Identifiziere die Bausteine der Materie
Auf seiner grundlegendsten Ebene besteht das Leben aus Materie. Materie ist jede Substanz, die Raum einnimmt und Masse hat. Elemente sind einzigartige Formen von Materie mit spezifischen chemischen und physikalischen Eigenschaften, die durch gewöhnliche chemische Reaktionen nicht in kleinere Stoffe zerlegt werden können. Es gibt 118 Elemente, aber nur 92 kommen in der Natur vor. Die übrigen Elemente werden in Labors synthetisiert und sind instabil.
Jedes Element wird durch sein chemisches Symbol bezeichnet, das aus einem einzigen Großbuchstaben besteht oder, wenn der erste Buchstabe bereits von einem anderen Element „besetzt“ ist, aus einer Kombination von zwei Buchstaben. Einige Elemente folgen der englischen Bezeichnung für das Element, wie z. B. C für Kohlenstoff und Ca für Calcium. Die chemischen Symbole anderer Elemente leiten sich von ihren lateinischen Namen ab; das Symbol für Natrium ist beispielsweise Na und bezieht sich auf Natrium, das lateinische Wort für Natrium.
Die vier Elemente, die allen lebenden Organismen gemeinsam sind, sind Sauerstoff (O), Kohlenstoff (C), Wasserstoff (H) und Stickstoff (N). In der unbelebten Welt kommen die Elemente in unterschiedlichen Verhältnissen vor, und einige Elemente, die den lebenden Organismen gemeinsam sind, sind auf der Erde insgesamt relativ selten, wie in Tabelle 1 dargestellt. So ist die Atmosphäre reich an Stickstoff und Sauerstoff, enthält aber wenig Kohlenstoff und Wasserstoff, während die Erdkruste zwar Sauerstoff und eine geringe Menge Wasserstoff, aber wenig Stickstoff und Kohlenstoff enthält. Trotz ihrer unterschiedlichen Häufigkeit gehorchen alle Elemente und die chemischen Reaktionen zwischen ihnen denselben chemischen und physikalischen Gesetzen, unabhängig davon, ob sie Teil der lebenden oder der nicht lebenden Welt sind.
| Tabelle 1. Approximate Percentage of Elements in Living Organisms (Humans) Compared to the Non-living World | |||
|---|---|---|---|
| Element | Life (Humans) | Atmosphere | Earth’s Crust |
| Oxygen (O) | 65% | 21% | 46% |
| Carbon (C) | 18% | trace | trace |
| Hydrogen (H) | 10% | trace | 0.1% |
| Nitrogen (N) | 3% | 78% | trace |
Learning Objectives
- Draw a diagram of an atom, according to current scientific understanding
- Understand the periodic table of elements and how to use it to understand elements
- Describe the behavior and location of electrons, und wie diese Faktoren die Bildung von Bindungen zwischen Atomen beeinflussen
Atome
Die Struktur des Atoms
Um zu verstehen, wie sich Elemente zusammensetzen, müssen wir zunächst den kleinsten Bestandteil oder Baustein eines Elements, das Atom, erörtern. Ein Atom ist die kleinste Einheit der Materie, die alle chemischen Eigenschaften eines Elements besitzt. Ein Goldatom hat zum Beispiel alle Eigenschaften von Gold, da es bei Raumtemperatur ein festes Metall ist. Eine Goldmünze besteht einfach aus einer sehr großen Anzahl von Goldatomen, die in die Form einer Münze gebracht wurden und kleine Mengen anderer Elemente enthalten, die als Verunreinigungen bekannt sind. Goldatome können nicht in etwas Kleineres zerlegt werden, ohne dass die Eigenschaften von Gold verloren gehen.
Ein Atom besteht aus zwei Bereichen: dem Kern, der sich im Zentrum des Atoms befindet und Protonen und Neutronen enthält, und dem äußersten Bereich des Atoms, in dem sich die Elektronen auf einer Umlaufbahn um den Kern befinden, wie in Abbildung 1 dargestellt. Atome enthalten neben anderen subatomaren Teilchen Protonen, Elektronen und Neutronen. Die einzige Ausnahme ist Wasserstoff (H), der aus einem Proton und einem Elektron ohne Neutronen besteht.

Abbildung 1. Elemente, wie das hier abgebildete Helium, bestehen aus Atomen. Atome bestehen aus Protonen und Neutronen, die sich im Kern befinden, und Elektronen in Orbitalen, die den Kern umgeben.
Protonen und Neutronen haben ungefähr die gleiche Masse, etwa 1,67 × 10-24 Gramm. Wissenschaftler definieren diese Menge an Masse willkürlich als eine atomare Masseneinheit (amu) oder ein Dalton, wie in Tabelle 1 dargestellt. Obwohl sich Protonen und Neutronen in ihrer Masse ähneln, unterscheiden sie sich in ihrer elektrischen Ladung. Ein Proton ist positiv geladen, während ein Neutron ungeladen ist. Daher trägt die Anzahl der Neutronen in einem Atom wesentlich zu seiner Masse, nicht aber zu seiner Ladung bei. Elektronen haben eine viel geringere Masse als Protonen und wiegen nur 9,11 × 10-28 Gramm, also etwa 1/1800 einer atomaren Masseneinheit. Daher tragen sie nicht viel zur gesamten Atommasse eines Elements bei. Daher ist es üblich, bei der Betrachtung der Atommasse die Masse der Elektronen zu ignorieren und die Masse des Atoms allein auf der Grundlage der Anzahl der Protonen und Neutronen zu berechnen. Die Elektronen tragen zwar nicht wesentlich zur Masse bei, tragen aber erheblich zur Ladung des Atoms bei, da jedes Elektron eine negative Ladung hat, die der positiven Ladung eines Protons entspricht. In ungeladenen, neutralen Atomen ist die Anzahl der Elektronen, die den Kern umkreisen, gleich der Anzahl der Protonen im Inneren des Kerns. In these atoms, the positive and negative charges cancel each other out, leading to an atom with no net charge.
Accounting for the sizes of protons, neutrons, and electrons, most of the volume of an atom—greater than 99 percent—is, in fact, empty space. With all this empty space, one might ask why so-called solid objects do not just pass through one another. The reason they do not is that the electrons that surround all atoms are negatively charged and negative charges repel each other.
| Table 1. Protons, Neutrons, and Electrons | |||
|---|---|---|---|
| Charge | Mass (amu) | Location | |
| Proton | +1 | 1 | nucleus |
| Neutron | 0 | 1 | Kern |
| Elektron | -1 | 0 | Orbitale |
Atomzahl und Masse
Atome eines jeden Elements enthalten eine charakteristische Anzahl von Protonen und Elektronen. Die Anzahl der Protonen bestimmt die Ordnungszahl eines Elements und dient dazu, ein Element von einem anderen zu unterscheiden. Die Anzahl der Neutronen ist variabel und führt zu Isotopen, d. h. verschiedenen Formen desselben Atoms, die sich nur in der Anzahl der Neutronen unterscheiden. Die Anzahl der Protonen und die Anzahl der Neutronen bestimmen zusammen die Massenzahl eines Elements, wie in Abbildung 2 dargestellt. Beachten Sie, dass der geringe Beitrag der Elektronen zur Masse bei der Berechnung der Massenzahl vernachlässigt wird. Mit diesem Näherungswert für die Masse lässt sich leicht berechnen, wie viele Neutronen ein Element hat, indem man einfach die Anzahl der Protonen von der Massenzahl abzieht. Da die Isotope eines Elements leicht unterschiedliche Massenzahlen haben, bestimmen die Wissenschaftler auch die Atommasse, die der berechnete Mittelwert der Massenzahl für die natürlich vorkommenden Isotope ist. Oft enthält die resultierende Zahl einen Bruchteil. Die Atommasse von Chlor (Cl) beträgt beispielsweise 35,45, weil Chlor aus mehreren Isotopen besteht, von denen einige (die Mehrheit) die Atommasse 35 (17 Protonen und 18 Neutronen) und einige die Atommasse 37 (17 Protonen und 20 Neutronen) haben.
Praxisfrage
Kohlenstoff hat eine Ordnungszahl von sechs und zwei stabile Isotope mit den Massenzahlen zwölf bzw. dreizehn. Seine Atommasse beträgt 12,11.

Abbildung 2. Kohlenstoff-12 und Kohlenstoff-13
Wie viele Neutronen haben Kohlenstoff-12 bzw. Kohlenstoff-13?
Das Periodensystem der Elemente
Die verschiedenen Elemente sind im Periodensystem angeordnet und dargestellt. Es wurde 1869 von dem russischen Chemiker Dmitri Mendelejew (1834-1907) entwickelt und gruppiert Elemente, die zwar einzigartig sind, aber bestimmte chemische Eigenschaften mit anderen Elementen gemeinsam haben. Die Eigenschaften der Elemente sind für ihren physikalischen Zustand bei Raumtemperatur verantwortlich: Sie können gasförmig, fest oder flüssig sein. Sie können gasförmig, fest oder flüssig sein. Elemente haben auch eine bestimmte chemische Reaktivität, d. h. die Fähigkeit, sich miteinander zu verbinden und chemische Bindungen einzugehen.
Im Periodensystem, das in Abbildung 3 dargestellt ist, werden die Elemente nach ihrer Ordnungszahl geordnet und in einer Reihe von Zeilen und Spalten auf der Grundlage gemeinsamer chemischer und physikalischer Eigenschaften angezeigt. Das Periodensystem enthält nicht nur die Ordnungszahl für jedes Element, sondern auch die Atommasse des Elements. Bei Kohlenstoff beispielsweise erscheinen das Symbol (C) und der Name sowie die Ordnungszahl von sechs (in der oberen linken Ecke) und die Atommasse von 12,11.

Abbildung 3. Das Periodensystem zeigt die Atommasse und die Ordnungszahl der einzelnen Elemente. Die Ordnungszahl steht über dem Symbol des Elements und die ungefähre Atommasse darunter.
Das Periodensystem gruppiert die Elemente nach ihren chemischen Eigenschaften. Die Unterschiede in der chemischen Reaktivität zwischen den Elementen beruhen auf der Anzahl und der räumlichen Verteilung der Elektronen eines Atoms. Atome, die chemisch reagieren und sich miteinander verbinden, bilden Moleküle. Moleküle sind einfach zwei oder mehr Atome, die chemisch miteinander verbunden sind. Wenn sich zwei Atome chemisch zu einem Molekül verbinden, kommen ihre Elektronen, die den äußersten Bereich jedes Atoms bilden, logischerweise zuerst zusammen, wenn die Atome eine chemische Bindung eingehen.
Schauen Sie sich dieses Video für eine ausführlichere Einführung in das Periodensystem an:
Elektronenschalen und das Bohrsche Modell

Abbildung 4. Das Bohrsche Modell.

Abbildung 4. Das Bohrsche Modell.
Es sollte betont werden, dass es einen Zusammenhang zwischen der Anzahl der Protonen in einem Element, der Ordnungszahl, die ein Element von einem anderen unterscheidet, und der Anzahl der Elektronen gibt. In allen elektrisch neutralen Atomen ist die Anzahl der Elektronen gleich der Anzahl der Protonen. Somit hat jedes Element, zumindest wenn es elektrisch neutral ist, eine charakteristische Anzahl von Elektronen, die seiner Ordnungszahl entspricht.
Ein frühes Modell des Atoms wurde 1913 von dem dänischen Wissenschaftler Niels Bohr (1885-1962) entwickelt. In diesem Modell existieren die Elektronen in Hauptschalen. Ein Elektron befindet sich normalerweise in der Schale mit der niedrigsten Energie, die dem Atomkern am nächsten ist. Die Energie eines Lichtphotons kann es in eine Schale mit höherer Energie befördern, aber diese Situation ist instabil, und das Elektron zerfällt schnell wieder in den Grundzustand. Dabei wird ein Lichtphoton freigesetzt.
Nach dem Bohr’schen Modell besteht das Atom aus einem zentralen Kern mit Protonen und Neutronen, wobei sich die Elektronen in kreisförmigen Orbitalen in bestimmten Abständen vom Kern befinden, wie in Abbildung 4 dargestellt. Diese Umlaufbahnen bilden Elektronenschalen oder Energieniveaus, mit denen die Anzahl der Elektronen in den äußersten Schalen veranschaulicht werden kann. Diese Energieniveaus werden mit einer Zahl und dem Symbol „n“ bezeichnet. Zum Beispiel steht 1n für das erste Energieniveau, das dem Kern am nächsten liegt.
Elektronen füllen Orbitale in einer konsistenten Reihenfolge: Sie füllen zuerst die Orbitale, die dem Kern am nächsten sind, dann füllen sie Orbitale mit zunehmender Energie in größerer Entfernung vom Kern. Wenn es mehrere Orbitale gleicher Energie gibt, werden sie in jedem Energieniveau mit einem Elektron gefüllt, bevor ein zweites Elektron hinzugefügt wird. Die Elektronen des äußersten Energieniveaus bestimmen die energetische Stabilität des Atoms und seine Neigung, mit anderen Atomen chemische Bindungen einzugehen, um Moleküle zu bilden.
Unter Standardbedingungen füllen Atome zuerst die inneren Schalen, was oft zu einer variablen Anzahl von Elektronen in der äußersten Schale führt. Die innerste Schale hat maximal zwei Elektronen, aber die nächsten beiden Elektronenschalen können jeweils bis zu acht Elektronen haben. Dies ist als Oktettregel bekannt, die besagt, dass Atome mit Ausnahme der innersten Schale energetisch stabiler sind, wenn sie acht Elektronen in ihrer Valenzschale, der äußersten Elektronenschale, haben. Beispiele für einige neutrale Atome und ihre Elektronenkonfigurationen sind in Abbildung 5 dargestellt. Man beachte, dass Helium in dieser Abbildung eine vollständige äußere Elektronenschale hat, wobei zwei Elektronen seine erste und einzige Schale ausfüllen. Ebenso hat Neon eine vollständige äußere 2n-Schale mit acht Elektronen. Im Gegensatz dazu haben Chlor und Natrium sieben bzw. eins in ihren äußeren Schalen, aber theoretisch wären sie energetisch stabiler, wenn sie der Oktettregel folgten und acht hätten.
Praxisfrage
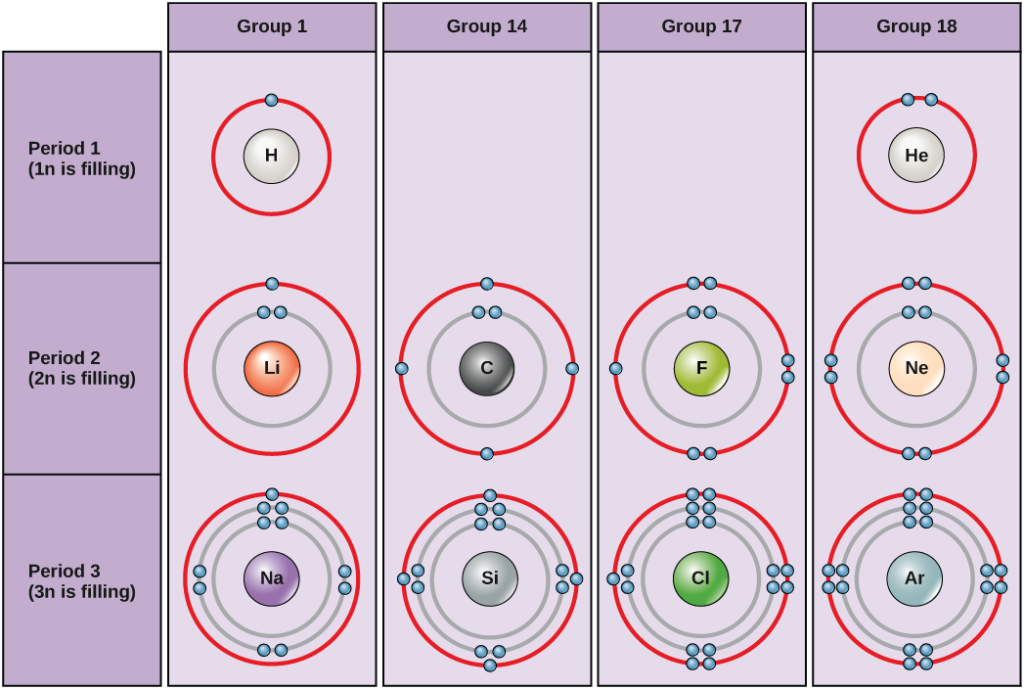
Abbildung 5. Bohr-Diagramme für Wasserstoff, Helium, Lithium, Kohlenstoff, Fluor, Neon, Natrium, Silizium, Chlor und Argon.
Bohr-Diagramme geben an, wie viele Elektronen jede Hauptschale füllen. Die Elemente der Gruppe 18 (Helium, Neon und Argon sind in Abbildung 5 dargestellt) haben eine volle äußere Schale, die Valenzschale. Eine volle Valenzschale ist die stabilste Elektronenkonfiguration. Elemente in anderen Gruppen haben teilweise gefüllte Valenzschalen und gewinnen oder verlieren Elektronen, um eine stabile Elektronenkonfiguration zu erreichen.
Ein Atom kann Elektronen abgeben, nehmen oder mit einem anderen Atom teilen, um eine volle Valenzschale, die stabilste Elektronenkonfiguration, zu erreichen. Wie viele Elektronen müssen die Elemente der Gruppe 1 verlieren, um eine stabile Elektronenkonfiguration zu erreichen? Wie viele Elektronen müssen die Elemente der Gruppen 14 und 17 gewinnen, um eine stabile Konfiguration zu erreichen?
Das Verständnis, dass die Organisation des Periodensystems auf der Gesamtzahl der Protonen (und Elektronen) basiert, hilft uns zu wissen, wie die Elektronen auf die äußere Schale verteilt sind. Das Periodensystem ist in Spalten und Zeilen gegliedert, die sich nach der Anzahl der Elektronen und der Position dieser Elektronen richten. Schauen Sie sich einige der Elemente in der rechten Spalte des Periodensystems in Abbildung 3 genauer an.
Die Atome der Gruppe 18, Helium (He), Neon (Ne) und Argon (Ar), haben alle gefüllte äußere Elektronenschalen, so dass sie keine Elektronen mit anderen Atomen teilen müssen, um Stabilität zu erreichen; sie sind als einzelne Atome sehr stabil. Ihre Nicht-Reaktivität hat dazu geführt, dass sie als Edelgase bezeichnet werden. Vergleichen Sie dies mit den Elementen der Gruppe 1 in der linken Spalte. Diese Elemente, darunter Wasserstoff (H), Lithium (Li) und Natrium (Na), haben alle ein Elektron in ihrer äußersten Schale. Das bedeutet, dass sie eine stabile Konfiguration und eine gefüllte äußere Schale erreichen können, indem sie ein Elektron an ein anderes Atom oder ein Molekül wie z. B. Wasser abgeben oder mit ihm teilen. Wasserstoff spendet oder teilt sein Elektron, um diese Konfiguration zu erreichen, während Lithium und Natrium ihr Elektron spenden, um stabil zu werden. Infolge des Verlusts eines negativ geladenen Elektrons werden sie zu positiv geladenen Ionen. Die Elemente der Gruppe 17, zu denen auch Fluor und Chlor gehören, haben sieben Elektronen in ihrer äußersten Schale, so dass sie dazu neigen, diese Schale mit einem Elektron aus anderen Atomen oder Molekülen aufzufüllen, wodurch sie zu negativ geladenen Ionen werden. Die Elemente der Gruppe 14, von denen Kohlenstoff für lebende Systeme am wichtigsten ist, haben vier Elektronen in ihrer äußeren Schale, was es ihnen ermöglicht, mehrere kovalente Bindungen (siehe unten) mit anderen Atomen einzugehen. Die Spalten des Periodensystems stellen also den potenziell gemeinsamen Zustand der äußeren Elektronenschalen dieser Elemente dar, der für ihre ähnlichen chemischen Eigenschaften verantwortlich ist.
Elektronenorbitale
Obwohl das Bohrsche Modell des Atoms nützlich ist, um die Reaktivität und die chemischen Bindungen bestimmter Elemente zu erklären, spiegelt es nicht genau wider, wie die Elektronen in der Umgebung des Kerns räumlich verteilt sind. Sie kreisen nicht um den Kern wie die Erde um die Sonne, sondern befinden sich in Elektronenorbitalen. Diese relativ komplexen Formen ergeben sich aus der Tatsache, dass sich Elektronen nicht nur wie Teilchen, sondern auch wie Wellen verhalten. Mathematische Gleichungen aus der Quantenmechanik, die so genannten Wellenfunktionen, können mit einer gewissen Wahrscheinlichkeit vorhersagen, wo sich ein Elektron zu einem bestimmten Zeitpunkt befinden könnte. Der Bereich, in dem sich ein Elektron am wahrscheinlichsten aufhält, wird als Orbital bezeichnet.

Abbildung 6. Klicken Sie für eine größere Darstellung. Die s-Unterschalen sind wie Kugeln geformt. Sowohl die 1n- als auch die 2n-Hauptschale haben ein s-Orbital, aber die Größe der Kugel ist beim 2n-Orbital größer. Jede Kugel ist ein einzelnes Orbital. Die p-Unterschalen bestehen aus drei hantelförmigen Orbitalen. Die Hauptschale 2n hat eine p-Unterschale, die Schale 1 jedoch nicht.
Erinnern Sie sich, dass das Bohr-Modell die Elektronenschalenkonfiguration eines Atoms darstellt. Innerhalb jeder Elektronenschale gibt es Unterschalen, und jede Unterschale hat eine bestimmte Anzahl von Orbitalen, die Elektronen enthalten. Obwohl es unmöglich ist, genau zu berechnen, wo sich ein Elektron befindet, wissen die Wissenschaftler, dass es sich höchstwahrscheinlich innerhalb seiner Orbitalbahn befindet. Die Unterschalen werden mit den Buchstaben s, p, d und f bezeichnet. Die Unterschale s ist kugelförmig und hat ein Orbital. Die Hauptschale 1n hat nur ein einziges s-Orbital, das zwei Elektronen aufnehmen kann. Die Hauptschale 2n hat eine s- und eine p-Unterschale, die insgesamt acht Elektronen aufnehmen kann. Die p-Unterschale hat drei hantelförmige Orbitale, wie in Abbildung 6 dargestellt. Die Unterschalen d und f haben eine komplexere Form und enthalten fünf bzw. sieben Orbitale. Diese sind in der Abbildung nicht dargestellt. Die Hauptschale 3n hat s-, p- und d-Unterschalen und kann 18 Elektronen aufnehmen. Die Hauptschale 4n hat s-, p-, d- und f-Orbitale und kann 32 Elektronen aufnehmen. Mit zunehmender Entfernung vom Kern nimmt die Anzahl der Elektronen und Orbitale in den Energieniveaus zu. Wenn man im Periodensystem von einem Atom zum nächsten geht, kann man die Elektronenstruktur berechnen, indem man ein zusätzliches Elektron in das nächste verfügbare Orbital einpasst.
Das dem Kern am nächsten liegende Orbital, das so genannte 1s-Orbital, kann bis zu zwei Elektronen aufnehmen. Dieses Orbital entspricht der innersten Elektronenschale des Bohrschen Atommodells. Es wird als 1s-Orbital bezeichnet, weil es kugelförmig um den Atomkern herum verläuft. Das 1s-Orbital ist das dem Kern am nächsten gelegene Orbital und wird immer zuerst besetzt, bevor ein anderes Orbital besetzt werden kann. Wasserstoff hat ein Elektron; daher ist nur eine Stelle im 1s-Orbital besetzt. Diese wird als 1s1 bezeichnet, wobei die hochgestellte 1 das eine Elektron im 1s-Orbital bezeichnet. Helium hat zwei Elektronen und kann daher das 1s-Orbital mit seinen beiden Elektronen vollständig besetzen. Dies wird als 1s2 bezeichnet, was sich auf die beiden Elektronen des Heliums im 1s-Orbital bezieht. Im Periodensystem (Abbildung 6) sind Wasserstoff und Helium die einzigen beiden Elemente in der ersten Reihe (Periode), weil sie nur in ihrer ersten Schale, dem 1s-Orbital, Elektronen haben. Wasserstoff und Helium sind die einzigen beiden Elemente, die im elektrisch neutralen Zustand das 1s und keine anderen Elektronenorbitale besitzen.
Die zweite Elektronenschale kann acht Elektronen enthalten. Diese Schale enthält ein weiteres kugelförmiges s-Orbital und drei „hantelförmige“ p-Orbitale, von denen jedes zwei Elektronen aufnehmen kann, wie in Abbildung 6 dargestellt. Nachdem das 1s-Orbital gefüllt ist, wird die zweite Elektronenschale gefüllt, wobei zuerst das 2s-Orbital und dann die drei p-Orbitale gefüllt werden. Beim Auffüllen der p-Orbitale nimmt jedes ein einzelnes Elektron auf; sobald jedes p-Orbital ein Elektron hat, kann ein zweites hinzugefügt werden. Lithium (Li) enthält drei Elektronen, die die erste und zweite Schale besetzen. Zwei Elektronen besetzen das 1s-Orbital, und das dritte Elektron besetzt das 2s-Orbital. Seine Elektronenkonfiguration ist 1s22s1. Neon (Ne) hingegen hat insgesamt zehn Elektronen: zwei im innersten 1s-Orbital und acht in der zweiten Schale (je zwei im 2s-Orbital und drei im p-Orbital); es ist also ein Edelgas und energetisch stabil als Einzelatom, das nur selten eine chemische Bindung mit anderen Atomen eingeht. Größere Elemente haben zusätzliche Orbitale, die die dritte Elektronenschale bilden. Die Konzepte von Elektronenschalen und Orbitalen sind zwar eng miteinander verwandt, doch bieten Orbitale eine genauere Darstellung der Elektronenkonfiguration eines Atoms, da das Orbitalmodell die verschiedenen Formen und speziellen Ausrichtungen aller Plätze spezifiziert, die Elektronen einnehmen können.
In dieser visuellen Animation sehen Sie die räumliche Anordnung der p- und s-Orbitale. Note that this video has no audio.
Video Review
This video gives another overview of the electron:
Check Your Understanding
Answer the question(s) below to see how well you understand the topics covered in the previous section. This short quiz does not count toward your grade in the class, and you can retake it an unlimited number of times.
Use this quiz to check your understanding and decide whether to (1) study the previous section further or (2) move on to the next section.