Ein Elektrolyt ist eine chemische Verbindung, die in Ionen dissoziiert und damit elektrische Ladung transportieren kann – d.h. ein Elektrolyt ist ein elektrischer Leiter; im Gegensatz zu Metallen ist der Ladungsfluss kein Elektronenfluss, sondern eine Ionenbewegung.
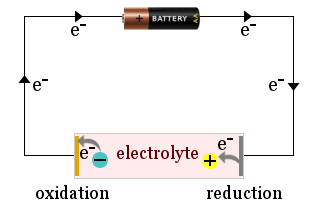
Das Diagramm zeigt zum Beispiel, wie eine Haushaltsbatterie verwendet wird, um Elektrolyt-Ionen an die Elektroden einer elektrochemischen Zelle zu ziehen, wo die Ionen Elektronen gewinnen (reduziert werden) oder Elektronen verlieren (oxidiert werden).
Manchmal reagieren die Elektroden selbst, zum Beispiel kann eine Metallelektrode oxidiert werden und Ionen in den Elektrolyten abgeben.
Elektrolyte können fest, flüssig oder in Lösungen vorliegen.
Beispiele für Elektrolyte
1. Geschmolzenes Natriumchlorid dient als Elektrolyt bei der Herstellung von Natriummetall. Dabei entsteht auch Chlorgas.
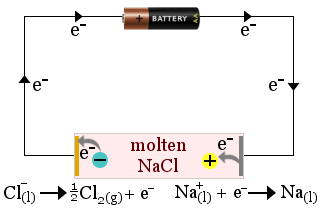 In diesem Fall wird der Elektrolyt durch die Redoxreaktionen der Zelle verbraucht.
In diesem Fall wird der Elektrolyt durch die Redoxreaktionen der Zelle verbraucht.
2. In Wasser gelöstes Kaliumhydroxid ergibt in der Edison-Zelle, einer frühen wiederaufladbaren Zelle, einen gut leitenden Elektrolyten.
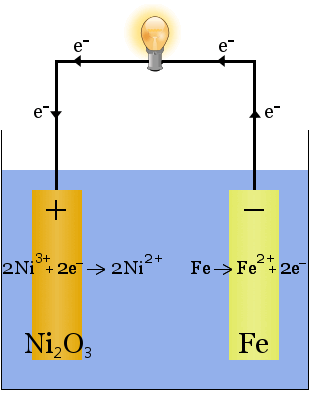
Im Gegensatz zur Natriumproduktion oben wird bei dieser Reaktion kein Elektrolyt verbraucht, sondern das Kaliumhydroxid hat die Aufgabe, die Verfügbarkeit von Ionen zu erhöhen, um die Leitfähigkeit des Elektrolyten zu steigern und den Stromkreis zu schließen.
Die chemischen Gleichungen für die Reaktionen an den Elektroden lauten:
Für die Entladung werden die Gleichungen von links nach rechts gelesen, für die Aufladung von rechts nach links.
3. Traditionell waren Elektrolyte Flüssigkeiten, um die Bewegung von Ionen zu ermöglichen, aber jetzt gibt es feste Materialien, die es den Ionen ermöglichen, sich leicht durch ihre Strukturen zu bewegen. Feste Elektrolyte sind in vielen Verbraucherprodukten wünschenswert, weil sie nicht auslaufen.
Lithium-Zinn-Phosphor-Sulfid, Li10SnP2S12, ist ein Festelektrolyt für den Einsatz in Lithium-Ionen-Batterien.
4. Elektrolyte sind enorm wichtig für die elektrochemischen Prozesse in lebenden Organismen.Die wichtigsten Ionen in diesen Elektrolyten sind Calcium (Ca2+), Magnesium (Mg2+), Natrium (Na+), Kalium (K+), Chlorid (Cl-), Hydrogencarbonat (HCO3-) und Hydrogenphosphat (HPO42-).
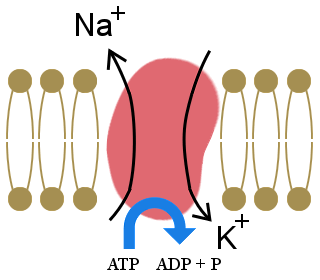
The importance of the sodium-potassium pump, shown in the diagram, to our lives is illustrated by the fact that it uses one-third of our resting energy.The pump maintains our cells‘ electrolyte balance, with excess potassium ions inside cells and excess sodium ions outside cells.
This concentration gradient creates a voltage across the cell wall, which allows electrical signals to be transmitted in neurons and in muscles.It also provides the energy for processes in cell-membranes.
