Das pseudophake zystoide Makulaödem (CME), auch Irvine-Gass-Syndrom genannt, führt zu einem schmerzlosen Sehverlust und tritt typischerweise 4 bis 6 Wochen nach der Kataraktoperation auf, obwohl Risikofaktoren für diese Komplikation oft schon viel früher erkannt werden können. Zu den Patienten mit einem erhöhten Risiko für CME gehören Patienten mit Diabetes mellitus ohne Retinopathie, Patienten mit Diabetes mit Retinopathie (relatives Risiko 1,80 bzw. 6,23), Patienten mit einer epiretinalen Membran in der Vorgeschichte (RR 5.60) oder Uveitis (RR 2,88) und Patienten mit retinalem Venenverschluss (RR 4,47).1
Die Aufklärung von Patienten, die ein erhöhtes Risiko für CME haben, vor dem Eingriff ist wichtig, da sie dazu beiträgt, ihre Beunruhigung zu lindern, sollte die Komplikation auftreten. Bestimmte intraoperative Komplikationen, wie z. B. eine hintere Kapselruptur und Linsenrückstände, erhöhen bekanntermaßen die Inzidenz von CME.2 Sollte der Patient eine der oben genannten Komplikationen erleiden, kann eine häufige Dilatation in der postoperativen Phase angezeigt sein, um die Erkennung von CME-Anzeichen zu unterstützen.
Nachfolgend finden Sie einige Perlen, die Sie bei der Betreuung von Kataraktpatienten im Auge behalten sollten.
RED FLAGS
Zu den vermuteten ätiologischen Faktoren für postoperative CME gehören Entzündung, vitreomakuläre Traktion und vaskuläre Instabilität. Die primäre Ursache scheinen unregulierte Entzündungsmediatoren im Kammerwasser und im Glaskörper als Folge der chirurgischen Manipulation zu sein. Diese Mediatoren (z. B. Leukotriene und Prostaglandine) stören die Blut-Kammerwasser- und Blut-Retina-Schranke und führen zu einer erhöhten Permeabilität.3 Der Zeitpunkt des typischen Auftretens von CME könnte darauf zurückzuführen sein, wie lange es dauert, bis diese Entzündungsmediatoren vom vorderen Augenabschnitt zum Augenhintergrund gelangen.
Der Verdacht auf ein CME wird durch einen verminderten Visus oder eine Metamorphopsie ausgelöst, die nicht durch andere Ursachen im Zusammenhang mit der Kataraktchirurgie erklärt werden können, wie z. B. Restrefraktionsfehler, Hornhautödem, Linsenfehlstellung oder hintere Kapseltrübung.
Ein visuell signifikantes CME ist relativ selten und tritt bei 0,1 bis 3,5 % der Augen nach einer Kataraktoperation auf.4-6 Ein nicht visuell signifikantes Makulaödem ist viel häufiger. Es tritt bei 3 % bis 41 % der mit OCT untersuchten Augen und bei 20 % bis 55 % der mit Fluoreszeinangiographie untersuchten Augen auf.7
Die Notwendigkeit einer OCT-Untersuchung sollte anhand des Visus und der Symptome des Patienten festgestellt werden. Unscharfes Sehen bei Fehlen anderer Befunde erfordert eine sorgfältige Fundusuntersuchung und ein Makula-OCT (Abbildung 1). Eine routinemäßige Bildgebung bei allen Patienten kann dazu führen, dass einige Patienten mit asymptomatischem CME identifiziert werden, was zu unnötigen Behandlungen und Ängsten der Patienten führt.
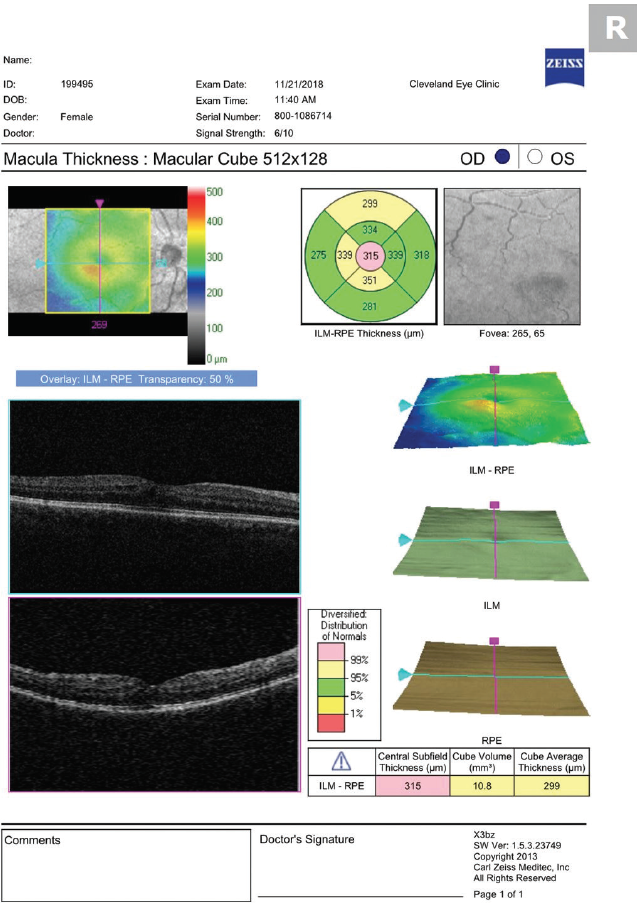
Abbildung 1. Das OCT, das 30 Tage nach der Kataraktoperation durchgeführt wurde, zeigt ein leichtes CME.
Behandlung von CME
Es gibt keinen Konsens, der den optimalen Bedarf an Prävention oder Behandlung von CME definiert. Es wurde festgestellt, dass eine prophylaktische Behandlung mit einem topischen nichtsteroidalen Antirheumatikum (NSAID) vor der Kataraktoperation das Auftreten von CME nach der Operation verringert; die visuellen Auswirkungen von CME, die dennoch auftraten, waren jedoch langfristig (>3 Monate) unbedeutend.8
Kürzlich erhielt Dexamethason intraokulare Suspension 9% (Dexycu, Eyepoint Pharmaceuticals) die FDA-Zulassung für die Injektion hinter die Iris zum Zeitpunkt der Kataraktoperation. Diese Formulierung hat sich als sicher und wirksam bei der Behandlung von Entzündungen nach Kataraktoperationen erwiesen und kann eine Alternative zur postoperativen Instillation von Steroidtropfen sein.9
Prophylaktische postoperative topische entzündungshemmende Medikamente verringern das Auftreten von CME. Eine Analyse von 30 randomisierten klinischen Studien, einschließlich unkomplizierter Kataraktoperationen bei nicht diabetischen Patienten, zeigte, dass postoperative topische NSAIDs die Wahrscheinlichkeit, ein CME zu entwickeln, im Vergleich zu postoperativen topischen Kortikosteroiden signifikant verringerten.10 Diese Analyse ergab auch, dass eine Kombination aus Kortikosteroiden und NSAIDs den topischen Kortikosteroiden allein überlegen war.
Wenn ein Patient trotz prophylaktischer Behandlung ein CME entwickelt, kann die Erkrankung im Allgemeinen mit topischen Medikamenten behandelt werden. Obwohl sich das Ödem im Laufe mehrerer Monate oft von selbst zurückbildet, ist eine topische NSAID-Therapie wirksam bei der Verringerung des OCT-erkannten CME und kann im Vergleich zu Placebo die Erholung des Sehvermögens nach der Operation beschleunigen.11 Die Kombination aus einem Kortikosteroid und einem NSAID scheint auch den beiden entzündungshemmenden Medikamenten allein überlegen zu sein. In einer Studie betrug die durchschnittliche Verbesserung des Snellen-Sehvermögens über 3 Monate 1,6 Linien bei Patienten, die ein NSAR erhielten, 1,1 Linien bei Patienten, die ein Steroid erhielten, und 3,8 Linien bei Patienten, die eine Kombination erhielten.12
In unserer Praxis verschreiben wir Prednisolonacetat 1 % und Ketorolac 0,5 %, die viermal täglich bis zum Abklingen des CME eingenommen werden, gefolgt von einer dreiwöchigen Reduktion. Wir verjüngen beide Medikamente auf Empfehlung der Netzhautgruppe, mit der wir zusammenarbeiten (dreimal täglich für eine Woche, dann zweimal täglich für eine Woche, gefolgt von einmal täglich für eine Woche). Seien Sie nicht beunruhigt, wenn sich der Schweregrad des CME kurz nach Beginn der topischen Therapie verschlechtert. Ähnlich wie beim verzögerten Auftreten des Ödems (das vermutlich auf die Zeit zurückzuführen ist, die die Entzündungsmediatoren benötigen, um die Netzhaut vom vorderen Augenabschnitt aus zu erreichen), dauert es auch eine gewisse Zeit, bis die Medikamente die Netzhaut von der Augenoberfläche aus erreichen (Abbildungen 2 und 3).
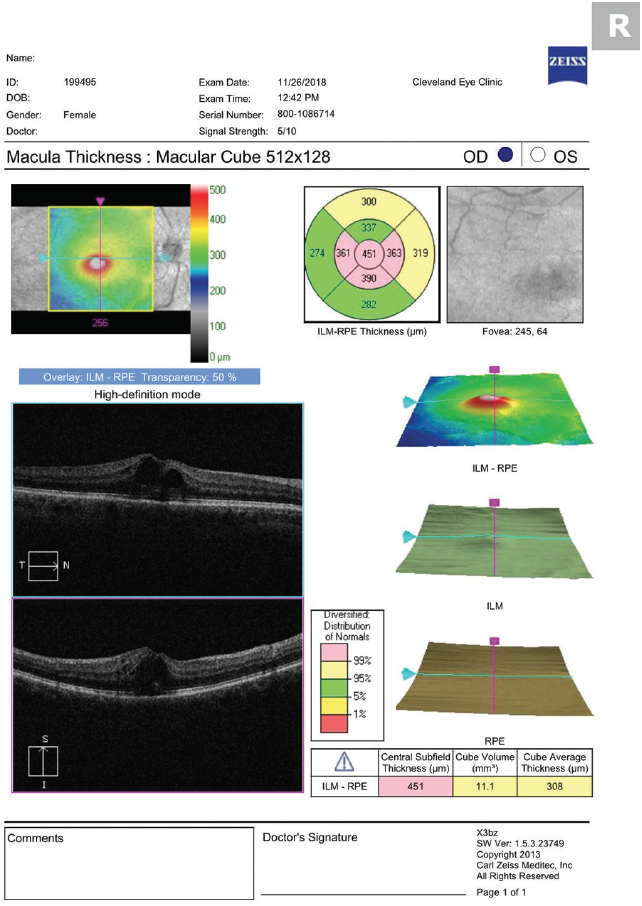
Abbildung 2. Das OCT, das 5 Tage nach Beginn der Behandlung mit Prednisolonacetat und Ketorolac viermal täglich durchgeführt wurde, zeigt eine Verschlechterung des CME.
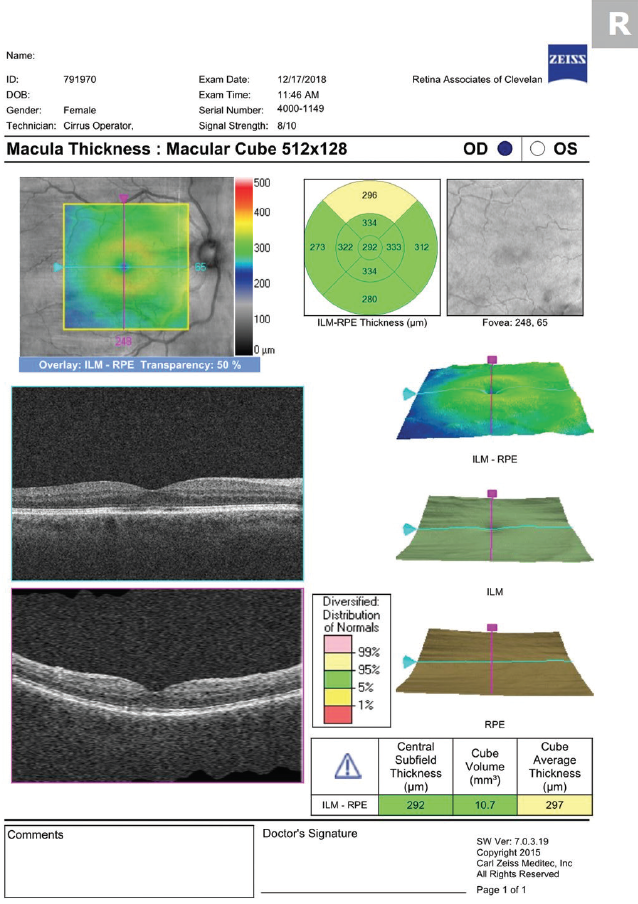
Abbildung 3. Die OCT-Untersuchung 1 Monat nach Beginn der Behandlung zeigt eine Auflösung des CME.
Rekurrierende CME erfordern oft weitere Maßnahmen zur Erholung der Sehkraft. Wenn strukturelle (OCT-Befunde) und funktionelle (VA) Verbesserungen nicht innerhalb eines Monats nach der topischen Behandlung eintreten, ist eine Überweisung an einen Netzhautspezialisten angezeigt. Periokulare Steroidinjektionen (sub-Tenon und retrobulbär) verringern nachweislich das Ödem und verbessern den Visus bei CME, das auf eine topische Behandlung nicht anspricht.13 Intraokulare Steroidinjektionen und intravitreale Implantate mit verlängerter Wirkstofffreisetzung haben die Ergebnisse bei Patienten mit chronischem CME ebenfalls verbessert.14
Anti-VEGF-Injektionen haben sich ebenfalls als vorteilhaft für die Behandlung von chronischem CME erwiesen. Eine multizentrische retrospektive Studie ergab, dass 72 % der Augen mit refraktärem CME, die mit mindestens einer intravitrealen Injektion von Bevacizumab (Avastin, Genentech) behandelt wurden, nach 12 Monaten eine Verbesserung des Sehvermögens und eine Verringerung der mittleren zentralen Makuladicke aufwiesen.15
In einigen Fällen müssen chirurgische Methoden zur Behandlung von CME eingesetzt werden. So kann zum Beispiel die chirurgische Entfernung von Linsenresten erforderlich sein, um ein rezidivierendes CME zu beheben. Auch die Pars-plana-Vitrektomie hat bei CME, das auf eine medikamentöse Therapie nicht anspricht, zu besseren Sehergebnissen geführt.16
TAKE-HOME POINTS
Bei der Betreuung von Kataraktpatienten zahlt es sich aus, häufige Komplikationen wie CME zu erkennen und zu wissen, wie man vorgeht, wenn sie entdeckt werden.
Zusammenfassend kann man sagen, dass Risikopatienten (Patienten mit Diabetes, epiretinaler Membran, Uveitis oder retinalem Venenverschluss) präoperativ erkannt werden sollten. Achten Sie auch auf intraoperative Komplikationen, die das Risiko eines CME erhöhen können (z. B. hintere Kapselruptur, zurückgebliebene Linsenfragmente). Schließen Sie andere Ursachen für postoperative Unschärfe aus und führen Sie eine sorgfältige Dilatationsuntersuchung und ein Makula-OCT durch, um CME zu identifizieren. Klären Sie den Patienten auf und versichern Sie ihm, dass CME eine behandelbare Erkrankung ist. Behandeln Sie topisch mit NSAIDs und Steroiden und überweisen Sie den Patienten an einen Netzhautspezialisten, um weitere Maßnahmen zu ergreifen, wenn das CME rezidivierend ist.
1. Henderson BA, Kim JY, Ament CS, Ferrufino-Ponce ZK, Grabowska A, Cremers SL. Klinisches pseudophakes zystoides Makulaödem. Risikofaktoren für die Entstehung und Dauer nach der Behandlung. J Cataract Refract Surg. 2007;33(9):1550-1558.
2. Kim SJ, Belair ML, Bressler NM, et al. A method of reporting macular edema after cataract surgery using optical coherence tomography. Retina. 2008;28(6):870-876.
3. Benitah NR, Arroyo JG. Pseudophakic cystoid macular edema. Int Ophthalmol Clin. 2010;50(1):139-153.
4. Powe NR, Schein OD, Gieser SC, et al. Synthesis of the literature on visual acuity and complications following cataract extraction with intraocular lens implantation. Cataract Patient Outcome Research Team. Arch Ophthalmol. 1994;112(2):239-252.
5. Greenberg PB, Tseng VL, Wu WC, et al. Prävalenz und Prädiktoren von okulären Komplikationen im Zusammenhang mit Kataraktoperationen bei Veteranen in den Vereinigten Staaten. Ophthalmology. 2011;118(3):507-514.
6. Clark A, Morlet N, Ng JQ, et al. Whole population trends in complications of cataract surgery over 22 years in Western Australia. Ophthalmology. 2011;118(6):1055-1061.
7. Bélair ML, Kim SJ, Thorne JE, et al. Incidence of cystoid macular edema after cataract surgery in patients with and without uveitis using optical coherence tomography. Am J Ophthalmol. 2009;148(1):128-135.
8. Grzybowski A, Kim SJ. Substitution von Kortikosteroiden durch nichtsteroidale Antirheumatika: Ist dies durch evidenzbasierte Medizin gerechtfertigt? J Cataract Refract Surg. 2016;42(3):510-511.
9. Donnenfeld E, Holland E. Dexamethason intracameral drug-delivery suspension for inflammation associated with cataract surgery: a randomized, placebo-controlled, phase III trial. Ophthalmology. 2018;125(6):799-806.
10. Heier JS, Topping TM, Baumann W, et al. Ketorolac versus Prednisolon versus Kombinationstherapie bei der Behandlung des akuten pseudophaken zystoiden Makulaödems. Ophthalmology. 2000;107(11):2034-2039.
11. Kim SJ, Schoenberger SD, Thorne JE, Ehlers JP, Yeh S, Bakri SJ. Topische nichtsteroidale Antirheumatika und Kataraktchirurgie: ein Bericht der American Academy of Ophthalmology. Ophthalmology. 2015;122(11):2159-2168.
12. Shelsta HN, Jampol LM. Pharmakologische Therapie des pseudophakischen zystoiden Makulaödems: 2010 update. Retina. 2011;31(1):4-12.
13. Benhamou N, Massin P, Haouchine B, Audren F, Tadayoni R, Gaudric A. Intravitreal triamcinolone for refractory pseudophakic macular edema. Am J Ophthalmol. 2003;135(2):246-249.
14. Bellocq D, Korobelnik JF, Burillon C, et al. Effectiveness and safety of dexamethasone implants for post-surgical macular oedema including Irvine-Gass syndrome: the EPISODIC study. Br J Ophthalmol. 2015;99(7):979-983.
15. Arevalo JF, Maia M, Garcia-Amaris RA, et al; Pan-American Collaborative Retina Study Group. Intravitreal bevacizumab for refractory pseudophakic cystoid macular edema: The Pan-American Collaborative Retina Study Group results. Ophthalmology. 2009;116:1481-1487.
16. Cardone S, et al. The role of pars plana vitrectomy for pseudophakic cystoid macular edema. Invest Ophthalmol Vis Sci. 2003;44(7):3012.

Charles A. Roseman, OD
- Cleveland Eye Clinic, Ohio
- [email protected]
- Financial disclosure: None