Einleitung
Zwei gleichzeitig auftretende visuelle Signale werden schneller erkannt als jedes der beiden Signale allein (Hershenson, 1962; Raab, 1962). Ein Teil dieses redundanten Zieleffekts (RTE) kann stochastisch durch ein „Pferderennen“-Modell erklärt werden. Das heißt, wenn zwei Reize in parallelen und unabhängigen Kanälen verarbeitet werden, für die die Verarbeitungsgeschwindigkeit von Versuch zu Versuch zufällig variiert, gewinnt bei jeder Präsentation der schnellste Reiz das Rennen und erreicht die Erkennungsschwelle, um die Reaktion auszulösen; daher ist es im Durchschnitt wahrscheinlicher, dass zwei Reize zu einer schnelleren Reaktion führen als die durchschnittliche Reaktionszeit auf einen Reiz, der in einem der beiden Kanäle verarbeitet wird.
Analysen der kumulativen Häufigkeitsverteilungen haben jedoch gezeigt, dass es einen zusätzlichen Beitrag zum RTE gibt, der nicht durch ein Pferderennmodell zwischen zwei unabhängigen Kanälen erklärt werden kann. Miller (1982) schlug ein „Co-Aktivierungs“-Modell vor, bei dem die beiden Signale in einem Aktivierungspool summiert werden. Miniussi et al. (1998) zeigten, dass redundante Ziele zu kürzeren Latenzen für ereigniskorrelierte P1- und N1-Hirnpotenziale führen, was darauf hindeutet, dass die neuronale Summierung früh in der Sehbahn stattfindet. Experimente an Hemianopie-Patienten haben auch gezeigt, dass die RTE nicht vollständig durch ein Wettrennen um das Erreichen der Erkennungsschwelle erklärt werden kann, da eine RTE auch ohne phänomenales Bewusstsein für einen der beiden Reize auftreten kann (Marzi et al., 1986; Tomaiuolo, 1997; de Gelder et al., 2001; Leh et al., 2006a,b). Tatsächlich erzeugt ein redundantes Ziel im blinden Feld bei Hemisphärektomie-Patienten nicht nur ein RTE, sondern das RTE wird verstärkt, wenn der redundante Reiz ein Gestaltmuster vervollständigt (Georgy et al., 2016). Diese Beobachtungen bei Hemianopics deuten darauf hin, dass die neuronale Summierung subkortikal stattfindet und nicht vom primären visuellen Kortex abhängt.
Die kumulative indirekte Evidenz hat den Superior Colliculus (SC) als Substrat für die neuronale Summierung, die zum RTE beiträgt, impliziert. Direkte Beweise wurden jedoch bisher nicht erbracht. In der aktuellen Studie wird der neuronale Pfad untersucht, der die visuellen Signale, die im SC integriert werden, weiterleitet. Der SC besteht aus oberflächlichen und tiefen Schichten. Die tiefen Schichten des Colliculus erhalten Afferenzen, sowohl direkt als auch über die Basalganglien, vom okulomotorischen Kortex (Hikosaka und Wurtz, 1983; Pare und Wurtz, 1997; Sommer und Wurtz, 2000). Visuelle Afferenzen zu den oberflächlichen Schichten des Colliculus werden jedoch sowohl von der Retina (über den retino-tektalen Trakt) als auch vom frühen visuellen Kortex (Fries, 1984) über das Brachium des SC übertragen.
Da neurale Summationseffekte bei neurologischen Patienten ohne visuellen Kortex nachgewiesen wurden, könnten die im Colliculus summierten visuellen Signale direkt von der Retina über den retino-tektalen Trakt zu den oberflächlichen Schichten des Colliculus übertragen werden. Wenn dies der Fall ist, könnte die neuronale Summierung durch Läsionen des Brachiums des SC aufgehoben werden.
Läsionen, die das Brachium des SC unterbrechen, sind sehr selten. Hier berichten wir über Einzelfallstudien von zwei Patienten mit unilateralen subkortikalen Läsionen, die den SC vom visuellen Input abkoppelten und bei denen keine RTE auftrat. Ein Patient hatte eine Läsion, die sowohl den Nucleus pulvinaris des Thalamus als auch den rostralen SC und dessen Brachium schädigte. Bei dem anderen Patienten mit einer Schädigung des dorsalen Mittelhirns infolge eines Schädel-Hirn-Traumas schien der SC intakt zu sein, aber sein Brachium war gestört.
Materialien und Methoden
Teilnehmer
Zwei neurologische Patienten wurden zusammen mit einer altersgleichen Kontrollgruppe in einem Experiment zur Messung des RTE getestet.
RE war zum Zeitpunkt der Tests 71 Jahre alt. Eine posteriore Thalamusblutung drei Jahre zuvor zerstörte den medialen Pulvinar, die ventro-lateralen Thalamuskerne und den hinteren Teil der inneren Kapsel mit einer Schädigung, die sich bis ins dorsale Mittelhirn einschließlich des Prätektums und des rostralen SC ausdehnte (Abbildung 1). Probabilistische DTI-Traktographie (Behrens et al., 2003, Behrens et al., 2007) bestätigte, dass die Läsion das Brachium des SC zerstörte (Abbildung 2). RE war auf der linken Körperseite gelähmt, mit Gefühlsverlust im linken Gesicht und Arm. Sie hatte abnorme Augenbewegungen, einschließlich Lidrückzug, gelähmte vertikale Augenbewegungen und beeinträchtigte Konvergenz, die eine Folge der Ausdehnung der Läsion in das dorsale Mittelhirn waren.
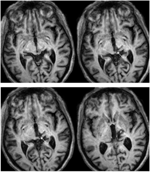
ABBILD 1: Hochauflösende (0,7 mm3) T1-gewichtete MRT der Patientin RE. Axiale Schnitte von ventral (oben links) nach dorsal (unten rechts) zeigen die Läsion im rechten dorsalen Mittelhirn und Thalamus. Ausdehnung der Läsion in den rostralen Colliculus superior (SC) durch weiße Pfeile dargestellt.
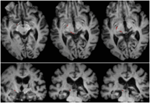
Abbildung 2. Traktographie zur Darstellung des Retinotektaltrakts bei Patient RE, koregistriert mit T1-gewichteten axialen Schichten (oben von ventral nach dorsal) und koronalen Schichten (unten von anterior nach posterior). Der Verlauf des Retinotektaltrakts ist in der linken Hemisphäre dargestellt (rot). In der rechten Hemisphäre wurde keine Stromlinie nachgezeichnet, und im Vergleich mit der intakten Hemisphäre ist zu erkennen, dass die Läsion das Brachium des SC in der rechten Hemisphäre zerstört hat. Die in rot dargestellte Stromlinie wurde mit probabilistischer Traktographie unter Verwendung von FSL FDT (FMRIB Diffusion Toolbox; Behrens et al., 2003, Behrens et al., 2007; http://fsl.fmrib.ox.ac.uk/fsl/fslwiki) erzeugt. Diffusionsgewichtete echoplanare Magnetresonanzbilder wurden mit einer Auflösung von 1,5 mm3 mit 32 isotrop verteilten diffusionskodierenden Richtungen (b = 800) und einer Basislinie (b = 0) aufgenommen. Wiederholungszeit = 2 s und Echozeit = 35 ms. Für die probabilistische Traktographie markierten wir manuell die Startregion (d. h. wir zeichneten Seed-Masken) auf dem Sehnervengang jeder Hemisphäre unmittelbar hinter dem Chiasma und eine Zielregion (Zielmaske) auf dem SC.
Zum Zeitpunkt der Untersuchung war die Patientin 23 Jahre alt. Sie hatte 7 Jahre zuvor bei einem Verkehrsunfall ein schweres Schädel-Hirn-Trauma erlitten, das zu einer diffusen axonalen Verletzung mit Einblutung in das rechte Putamen und das dorsale Mittelhirn führte. Einzelheiten zu ihrer Anamnese, der neurologischen Untersuchung und den Ergebnissen der bildgebenden Verfahren wurden in (Poliva et al., 2015) beschrieben. Obwohl links einige motorische Beeinträchtigungen, einschließlich Spastizität und Ataxie, vorhanden waren, hatte sie ihre Unabhängigkeit wiedererlangt. Ihre Hauptbehinderung war eine schwere auditorische Agnosie aufgrund einer Schädigung der Hirnstamm-Audiobahnen, einschließlich des linken Colliculus inferior. Die Sehschärfe und das Gesichtsfeld waren nicht beeinträchtigt, und es gab keine visuelle Vernachlässigung oder Extinktion. Zu den okulomotorischen Anzeichen einer Mittelhirnstörung gehörten makroquadratische Zuckungen und Konvergenzspasmen beim vertikalen Blick (mehr nach unten als nach oben). Die hochauflösende MRT zeigte einen zystischen Hohlraum im rechten Putamen an der Stelle ihrer früheren Blutung und eine kleine periventrikuläre Läsion in der rechten unteren Pons, im Bereich des unteren Kleinhirnstiels (Abbildung 3). Der linke Colliculus inferior war fast vollständig abgerissen, nur sein medialer und kaudaler Teil blieb verschont. Die Schädigung erstreckte sich auf das laterale Prätektum und das Mittelhirntegmentum und zerstörte die Brachien des oberen und unteren Colliculus sowie ventral auf den Nucleus red. Die probabilistische DTI-Traktographie bestätigte, dass die Läsion das Brachium des SC zerstörte (Abbildung 4).
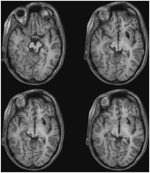
Abbildung 3: Hochauflösende (0,7 mm3) T1-gewichtete MRT von Patient ML. Axiale Schichten von ventral (oben links) nach dorsal (unten rechts) zeigen eine Schädigung des linken Colliculus inferior und des mesenzephalen Tegmentums ventral und lateral des SC.
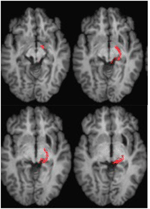
Abbildung 4. DTI-Traktographie bei Patient ML, die den retino-tektalen Trakt in der rechten Hemisphäre (rot) zeigt, koregistriert zu T1-gewichteten MR-Bildern in der axialen Ebene von ventral (oben links) nach dorsal (unten rechts). Diffusionsgewichtete echoplanare Magnetresonanzbilder wurden mit einer Auflösung von 2 mm3 mit 63 isotrop verteilten diffusionskodierenden Richtungen (b = 1000) und einer Basislinie (b = 0) aufgenommen. Wiederholungszeit = 2 s und Echozeit = 35 ms. Die Traktographie wurde wie in Abbildung 2 beschrieben durchgeführt.
Zu den neurologisch gesunden Kontrollpersonen für den Patienten RE gehörten 11 ältere Erwachsene (sechs Frauen und fünf Männer, Durchschnittsalter: 68,5, Spanne 59-73). Sie wurden aus dem Teilnehmerpanel der Universität Bangor rekrutiert. Die Teilnehmer hatten keine bekannten neurologischen, psychologischen, psychiatrischen oder kognitiven Beeinträchtigungen und alle Teilnehmer hatten eine normale/korrigierte bis normale Sehkraft. Die Teilnehmer erhielten für ihre Teilnahme ein Entgelt von 6 £.
Zu den neurologisch gesunden Kontrollpersonen für den Patienten ML gehörten 11 Studenten und Doktoranden der Universität Bangor im Alter von 18-26 Jahren (sieben Frauen und vier Männer).
Geräte und Betrachtungsbedingungen
Die auf einem PC laufende Programmiersoftware Presentation® zeichnete die Reaktionszeit (RT) auf und generierte Stimuli, die auf einem Dell-Monitor (12,5″ × 25″, Bildwiederholfrequenz 60 Hz) präsentiert wurden, der in Augenhöhe 57 cm vor den Teilnehmern bei gedämpftem Licht binokular betrachtet wurde. Eine Kinn- und Kopfstütze wurde verwendet, um die Stabilität des Kopfes zu gewährleisten. Die Antworten der Teilnehmer wurden durch Drücken der Leertaste auf einer Tastatur aufgezeichnet.
Stimuli
Die experimentellen Stimuli bestanden aus ungefüllten weißen Markierungsquadraten (1 cm × 1 cm), die 8° links und rechts von einem kleinen Fixationsfeld (0,2 cm × 0,2 cm) in der Mitte des Bildschirms angeordnet waren. Die Zielreize bestanden aus dem Ausfüllen eines oder beider peripherer Markierungsfelder, um ein durchgehendes weißes Quadrat zu erzeugen. Alle Stimuli waren weiß auf grauem Hintergrund.
Abbildung 5 zeigt den Ablauf eines einzelnen Versuchs. Die Markierungsfelder blieben während des gesamten Experiments sichtbar. Nach einem Intertrial-Intervall von 1750 ms erschien das Fixationsfeld, um den Versuch zu starten. Nach einem zufälligen Intervall von 250 bis 750 ms (in Schritten von 25 ms) erschien an der Stelle eines oder beider Markierungsfelder ein Ziel, das einen einfachen Tastendruck auf die Leertaste der Tastatur erforderte. Das Ziel war ein ausgefülltes weißes Quadrat, das durch Ausfüllen eines oder beider Markerfelder erzeugt wurde. Nach dem Zufallsprinzip und mit gleicher Wahrscheinlichkeit erschienen die Ziele auf der linken, der rechten oder auf beiden Seiten gleichzeitig. Bei Fangversuchen (10 % der Versuche) erschien kein Ziel.
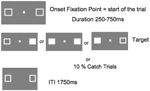
Abbildung 5. Anzeigesequenz eines einzelnen Versuchs (ITI, Inter-Trial-Intervall zwischen der Antwort des Teilnehmers und dem Beginn des Fixationspunktes, der den nächsten Versuch startet).
Vorgehensweise
Jeder Teilnehmer wurde in einer einzigen Sitzung getestet. Nach dem Lesen der Anweisungen auf dem Bildschirm wurden den Teilnehmern Beispiele aller Stimuli gezeigt, die in der Aufgabe präsentiert wurden (die Fixationsbox und jede der drei Zielpräsentationen), und sie wurden gebeten, die Erkennung jedes Ziels durch Drücken der Leertaste zu bestätigen. Die Anweisungen lauteten, die Fixierung auf das zentrale Feld für die Dauer jedes Versuchs aufrechtzuerhalten und so schnell wie möglich zu reagieren, indem die Leertaste der Tastatur mit der rechten Hand gedrückt wurde, sobald ein Ziel erschien.
Nachdem der Teilnehmer mündlich und per Tastendruck bestätigt hatte, dass er alle Anweisungen verstanden hatte, wurden Übungsversuche (10 Versuche mit jeder Zielpräsentation und 3 Versuche ohne Ziel) durchgeführt. Während des Abschlusses der Übungsversuche wurde auf dem Bildschirm ein Feedback mit den folgenden Aussagen angezeigt: (1) „Richtig“, (2) „Versuchen Sie, schneller zu reagieren!“ und (3) „Reagieren Sie nur, wenn Sie ein Ziel sehen.“ Sobald die Übungseinheit abgeschlossen war und sowohl der Teilnehmer als auch der Versuchsleiter sicher waren, dass die Aufgabenanweisungen richtig verstanden wurden, wurde der Teilnehmer aufgefordert, mit dem Experiment zu beginnen. Die ersten 30 Versuche eines jeden Versuchsblocks wurden als Übungsversuche ausgeschlossen. Jeder Block bestand aus insgesamt 233 Versuchen: 70 rechts, 70 links, 70 beides und 23 „Fangversuche“. Nach der Hälfte des Blocks wurde eine kurze Pause eingelegt. Patient ML und die jüngeren Kontrollpersonen wurden in einem einzigen Block getestet. Aufgrund der alters- und krankheitsbedingten Variabilität der Patientin RE wurde sie in zwei Blöcken an verschiedenen Tagen getestet; ihre altersgleichen Kontrollteilnehmer wurden ebenfalls in zwei Sitzungen an einem Tag getestet.
Analysen
Für jede Kontrollgruppe wurde der Median der RT für jeden Teilnehmer in jeder Bedingung (linkes Ziel, rechtes Ziel, bilaterale Ziele) berechnet, nachdem Versuche ausgeschlossen wurden, die auf Fangversuche folgten und solche mit RTs von <100 ms oder >800 ms. Ein t-Test für gepaarte Stichproben wurde durchgeführt, um zu bestätigen, dass es keine Asymmetrie bei den Reaktionen auf rechte und linke unilaterale Ziele gab, und es wurde eine mittlere RT für unilaterale Ziele berechnet. Die RTE wurde durch Subtraktion der RTs für bilaterale Versuche von den RTs für unilaterale Versuche errechnet. Ein t-Test für gepaarte Stichproben verglich die unilateralen mit den bilateralen Versuchen, um festzustellen, ob die RTE statistisch zuverlässig war.
Für jeden Patienten wurden nach Ausschluss von Versuchen, die auf Fangversuche folgten, und von Versuchen mit RTs von <100 ms oder >800 ms in einem t-Test für gepaarte Stichproben die medianen RTs für kontralaterale und ipsilaterale unilaterale Ziele verglichen. Wie weiter unten berichtet, waren die RTs für Antworten auf kontralaterale Ziele länger als für ipsilaterale unilaterale Ziele. Um festzustellen, ob das Vorhandensein eines kontralateralen Ziels zu einer statistisch zuverlässigen RTE führte, wurden mit einem t-Test für gepaarte Stichproben die medianen RTs für bilaterale Zielversuche mit unilateralen ipsilateralen Zielversuchen verglichen.
Um zu prüfen, ob die RTE für jeden Patienten zuverlässig kleiner war als für die jeweilige Kontrollgruppe, wurde die RTE für jeden Kontrollteilnehmer berechnet und die oberen und unteren Grenzen der 95 %-Konfidenzintervalle (KI) ermittelt. Der Z-Score für die RTE der einzelnen Patienten wurde im Verhältnis zu ihrer Kontrollgruppe berechnet und mit dem t-Test von Crawford auf statistische Zuverlässigkeit geprüft.
P-Werte für t-Tests mit gepaarten Stichproben wurden mit zwei Schwänzen und für t-Tests von Crawford mit einem Schwanz angegeben.
Ergebnisse
Patienten-RT
Kontrollteilnehmer: Die Mittelwerte der medianen RTs unterschieden sich nicht für linke und rechte Antworten (t = 0,6). Abbildung 6 zeigt, dass die RTs für bilaterale Ziele kürzer waren (die RTE) als für linke (t = 6,8, p < 0,001) oder rechte (t1,10) = 3,8, p = 0,003) unilaterale Ziele. Die mittlere RT für bilaterale Zielversuche wurde vom Mittelwert der mittleren RT für unilaterale Ziele subtrahiert, um eine mittlere RTE für jeden Kontrollteilnehmer zu berechnen. Die mittlere RTE der Kontrollgruppe betrug 24,3 ms (SEM = 2,75).

Abbildung 6. Mediane RTs für Patienten RE und Mittelwert der medianen RTs für Teilnehmer der Kontrollgruppe für Ziele, die im linken Gesichtsfeld („Links“), im rechten Gesichtsfeld („Rechts“) und gleichzeitig in beiden Gesichtsfeldern („Beide“) erscheinen. Die Fehlerbalken für die Kontrollteilnehmer geben die Standardfehler an.
Die mittleren RTs der RE-Patienten waren länger als die der Kontrollteilnehmer (Abbildung 6) und lagen über der oberen Grenze des 95%-KI der mittleren RTs der Kontrollgruppe für alle drei Bedingungen (links = 457 ms; rechts = 449 ms; beide = 426 ms). Die RTs für unilaterale Ziele im kontraläsionalen (linken) Feld waren länger als für unilaterale Ziele im ipsilesionalen (rechten) Feld (t = 6,0, p < 0,001).
Wichtig ist, dass es keine RTE gab: Die mediane RT für bilaterale Ziele (500 ms) war nicht kürzer als für unilaterale Ziele im ipsilesionalen (rechten) Gesichtsfeld (494 ms; t = 1,141), p = ns (Abbildung 6). Tabelle 1 (oben) zeigt, dass der für die Patientin RE berechnete RTE signifikant geringer war als der RTE für ihre Kontrollgruppe.

TABELLE 1. Redundanter Zieleffekt für Patienten RE (oben) und ML (unten) und mittlere RTE für ihre jeweiligen Kontrollgruppen mit 95 % Konfidenzintervallen (KI), Z-Scores und Crawford t-Test zum Vergleich jedes Patienten mit seiner jeweiligen Kontrollgruppe.
Patienten ML
Kontrollteilnehmer: Der Mittelwert der medianen RTs unterschied sich nicht für die Antworten auf linke und rechte Ziele (t = 0,86. Abbildung 7 zeigt, dass die RTs für bilaterale Ziele kürzer waren (die RTE) als für entweder linke (t = 4,7, p = 0,001, oder rechte (t1,11) = 7,8, p < 0,001) unilaterale Ziele.

Abbildung 7. Mediane RTs für Patienten ML und Mittelwert der medianen RTs für Teilnehmer der Kontrollgruppe für Ziele, die im linken Gesichtsfeld, im rechten Gesichtsfeld und gleichzeitig in beiden Gesichtsfeldern erscheinen. Die Fehlerbalken für die Kontrollteilnehmer geben die Standardfehler an.
Die mittlere RT für bilaterale Zielversuche wurde vom Mittelwert der medianen RT für linke und rechte unilaterale Ziele subtrahiert, um eine RTE für jeden Kontrollteilnehmer zu berechnen.
Der Gruppenmittelwert der RTE betrug 33 ms (SEM = 6,65).
Die medianen RTs der ML-Patienten waren länger als die der Kontrollgruppe (Abbildung 7) und lagen über der oberen Grenze des 95 %-KI der mittleren RTs der Kontrollgruppe für alle drei Bedingungen (links = 322 ms; rechts = 307 ms; beide = 277 ms). Die RTs für unilaterale Ziele im rechten (kontraläsionalen) Feld waren länger als für unilaterale Ziele im linken (ipsilesionalen) Feld (t = 4,9, p = 0,001). Es gab keine RTE. Die RTs für bilaterale Ziele (361 ms) waren nicht kürzer als für unilaterale Ziele im ipsilesionalen (linken) Gesichtsfeld (363 ms). Tabelle 1 (unten) zeigt, dass die für die Patientin ML berechnete RTE signifikant geringer war als die RTE ihrer Kontrollgruppe.
Diskussion
Einfache RTs wurden für die Erkennung einzelner Ziele im kontraläsionalen oder ipsilesionalen Feld und für bilaterale Ziele bei zwei Patienten gemessen, bei denen das Brachium des SC in einer Hemisphäre geschädigt war. Bei einem der Patienten (einer jungen Frau) lag die Schädigung in der linken Hemisphäre und war auf ein Schädel-Hirn-Trauma zurückzuführen; die Läsion betraf zwar den Colliculus inferior und erstreckte sich bis in das Tegmentum des Mittelhirns, eine Schädigung des SC an sich war jedoch bei der hochauflösenden Neurobildgebung nicht erkennbar. Bei der anderen Patientin (einer älteren Frau) lag die Schädigung in der rechten Hemisphäre und wurde durch eine hypertensive Blutung verursacht, die auch den medialen Pulvinar und den lateralen Thalamus stark schädigte und sich bis ins dorsale Mittelhirn einschließlich des rostralen SC ausdehnte. Bei beiden Patienten war die einfache RT zur Erkennung visueller Ziele im kontraläsionalen Feld im Vergleich zum ipsilesionalen Feld verlangsamt. Keiner der Patienten zeigte einen räumlichen Summationseffekt (RTE) bei der Zielerfassung, wenn Reize in beiden Gesichtsfeldern präsentiert wurden.
Diese Beobachtungen werfen ein Licht auf die Rolle des SC bei der Zielerfassung und insbesondere auf die Rolle der visuellen Afferenzen zum SC. Posner et al. (1980) definierten Detektion operativ als die Fähigkeit, eine willkürliche Reaktion auf ein visuelles Signal (z.B. einen einfachen Tastendruck mit dem Finger, wie im vorliegenden Experiment) zu zeigen. Sie vertraten die These, dass die Erkennung eine Aufmerksamkeitszuweisung erfordert, um das Ziel für die Verarbeitung in einem System mit begrenzter Kapazität auszuwählen, das dem Ziel Priorität einräumt.
Song et al. (2011) zeigten, dass die Inaktivierung des SC bei Affen auffällige Defizite bei der Zielauswahl verursacht, die nicht ohne Weiteres durch eine einfache Beeinträchtigung der visuellen Wahrnehmung oder der motorischen Ausführung erklärt werden können, und schlugen vor, dass es zu einer Prioritätskarte mit allgemeinerem Zweck beiträgt. In diesem Experiment wurden den Affen zwei Reize in gegenüberliegenden Gesichtsfeldern präsentiert, und sie mussten mit einer Greifreaktion angeben, welcher Reiz zuerst erschien. Ein Affe wurde darauf trainiert, nach dem Reiz zu greifen, der zuerst erschien, und ein Affe wurde darauf trainiert, nach dem Ziel zu greifen, das als zweites erschien. In beiden Fällen gab es eine starke Voreingenommenheit gegen die Auswahl des Ziels, das sich im Gesichtsfeld kontralateral zur Läsion befand. Da die gleiche Verzerrung bei dem Affen auftrat, der nach dem zweiten Ziel griff, konnte die Verzerrung nicht auf eine Verzögerung bei der Wahrnehmung des kontralateralen Ziels zurückzuführen sein. Die kollikuläre Inaktivierung führte nicht zu einer Beeinträchtigung des Wahrnehmungsurteils darüber, welcher Stimulus zuerst erschien. Vielmehr wurden Reize im Gesichtsfeld kontralateral zum inaktivierten Kollikulus bei der Priorisierung für die Handlung benachteiligt.
Zhaoping (2016) hat kürzlich eine Unterscheidung zwischen neuronalen Salienzkarten und Prioritätskarten hervorgehoben und für eine evolutionäre Migration einer Wahrnehmungssalienzkarte vom Sehnerventektum/SC zum primären visuellen Kortex argumentiert. Sie schlug vor, dass Salienzsignale an eine Prioritätskarte im SC übertragen werden können, ohne die Eigenschaft der Merkmalsabstimmung zu projizieren.
Das Brachium des SC überträgt afferente visuelle Signale von der Retina über den retino-tektalen Trakt an die oberflächlichen Schichten des Colliculus; die Mehrzahl der durch das Brachium übertragenen afferenten Fasern sind jedoch Projektionen aus dem primären visuellen Cortex. Ist das Brachium gestört, können Salienzsignale vom primären visuellen Kortex über die frontalen Augenfelder an den Colliculus weitergeleitet werden. Fehlen jedoch direkte Projektionen von der Netzhaut oder dem visuellen Kortex zu den oberflächlichen Schichten des Colliculus, wie wir es bei den Patienten mit Brachiumläsionen vermuten, dauert es länger, bis die kollikuläre Prioritätskarte aktiviert wird, was zu langsameren Reaktionen auf kontralaterale visuelle Signale führt.
Wie in der Einleitung erwähnt, hängt der Beitrag zur RTE, der auf einem probabilistischen Rennpferdemodell basiert, von der Erkennung beider Ziele ab; und von einem Rennen, bei dem die Effizienz der unabhängigen Kanäle, über die die beiden Ziele übertragen werden, gleichwertig ist, so dass der Ausgang des Rennens zum Erreichen der Erkennungsschwelle von Versuch zu Versuch zufällig ist. Da die Erkennungsschwelle für kontraläsionale Signale bei den hier untersuchten Patienten höher ist, könnten redundante Ziele auf der Grundlage eines stochastischen Pferderennens nicht profitieren; d.h. der Ausgang des Rennens zwischen ipsilesionalen und kontraläsionalen Signalen ist nicht zufällig – kontraläsionale Signale verlieren das Rennen eher als dass sie es gewinnen.
Dennoch hat die Forschung bei hemianopischen Patienten gezeigt, dass es auch eine neuronale Summationskomponente gibt, die zum RTE beiträgt und nicht von der Erkennung beider Ziele abhängt (Marzi et al., 1986; Tomaiuolo, 1997; de Gelder et al., 2001). Da bei kommissurotomierten Patienten eine RTE nachgewiesen wurde (Marzi et al., 1986; Reuter-Lorenz et al., 1995), wurde argumentiert, dass die interhemisphärische Integration von Signalen über den vertikalen Meridian subkortikal erfolgen muss.
Savazzi und Marzi (2004) zeigten, dass die neuronale Summation bei kurzwelligen chromatischen Zielreizen weder bei neurologisch intakten Personen noch bei Split-Brain-Patienten auftritt. Leh et al. (2006b) berichteten, dass bei einigen hemianopischen, hemisphärenektomierten Patienten zwar ein RTE mit achromatischen Reizen auftrat, dass aber bei diesen Patienten kein RTE auftrat, wenn chromatische Reize mit kurzer Wellenlänge als Ziel verwendet wurden. Kurzwellige (d. h. violette) Reize aktivieren nur die S-Zapfen in der Netzhaut. Retinale Ganglienzellen, die Input von S-Zapfen erhalten, projizieren weder direkt in den SC noch in die magnozellulären Schichten des Nucleus geniculatus lateralis (De Monasterio, 1978). Da Projektionen vom primären visuellen Kortex zum SC durch das Brachium des SC nur visuelle Signale von magnozellulären geniculostriatischen Afferenzen weiterleiten (Schiller et al., 1979), deutet die Tatsache, dass S-Zapfen-Reize keine RTE hervorrufen, darauf hin, dass die neuronale Summierung im SC stattfindet und von den visuellen Afferenzen abhängt, die durch das Brachium des SC übertragen werden.
Es gibt also konvergierende Beweise bei Split-Brain-Patienten, hemianopischen Patienten mit Blindheit und aus Experimenten mit Stimuli kurzer Wellenlänge, dass neuronale Summierung im SC stattfindet. Obwohl kurzwellige Reize die retinalen Ganglienzellen, die über das Brachium in den SC projizieren, nicht aktivieren, kann man dennoch nicht davon ausgehen, dass der Colliculus für solche Reize völlig blind ist. Einzelne Ableitungen im SC von Affen haben gezeigt, dass kurzwellige Reize Reaktionen in den oberflächlichen Schichten des Colliculus auslösen. Darüber hinaus hat die Traktographie bei hemisphärenektomierten Patienten mit einem RTE (d.h. Blindsight), nicht aber bei Patienten, die keine Anzeichen von Blindsight zeigten, gezeigt, dass der SC eine Verbindung zur intakten Hemisphäre hat (Leh et al., 2006a).
Die Ergebnisse der aktuellen Untersuchung liefern somit den ersten direkten Beweis dafür, dass räumliche Summation im SC auftritt, die von der Übertragung visueller Signale durch das Brachium abhängt.
Ethikerklärung
Diese Studie wurde in Übereinstimmung mit den Richtlinien und mit Genehmigung des Protokolls des NHS Ethics Committee, Bangor, UK, und des School of Psychology Ethics Committee der Bangor University, UK, durchgeführt. Die mündliche und schriftliche Einwilligung aller Teilnehmer wurde gemäß der Deklaration von Helsinki eingeholt.
Beiträge der Autoren
MvK: Konzipierte die Forschung, entwarf und programmierte das Experiment, sammelte und analysierte Patientendaten und trug zum Verfassen des Manuskripts bei. KK: Sammelte Kontrolldaten, sichtete die einschlägige Literatur, analysierte die Kontrolldaten und trug zum Verfassen des Manuskripts bei. RR: Rekrutierte Patienten und analysierte Neuroimaging-Studien, einschließlich der virtuellen Dissektion mit DTI-Traktographie, bereitete die Krankengeschichten der Patienten vor und trug zum Verfassen des Manuskripts bei.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung ohne jegliche kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Behrens, T., Woolrich, M. W., Jenkinson, M., Johansen-Berg, H., Nunes, R. G., Clare, S., et al. (2003). Charakterisierung und Ausbreitung von Unsicherheit in der diffusionsgewichteten MR-Bildgebung. Magn. Reson. Med. 50, 1077-1088. doi: 10.1002/mrm.10609
PubMed Abstract | CrossRef Full Text | Google Scholar
Behrens, T. E., Berg, H. J., Jbabdi, S., Rushworth, M. F., und Woolrich, M. W. (2007). Probabilistische Diffusionstraktographie mit mehreren Faserorientierungen: Was können wir gewinnen? Neuroimage 34, 144–155.
Google Scholar
de Gelder, B., Pourtois, G., van Raamsdonk, M., Vroomen, J., and Weiskrantz, L. (2001). Unseen stimuli modulate conscious visual experience: evidence from interhemispheric summation. Neuroreport 12, 385–391. doi: 10.1097/00001756-200102120-00040
CrossRef Full Text | Google Scholar
De Monasterio, F. M. (1978). Properties of ganglion cells with atypical receptive-field organization in retina of macaques. J. Neurophysiol. 41, 1435–1449.
PubMed Abstract | Google Scholar
Fries, W. (1984). Cortical projections to the superior colliculus in the macaque monkey: a retrograde study using horseradish peroxidase. J. Comp. Neurol. 230, 55–76. doi: 10.1002/cne.902300106
PubMed Abstract | CrossRef Full Text | Google Scholar
Georgy, L., Celeghin, A., Marzi, C. A., Tamietto, M., and Ptito, A. (2016). Der Colliculus superior ist empfindlich für gestaltähnliche Reizkonfigurationen bei Hemisphärektomie-Patienten. Cortex 81, 151-161. doi: 10.1016/j.cortex.2016.04.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Hershenson, M. (1962). Die Reaktionszeit als Maß für die intersensorische Erleichterung. J. Exp. Psychol. 63, 289-293. doi: 10.1037/h0039516
CrossRef Full Text | Google Scholar
Hikosaka, O., and Wurtz, R. (1983). Visuelle und okulomotorische Funktionen der Substantia nigra pars reticulata des Affen. III. Memory contingent visual and saccade responses. J. Neurophysiol. 49, 1268-1284.
PubMed Abstract | Google Scholar
Leh, S. E., Johansen-Berg, H., und Ptito, A. (2006a). Unbewusstes Sehen: Neue Einblicke in das neuronale Korrelat des Blindsehens mittels Diffusionstraktographie. Brain 129(Pt 7), 1822–1832.
PubMed Abstract | Google Scholar
Leh, S. E., Mullen, K. T., and Ptito, A. (2006b). Absence of S-cone input in human blindsight following hemispherectomy. Eur. J. Neurosci. 24, 2954–2960.
PubMed Abstract | Google Scholar
Marzi, C., Tassinari, G., Aglioti, S., and Lutzemberger, L. (1986). Spatial summation across the vertical meridian in hemianopics: a test of blindsight. Neuropsychologia 24, 749–758. doi: 10.1016/0028-3932(86)90074-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Miller, J. (1982). Divided attention: evidence for coactivation with redundant signals. Cogn. Psychol. 14, 247–279. doi: 10.1016/0010-0285(82)90010-X
CrossRef Full Text | Google Scholar
Miniussi, C., Girelli, M., and Marzi, C. A. (1998). Neural site of the redundant target effect electrophysiological evidence. J. Cogn. Neurosci. 10, 216–230. doi: 10.1162/089892998562663
CrossRef Full Text | Google Scholar
Pare, M., and Wurtz, R. (1997). Monkey posterior parietal cortex neurons antidromically activated from superior colliculus. J. Neurophysiol. 78, 3493–3497.
PubMed Abstract | Google Scholar
Poliva, O., Bestelmeyer, P. E., Hall, M., Bultitude, J. H., Koller, K., and Rafal, R. D. (2015). Funktionelle Kartierung des menschlichen auditorischen Kortex: fMRI-Untersuchung eines Patienten mit auditiver Agnosie aufgrund eines Traumas des unteren Colliculus. Cogn. Behav. Neurol. 28, 160-180. doi: 10.1097/WNN.0000000000000072
PubMed Abstract | CrossRef Full Text | Google Scholar
Posner, M., Snyder, C., and Davidson, B. (1980). Aufmerksamkeit und die Erkennung von Signalen. J. Exp. Psychol. Gen. 109, 160-174. doi: 10.1037/0096-3445.109.2.160
CrossRef Full Text | Google Scholar
Raab, D. H. (1962). Statistische Erleichterung von einfachen Reaktionszeiten. Trans. N. Y. Acad. Sci. 24, 574-590. doi: 10.1111/j.2164-0947.1962.tb01433.x
CrossRef Full Text | Google Scholar
Reuter-Lorenz, P., Nozawa, G., Gazzaniga, M. S., and Hughes, H. C. (1995). Das Schicksal vernachlässigter Ziele: eine chronometrische Analyse redundanter Zieleffekte im zweigeteilten Gehirn. J. Exp. Psychol. Hum. Percept. Perform. 21, 211-230. doi: 10.1037/0096-1523.21.2.211
PubMed Abstract | CrossRef Full Text | Google Scholar
Savazzi, S., and Marzi, C. A. (2004). Der Colliculus superior ist für die interhemisphärische neuronale Summierung sowohl bei Normalen als auch bei Patienten mit einer totalen Sektion oder Agenese des Corpus callosum verantwortlich. Neuropsychologia 42, 1608-1618. doi: 10.1016/j.neuropsychologia.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiller, P. H., Malpeli, J. G., and Schein, S. J. (1979). Composition of geniculostriate input ot superior colliculus of the rhesus monkey. J. Neurophysiol. 42, 1124-1133.
PubMed Abstract | Google Scholar
Sommer, M., and Wurtz, R. (2000). Zusammensetzung und topographische Organisation von Signalen, die vom frontalen Augenfeld zum Colliculus superior gesendet werden. J. Neurophysiol. 83, 1979–2001.
PubMed Abstract | Google Scholar
Song, J. H., Rafal, R. D., and McPeek, R. M. (2011). PNAS Plus: deficits in reach target selection during inactivation of the midbrain superior colliculus. Proc. Natl. Acad. Sci. U.S.A. 108, E1433–E1440. doi: 10.1073/pnas.1109656108
PubMed Abstract | CrossRef Full Text
Tomaiuolo, F. (1997). Blindsight in hemispherectomized patients as revealed by spatial summation across the vertical meridian. Brain 120, 795–803. doi: 10.1093/brain/120.5.795
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhaoping, L. (2016). From the optic tectum to the primary visual cortex: migration through evolution of the saliency map for exogenous attentional guidance. Curr. Opin. Neurobiol. 40, 94–102. doi: 10.1016/j.conb.2016.06.017
PubMed Abstract | CrossRef Full Text | Google Scholar