Der Ausbruch der Natur aus der genetischen Gefangenschaft
Posttranslationale Modifikationen: Ein kurzer Überblick
Wie funktioniert die posttranslationale Modifikation?
Die häufigsten posttranslationalen Modifikationen
Die Auswirkungen der posttranslationalen Modifikation auf Gesundheit und Krankheit
Ein kurzer Überblick
Was bedeutet PTM?
Zellen müssen Veränderungen der internen und externen Bedingungen erkennen und darauf reagieren. Eine Methode zur Anpassung an diese Veränderungen ist die chemische Modifikation von Proteinen. Bedingte chemische Veränderungen werden über reversible posttranslationale Modifikationen (PTM) von Proteinen von den Sensoren an die Effektoren weitergegeben. PTMs spielen eine wichtige Rolle bei der Veränderung des Endprodukts der Expression, tragen zu biologischen Prozessen und Krankheitszuständen bei und spielen eine Schlüsselrolle bei vielen zellulären Prozessen wie der zellulären Differenzierung (1), dem Proteinabbau, Signal- und Regulierungsprozessen, der Regulierung der Genexpression und Protein-Protein-Interaktionen (2,3).
Wie funktioniert die posttranslationale Modifikation?
PTMs können in jeder Phase des Lebenszyklus eines Proteins auftreten. Viele Proteine werden kurz nach Abschluss der Translation modifiziert, um die richtige Faltung zu vermitteln oder das entstehende Protein an bestimmte zelluläre Orte (wie den Kern oder die Membran) zu leiten. Andere Modifikationen erfolgen nach Abschluss der Faltung und Lokalisierung, um die katalytische Aktivität zu aktivieren oder zu inaktivieren. Proteine werden auch kovalent an Markierungen gebunden, die ein Protein für den Abbau vorsehen. Sie werden durch eine Kombination aus posttranslationaler Spaltung und der Hinzufügung funktioneller Gruppen durch einen schrittweisen Mechanismus der Proteinreifung oder -aktivierung modifiziert.
Wo findet die posttranslationale Modifikation statt? PTMs treten an bestimmten Aminosäureseitenketten oder Peptidverknüpfungen auf und werden am häufigsten durch enzymatische Aktivität vermittelt. In der Tat bestehen 5 % des Proteoms aus Enzymen, die mehr als 200 Arten von PTMs durchführen (4). Zu diesen Enzymen gehören Kinasen, Phosphatasen, Transferasen und Ligasen, die funktionelle Gruppen, Proteine, Lipide oder Zucker an Aminosäureseitenketten anfügen oder von diesen entfernen, sowie Proteasen, die Peptidbindungen spalten, um bestimmte Sequenzen oder regulatorische Untereinheiten zu entfernen. Viele Proteine können sich auch selbst verändern, indem sie autokatalytische Domänen, wie Autokinase- und autoprotolytische Domänen, nutzen. PTMs können je nach Art der Modifikation auch reversibel sein. So hydrolysieren Phosphatasen beispielsweise die Phosphatgruppe, um sie aus dem Protein zu entfernen und seine biologische Aktivität umzukehren (Abbildung 1).
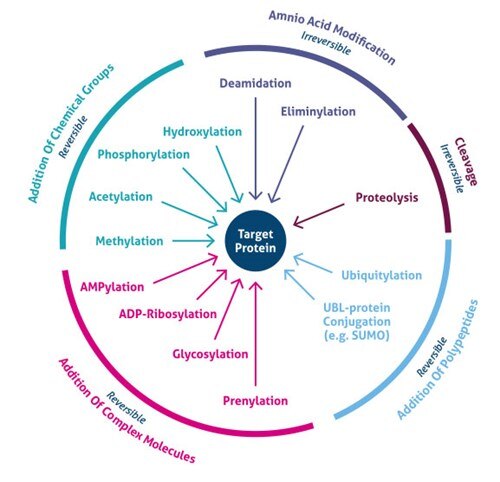
Abbildung 1. Arten von posttranslationalen Modifikationen (PTMs).
Häufigste posttranslationale Modifikationen
Die jüngsten Entwicklungen in der Massenspektrometrie (MS) haben die Identifizierung von Tausenden von PTM-Stellen ermöglicht. Folglich haben neuartige Anreicherungsstrategien die globale zelluläre Bedeutung verschiedener Arten von Modifikationen (z. B. Acetylierung, Ubiquitylierung, O-GlNac, N-gebundene Glykosylierung) aufgedeckt. Derzeit sind mehr als 200 verschiedene Arten von PTMs bekannt (5,6), die von kleinen chemischen Modifikationen (z. B. Phosphorylierung und Acetylierung) bis hin zur Hinzufügung kompletter Proteine (z. B. Ubiquitylierung, Abbildung 3) reichen.
Phosphorylierung
Die Phosphorylierung von Proteinen (Abbildung 2) ist die am häufigsten untersuchte posttranslationale Modifikation. Man schätzt, dass ein Drittel der Säugetierproteine phosphoryliert sein kann, und diese Modifikation spielt oft eine Schlüsselrolle bei der Modulation der Proteinfunktion. Die Phosphorylierung findet an Serin-, Threonin- und Tyrosinresten statt und reguliert die Proteinfunktion, die enzymatische Aktivität, Protein-Protein-Wechselwirkungen und die Proteinlokalisierung. Die Phosphorylierung wird durch Phosphatasen katalysiert und kann reversibel sein – phosphorylierte Proteine können durch Proteindephosphatasen dephosphoryliert werden.
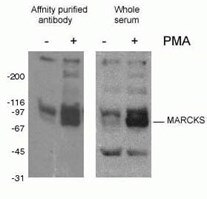
Abbildung 2. WB-Ergebnis des Phospho-Marcks-Antikörpers (10018-3-AP, 1:1500) mit J774-Makrophagenzellen der Maus, die mit PMA behandelt wurden.
Glykosylierung und Glykanisierung
Die meisten Proteine, die an den mit dem endoplasmatischen Retikulum assoziierten Ribosomen synthetisiert werden, werden glykosyliert. Das bedeutet, dass der Polypeptidkette eine kovalente Bindung von Zuckerresten hinzugefügt wird. Die beiden häufigsten Arten der Glykosylierung in Eukaryoten sind die N-gebundene Glykosylierung – an Asparagin – und die O-gebundene Glykosylierung – an Serin und Threonin.
Ubiquitinierung
Bei der Ubiquitinierung von Proteinen wird ein kovalentes Ubiquitin an Lysin, Cystein, Serin, Threonin oder direkt an den N-Terminus des Proteins angehängt. Ubiquitin ist ein kleines (+/-8,6 kDa) Protein, das in fast allen Gewebetypen vorkommt (Abbildung 3). Die Ubiquitinierung ist eine enzymatische Reaktion, die von einer Drei-Enzym-Kaskade (E1, E2 und E3) katalysiert wird. Diese sorgt für Substratspezifität und die Schritte Aktivierung, Konjugation und Ligation. Proteine können monoubiquitiniert (mit einem Ubiquitinmolekül) oder polyubiquitiniert sein. Bei der Polyubiquitinierung werden zusätzliche Ubiquitinmoleküle an das ursprüngliche Ubiquitinmolekül angehängt. Die Ubiquitinierung über das Proteom kann Proteine für den Abbau markieren. Sie ist auch wichtig für die zelluläre Signalübertragung, die Internalisierung von Membranproteinen und die Entwicklung und Regulierung der Transkription.

Abbildung 3. MDA-MB-453s-Zellen wurden einer SDS-PAGE unterzogen, gefolgt von einem Western Blot mit 10201-2-AP (Ubiquitin-Antikörper) in einer Verdünnung von 1:600.
PTMs beeinflussen Gesundheit und Krankheit
Die Analyse von Proteinen und ihren PTMs ist besonders wichtig für die Untersuchung von Herzerkrankungen, Krebs, neurodegenerativen Erkrankungen und Diabetes (7). Die größte Herausforderung bei der Untersuchung posttranslational veränderter Proteine ist die Entwicklung spezifischer Nachweis- und Reinigungsmethoden. Glücklicherweise werden diese technischen Hindernisse mit einer Vielzahl neuer und verfeinerter Proteomik-Technologien überwunden.
- Chemische Biologie: verkleidete Proteine.
- Konzepte der Sumoylierung: ein Jahrzehnt später.
- Proteomische Analyse in den Neurowissenschaften.
- Die Rolle posttranslationaler Modifikationen im Kontext von Proteininteraktionsnetzwerken
- Entschlüsselung eines globalen Netzwerks funktionell assoziierter posttranslationaler Modifikationen.
- PTMcode: a database of known and predicted functional associations between post-translational modifications in proteins.
- Citrullination: a posttranslational modification in health and disease.
