Typische Merkmale
RSTS ist gekennzeichnet durch eine langsame Entwicklung von Größe und Gewicht, Mikrozephalie, dysmorphe Gesichtszüge, breite Daumen und große Zehen. Die pränatale Entwicklung ist normal, mit durchschnittlichen oder nahezu normalen Wachstumsparametern bei der Geburt. In der ersten postnatalen Periode nähern sich die Wachstumskurven typischerweise den unteren Grenzen der Normalität, was in erster Linie auf eine Unterernährung zurückzuführen ist, die durch einen gastroösophagealen Reflux noch verstärkt wird. In der Folge kann in der Adoleszenz die Tendenz zu Übergewicht oder Adipositas (bei Männern früher als bei Frauen) beobachtet werden. Spezifische und kürzlich überarbeitete Wachstumstabellen sind für eine angemessene Beurteilung des Wachstums der betroffenen Personen unerlässlich. Die Gesichtszüge sind in erster Linie durch eine niedrige Stirnhaargrenze, gewölbte/dicke Augenbrauen, nach unten geneigte Lidspalten, eine abstehende Schnabelnase mit Columella unterhalb der Alae nasi, dysplastische und tief angesetzte Ohren, einen gewölbten Gaumen, eine leichte Mikrognathie, Zahnanomalien (veränderte Form, Zahnfehlstellungen und überfüllte Zähne) und ein atypisches Lächeln („Grimassieren“) mit fast vollständig geschlossenen Augen gekennzeichnet (Abbildung 1). Die Füße und Hände weisen typischerweise einen vergrößerten ersten Finger und Klinodaktylie des fünften Fingers auf (Abbildung 2), während Polydaktylie mit bifiden Daumen und ersten Zehen selten beobachtet wird. Zu den weiteren Skelettanomalien gehören abduzierte Daumen, Wirbelanomalien, laxe Bänder, schwere und lang anhaltende aseptische Entzündungen des Oberschenkelkopfes, Anomalien, die dem Morbus Perthes ähneln (3 %), und gelegentlich ein Verrutschen der Epiphyse des Oberschenkelknochens. Insbesondere wurde über ein hohes Risiko für Anomalien der Halswirbelsäule (Instabilität von C1-C2, Os odontoideum, Hypoplasie des Dens, Fusion der Halswirbel) berichtet, mit möglicher Stenose an der craniovertebralen Verbindung, die eine zervikale Myelopathie verursachen kann. Komplexe neuroradiologische Probleme wie eine Dysgenesie des Corpus callosum (17 %), eine Chiari-Malformation vom Typ I mit oder ohne Syringomyelie, eine Dandy-Walker-Malformation und Hydrozephalus sowie ein Tethered Cord wurden berichtet und werden noch untersucht. Auch zerebrovaskuläre Anomalien wie die spontane Dissektion der supraaortalen Arterien und Hirninfarkte aufgrund eines dissezierenden Aneurysmas der vorderen Hirnarterie wurden berichtet. Bei RSTS-Patienten kann jedoch jedes Organ betroffen sein. Zu den möglichen Fehlbildungen, medizinischen Problemen und Komplikationen gehören (Tabelle 1):
-
Leitungs- und/oder sensorineurale Taubheit, rezidivierende Mittelohrentzündungen, rezidivierende Atemwegsinfektionen, Immundefekte;
-
unspezifische Anomalien der Elektroenzephalographie (EEG) (57-66%) und Krampfanfälle (25%) ;
-
Katarakt, einseitiges oder beidseitiges Iris-/Retina-/Optiknervenkolobom (9-11%), Glaukom, Tränenwegsobstruktionen (38-47%), Brechungsfehler (41-56%) und Strabismus (60-71%) . Darüber hinaus beschrieben Jacobs et al. 2012 erstmals eine periphere Avaskularität mit Fluoreszeinangiographie beschrieben;
-
Zahnprobleme: Talonhöcker (73%), Zahnschmelzhypoplasie und abnorme Zahnanzahl;
-
Nierenfehlbildungen (52%) und Kryptorchismus (78-100%);
-
endokrine Störungen: kongenitale Hypothyreose, Schilddrüsenhypoplasie, GH-Mangel und Hypophysenhypoplasie;
-
Gastrointestinale Störungen: Gastroösophagealer Reflux, Verstopfung (40-74%) und Megakolon/Hirschsprung-Krankheit ;
-
obstruktive Schlafapnoe, Anästhesie- und Intubationskomplikationen ;
-
Hautprobleme einschließlich Pilomatrixome, eingewachsene Zehennägel, Paronychie und die Neigung zur Keloidbildung (24%) ;
-
Krebserkrankungen, insbesondere neuronaler und entwicklungsbedingter Art (Neuroblastom, Medulloblastom, Oligodendrogliom, Meningeom, Phäochromozytom, Rhabdomyosarkom, Leiomyosarkom, Seminom, Odontom, Choristom und Pilomatrixom. Es wurde auch über Leukämie und Lymphome berichtet;
-
hirsutism
Figure 1 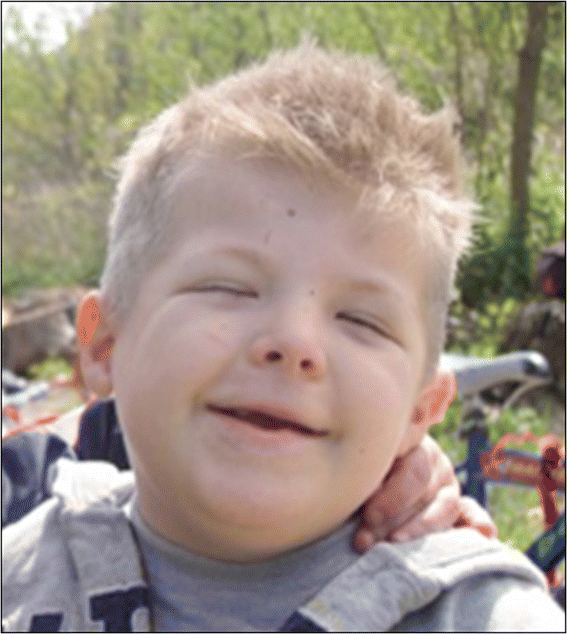
Typical facies of a RSTS patient, including arched eyebrows, slanted palpebral fissures, protruding beaked nose with columella below alae nasi, arched palate, mild micrognathia, labial commissures facing upward, teeth anomalies, and an atypical smile („grimacing“) with nearly completely closed eyes.
Figure 2 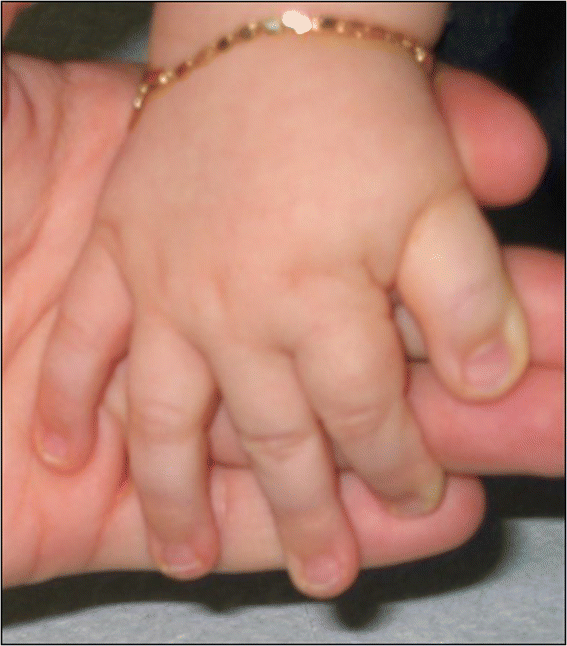
Typical hands of a RSTS patient, including enlarged first finger and clinodactyly of the fifth finger.
Table 1 The incidence of a number of typical features of RSTS
kongenitale Herzerkrankungen: Vorhofseptumdefekt, Ventrikelseptumdefekt, offener Ductus arteriosus, Coarctation der Aorta, Pulmonalstenose, bikuspide Aortenklappe, Pseudotruncus, Aortenstenose, Dextrokardie, Gefäßringe und Erregungsleitungsstörungen (24-38%) . Gelegentlich wurde auch über eine Assoziation von hypoplastischem Linksherz mit RSTS berichtet;
Die Neugeborenenperiode von Menschen mit RSTS ist typischerweise durch Hypotonie und eine verzögerte psycho-motorische Entwicklung, mit unterschiedlichen Graden von geistiger Behinderung. So liegt beispielsweise der Intelligenzquotient (IQ) von RSTS-Patienten in der Neugeborenenperiode in der Regel zwischen 25 und 79 (Durchschnitt: 36-51). Im Jahr 2009 beschrieben Galèra et al. drei RSTS-Kardinalmerkmale: kurze Aufmerksamkeitsspanne, motorische Stereotypien und schlechte Koordination. Es wurde sowohl über RSTS-Patienten mit klassischem RSTS und leichter geistiger Behinderung als auch über RSTS-Patienten mit atypischem RSTS und leichter geistiger Behinderung berichtet. Daher ist bei den leichtesten Fällen eine frühzeitige Diagnose besonders schwierig, und die wichtigsten Entwicklungsstadien müssen genau verfolgt werden, um rasch eine spezifische und individuelle Stimulation einzuleiten. Auch wenn RSTS-Patienten in der Regel freundliche und gesellige Eigenschaften haben, können insbesondere im Erwachsenenalter Verhaltensstörungen, Stimmungsschwankungen und Zwangsstörungen beobachtet werden.
Übergang und Gesundheitsversorgung im Erwachsenenalter
Über 90 % der Menschen mit RSTS überleben das Erwachsenenalter, und die Gesundheitsversorgung für diese Patienten ist besonders komplex, zeitaufwändig und oft nicht in spezifischen Leitlinien standardisiert. Die medizinischen Probleme der meisten genetischen Syndrome ändern sich oft mit zunehmendem Alter, und es gibt nur begrenzte Kenntnisse über die Behandlung von Erwachsenen mit genetischen Syndromen. Erwachsene Personen mit RSTS wurden dokumentiert, aber es liegen nur wenige Übersichtsstudien über Erwachsene mit RSTS vor. In diesen Übersichtsstudien hatten erwachsene RSTS-Patienten relevante medizinische Probleme und die meisten von ihnen waren übergewichtig oder fettleibig. Eine Reihe von Verhaltensphänotypen wie Angstzustände, instabile Stimmungen und aggressives Verhalten können bereits im Jugendalter auftreten. Betreuer berichteten bei 32 % der RSTS-Patienten über eine Abnahme der Fähigkeiten und bei 37 % über eine Verschlechterung des Verhaltens, was mit dem Bericht von Hennekam et al. aus dem Jahr 1992 übereinstimmt. Daher ist eine Nachsorge wichtig, um die mit zunehmendem Alter auftretenden psychiatrischen Probleme zu erkennen und zu behandeln. Schließlich könnte die Prävalenz von RSTS aufgrund einer späten Diagnose, insbesondere bei leichteren Fällen, höher sein als ursprünglich angenommen.
Diagnostische Ansätze
Individuen mit Verdacht auf RSTS sollten von Kindergenetikern mit Kenntnissen in Dysmorphologie untersucht werden. Bei der genetischen Analyse von RSTS wird eine Reihe von molekularen Techniken eingesetzt. Unter anderem kann die Karyotyp-Analyse seltene zytogenetisch sichtbare Anomalien (Translokationen, Inversionen oder Deletionen) aufzeigen; obwohl das Ergebnis in der Regel normal ist, sollte diese Untersuchung auf jeden Fall durchgeführt werden, um mögliche Rearrangements zu identifizieren. Mit FISH können Mikrodeletionen mit einer Entdeckungsrate von 5-10 % festgestellt werden. Mit der Deletions-/Duplikationsanalyse werden exonische oder ganzgene Deletionen/Duplikationen ermittelt, die durch die Sequenzanalyse der kodierenden und flankierenden intronischen Regionen der genomischen DNA nicht nachweisbar sind. Es können verschiedene Methoden angewandt werden (quantitative PCR, Long-Range-PCR, Multiplex-Ligations-abhängige Sondenamplifikation (MLPA) und chromosomales Microarray). Stef et al. wiesen bei 17 (20,5 %) von 83 Patienten mit Hilfe von Array-CGH und quantitativer Multiplex-Fluoreszenz-PCR Deletionen nach. Durch molekulare Analysen können auch Mutationen in den CREBBP- und EP300-Genen nachgewiesen werden. Pathogene Varianten des CREBBP-Gens wurden bei 50-70 % der RSTS-Patienten identifiziert, während Mutationen im EP300-Gen bei etwa 5-8 % der RSTS-Patienten festgestellt wurden (Roelfsema et al., Bartholdi et al., Negri et al.)
Genotyp-Phänotyp-Korrelationen
Wenig ist über Genotyp-Phänotyp-Korrelationen von RSTS bekannt. Bei RSTS-Patienten mit großen Deletionen wurde ein schwerwiegender Phänotyp festgestellt, aber andere Studien stützen diesen Genotyp-Phänotyp-Zusammenhang nicht. Ein Zusammenhang zwischen einem niedrigeren IQ und autistischen Merkmalen mit großen Deletionen bei RSTS-Patienten ist jedoch möglich. Daher empfehlen Calì et al. die MLPA, die diese großen Deletionen für das Screening von RSTS-Patienten mit niedrigerem IQ und autistischen Merkmalen identifizieren kann. Mutationen außerhalb der Histon-Acetyltransferase (HAT)-Domäne wurden mit einem milden Phänotyp in Verbindung gebracht. Darüber hinaus kann auch somatischer Mosaizismus mit mildem RSTS in Verbindung gebracht werden. Bislang wurden weniger als 20 RSTS-Patienten mit EP300-Mutationen identifiziert und charakterisiert. EP300-Mutationen wurden mit Präeklampsie bei Frauen in Verbindung gebracht, die eine von RSTS betroffene Schwangerschaft austrugen; Hautbeteiligung und ein milder Phänotyp mit Skelettanomalien und neuropsychiatrischen Problemen wurden beschrieben.
Genetische Beratung
Die meisten RSTS-Fälle treten sporadisch auf, und nur wenige RSTS-Fälle, die Geschwister betreffen, wurden bisher gemeldet. Eine vertikale Übertragung ist extrem selten. Obwohl das Risiko eines erneuten Auftretens von RSTS im Allgemeinen gering ist, sollte bei der pränatalen Diagnose von RSTS eine angemessene genetische Beratung durchgeführt werden. Somatischer Mosaikismus wurde beispielsweise bei dem klinisch nicht betroffenen Vater eines Jungen mit RSTS und bei dem leicht betroffenen Vater von drei Frauen mit RSTS bestätigt. Darüber hinaus wurde in zwei RSTS-Fällen ein Keimbahnmosaizismus vermutet. Ausgehend von diesen Berichten liegt das Rezidivrisiko für RSTS bei etwa 0,5-1 %.
Behandlung
Während sich das Wissen über die klinischen Manifestationen und den natürlichen Verlauf von RSTS deutlich verbessert hat, wurden die Leitlinien für die medizinische Versorgung und die Nachsorge von RSTS nach dem Vorschlag von Wiley et al. im Jahr 2003 nicht ausreichend aktualisiert (Tabelle 2). Neue genetische und epigenetische Therapien könnten vielversprechende Ansätze für die Behandlung von RSTS sein, aber es ist dringend notwendig, das Standard-Nachsorgeprotokoll zu verbessern und zu personalisieren. Auf der Grundlage unseres Wissens und der kritischen Aspekte, die wir im Folgenden erörtern, haben wir unseren Vorschlag für die Nachsorge ausgearbeitet (Tabelle 3).
Das Management sollte im jugendlichen Alter angepasst werden, aufgrund der bekannten Unterschiede in einigen Bereichen (insbesondere ophthalmologische Merkmale, Neigung zu Fettleibigkeit und Stimmungsstörungen).
Unbekannte und kritische Punkte bei RSTS
Bei der Erforschung der genetischen Grundlagen und der medizinischen Aspekte von RSTS wurden erhebliche Fortschritte erzielt, was zur ersten klinischen Diagnose und zur späteren Bestätigung durch molekulare Analysen beiträgt. Angesichts der Komplexität und Seltenheit dieses Syndroms gibt es noch zahlreiche unbeantwortete Fragen zu RSTS. Daher sollten sich weitere Untersuchungen auf die klinische Diagnose und das Management sowie auf die Genotyp-Phänotyp-Korrelation konzentrieren.
Ausgehend von unserer Erfahrung sollten anormale Wachstumsmuster, wie sie auf Standard-Wachstumsdiagrammen zu sehen sind, in den Diagnosekriterien für RSTS hervorgehoben werden. Darüber hinaus könnten die klinischen Diagnosekriterien und das Screening weiter nach pränataler, kindlicher und jugendlicher Periode unterteilt werden. Insbesondere das Vorhandensein eines normalen Wachstums in utero in Verbindung mit anderen Markern wie breiten Daumen/Halluken und anderen Fehlbildungen ist für die Differenzialdiagnose von RSTS gegenüber anderen Syndromen (z. B. Cornelia-de-Lange-Syndrom) nützlich. Pädiatrische Genetiker sollten stärker auf verbreiterte distale Fingerknochen achten: Bei der Durchsicht von Patientenfotos, die zur molekularen Analyse eingesandt wurden, fanden wir bei der großen Mehrheit dieses Zeichen, das in den Krankenakten nicht angegeben war. Ein vergrößerter erster Finger ist ein weitgehend bekanntes Merkmal, das aber auch bei anderen Syndromen wie der Akrozephalopolysyndaktylie auftritt, während die Form der distalen Phalangen spezifischer für RSTS zu sein scheint. Darüber hinaus sind Talonhöcker, die oft übersehen werden, ebenfalls sehr spezifisch für RSTS. Angesichts der verschiedenen Berichte und der diagnostischen und prognostischen Bedeutung dieser Merkmale ist eine multizentrische Prävalenzstudie zu Gehirn- und Wirbelsäulenanomalien erforderlich; eine Screening-MRT des Gehirns/der Hirnschädel könnte zusätzlich zur Basisdiagnostik nützlich sein. Was die endokrinologischen Merkmale anbelangt, so wurden vor kurzem weitere Informationen hinzugefügt, insbesondere zur Form und Funktion der Schilddrüse, und wir wissen persönlich von zwei weiteren Fällen mit leichtem Hypothyreoidismus und kleiner Schilddrüse. Neben der geistigen Behinderung sind bei RSTS-Patienten auch einige Verhaltensänderungen bekannt, doch gibt es keine aussagekräftigen Belege für den diagnostischen Wert dieser neuropsychiatrischen Merkmale bei der RSTS-Diagnose. Daher sind keine neuropsychiatrischen Merkmale aussagekräftig genug, um in die Diagnosekriterien für RSTS aufgenommen zu werden, obwohl einige Merkmale eher auf EP300-Mutationen hindeuten könnten. In diesen Fällen ist die Intelligenzminderung gering oder nicht vorhanden, und es überwiegen Verhaltensstörungen (z. B. Angstzustände). Zu den weiteren Merkmalen, die auf EP300-Mutationen hindeuten, gehören Präeklampsie und weniger signifikante Anomalien an der ersten Stelle, die den Hinweis auf die Erstellung von Differenzialkriterien für EP300 und auf ein präziseres und individuelleres Laborflussdiagramm geben. Nach unserem Kenntnisstand ist dies die einzige mögliche Änderung der Reihenfolge der molekularen Untersuchungen, da andere Genotyp-Phänotyp-Korrelationen nur vorläufig sind. Bei der Nachsorge von RSTS können zahlreiche unspezifische Komplikationen auftreten; daher ist es schwierig, ein allgemeines und effizientes Nachsorgeprotokoll zu erstellen. Darüber hinaus wurden keine robusten Genotyp-Phänotyp-Korrelationen festgestellt. Im Allgemeinen sollten die orthopädische Nachsorge, die Überwachung der Ernährung im Jugendalter und in neuropsychiatrischen Phasen sowie ophthalmologische Untersuchungen bei Erwachsenen im Vordergrund stehen. Ein weniger strenges Nachsorgeprotokoll ist möglicherweise nur für RSTS-Patienten mit EP300-Mutationen geeignet, wobei der Schwerpunkt auf Hautproblemen (Pilomatrixome und Nävi) liegt, die wahrscheinlich häufiger auftreten als bei Patienten mit CREBBP-Mutationen. Was die genetische Beratung anbelangt, so sind Speichelbürsten- und Gentests wichtig für die Bewertung des Rückfallrisikos bei Eltern mit Keim- und somatischem Mosaizismus.
Eine Diskussion über kritische Aspekte des Fortschritts im Verständnis der Ätiopathogenese von RSTS würde den Rahmen dieser Übersichtsarbeit sprengen, aber es wurden verschiedene Mausmodelle mit interessanten Ergebnissen erstellt.

