THE ACID-BASE BEHAVIOUR OF AMINO ACIDS
This page looks at what happens to amino acids as you change the pH by adding either acids or alkalis to their solutions.
For simplicity, the page only looks at amino acids which contain a single -NH2 group and a single -COOH group.
Amino acids as zwitterions
Zwitterions in simple amino acid solutions
An amino acid has both a basic amine group and an acidic carboxylic acid group.
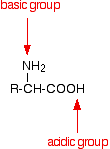
There is an internal transfer of a hydrogen ion from the -COOH group to the -NH2 group to leave an ion with both a negative charge and a positive charge.
This is called a zwitterion.

This is the form that amino acids exist in even in the solid state. Löst man die Aminosäure in Wasser, enthält eine einfache Lösung auch dieses Ion.
Ein Zwitterion ist eine Verbindung, die keine elektrische Gesamtladung hat, sondern getrennte Teile enthält, die positiv und negativ geladen sind.
Zugabe einer Lauge zu einer Aminosäurelösung
Erhöht man den pH-Wert einer Aminosäurelösung durch Zugabe von Hydroxidionen, wird das Wasserstoffion aus der -NH3+-Gruppe entfernt.
![]()

Mit Hilfe der Elektrophorese könnte man zeigen, dass die Aminosäure nun als negatives Ion vorliegt.
In ihrer einfachsten Form besteht die Elektrophorese aus einem Stück angefeuchtetem Filterpapier auf einem Objektträger mit einer Krokodilklemme an jedem Ende, die an eine Batterie angeschlossen ist. In die Mitte des Papiers wird ein Tropfen einer Aminosäurelösung gegeben.
Obwohl die Aminosäurelösung farblos ist, kann ihre Position nach einiger Zeit durch Besprühen mit einer Ninhydrinlösung festgestellt werden. Lässt man das Papier trocknen und erwärmt es dann leicht, zeigt sich die Aminosäure als farbiger Fleck.
Die Aminosäure wandert zur Anode (der positiven Elektrode).
Zugabe einer Säure zu einer Aminosäurelösung
Wenn man den pH-Wert durch Zugabe einer Säure zu einer Aminosäurelösung senkt, nimmt der -COO-Teil des Zwitterions ein Wasserstoffion auf.
![]()
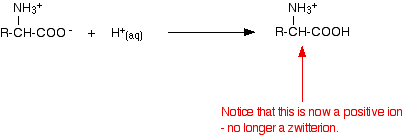
Dieses Mal würde sich die Aminosäure bei der Elektrophorese zur Kathode (der negativen Elektrode) hin bewegen.
Die Verschiebung des pH-Wertes von einem Extrem zum anderen
Angenommen, man beginnt mit dem Ion, das wir gerade unter sauren Bedingungen hergestellt haben, und fügt ihm langsam Alkali hinzu.
Dieses Ion enthält zwei saure Wasserstoffatome – den in der -COOH-Gruppe und den in der -NH3+-Gruppe.
Das saurere Wasserstoffatom ist das in der -COOH-Gruppe, und dieses wird zuerst entfernt – und man erhält das Zwitterion.
![]()
![]()
Wenn man also genau die richtige Menge Alkali hinzugefügt hat, hat die Aminosäure keine positive oder negative Nettoladung mehr. Das bedeutet, dass sie sich während der Elektrophorese weder zur Kathode noch zur Anode bewegt.
Der pH-Wert, bei dem diese fehlende Bewegung während der Elektrophorese auftritt, wird als isoelektrischer Punkt der Aminosäure bezeichnet. Dieser pH-Wert variiert von Aminosäure zu Aminosäure.
Wenn man weiterhin Hydroxidionen hinzufügt, erhält man die Reaktion, die wir bereits gesehen haben, bei der ein Wasserstoffion von der -NH3+-Gruppe entfernt wird.
![]()
![]()