Un électrolyte est un composé chimique qui se dissocie en ions et qui est donc capable de transporter une charge électrique – c’est-à-dire qu’un électrolyte est un conducteur électrique ; contrairement aux métaux, le flux de charge n’est pas un flux d’électrons, mais un mouvement d’ions.
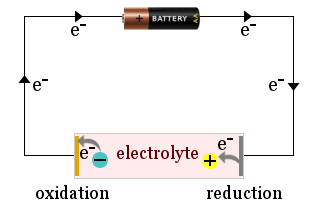
Par exemple, le schéma montre une batterie domestique utilisée pour attirer les ions de l’électrolyte vers les électrodes d’une cellule électrochimique, où les ions gagnent des électrons (sont réduits) ou perdent des électrons (sont oxydés).
Parfois, les électrodes elles-mêmes réagissent, par exemple une électrode métallique pourrait être oxydée et libérer des ions dans l’électrolyte.
Les électrolytes peuvent être solides, liquides ou en solution.
Exemples d’électrolytes
1. Le chlorure de sodium fondu sert d’électrolyte dans la production de sodium métal. Du chlore gazeux est également produit.
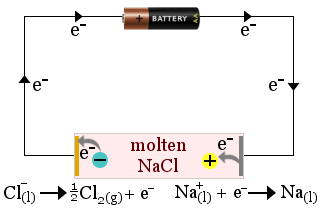 Dans ce cas, l’électrolyte est consommé par les réactions d’oxydoréduction de la pile.
Dans ce cas, l’électrolyte est consommé par les réactions d’oxydoréduction de la pile.
2. L’hydroxyde de potassium dissous dans l’eau produit un électrolyte très conducteur dans la pile Edison, une des premières piles rechargeables.
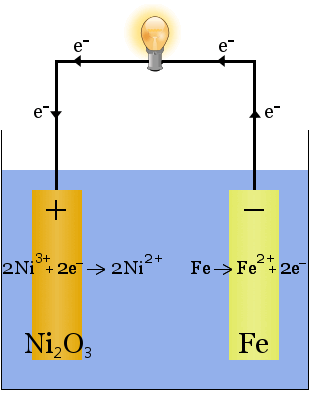
Contrairement au cas de la production de sodium ci-dessus, aucun électrolyte n’est consommé dans cette réaction.Le rôle de l’hydroxyde de potassium dans ce cas est d’augmenter la disponibilité des ions pour augmenter la conductivité de l’électrolyte et compléter le circuit électrique.
Les équations chimiques des réactions aux électrodes sont :
Pour la décharge, les équations se lisent de gauche à droite ; pour la charge de droite à gauche.
3. Traditionnellement, les électrolytes étaient des liquides pour permettre le mouvement des ions.Cependant, il existe maintenant des matériaux solides qui permettent aux ions de se déplacer facilement à travers leurs structures.Les électrolytes solides sont souhaitables dans de nombreux produits de consommation, car ils ne fuient pas.
Le sulfure de lithium-étain-phosphore, Li10SnP2S12, est un électrolyte solide utilisé dans les batteries au lithium-ion.La structure cristalline de l’électrolyte solide combinée à sa faible interaction avec les ions de lithium fournit un environnement dans lequel les ions de lithium peuvent facilement sauter.
4. Les électrolytes sont énormément importants pour les processus électrochimiques dans les organismes vivants.Les principaux ions de ces électrolytes sont le calcium (Ca2+), le magnésium (Mg2+), le sodium (Na+), le potassium (K+), le chlorure (Cl-), le carbonate d’hydrogène (HCO3-) et le phosphate d’hydrogène (HPO42-).
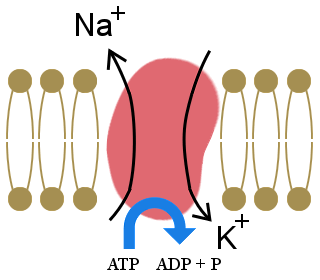
The importance of the sodium-potassium pump, shown in the diagram, to our lives is illustrated by the fact that it uses one-third of our resting energy.The pump maintains our cells’ electrolyte balance, with excess potassium ions inside cells and excess sodium ions outside cells.
This concentration gradient creates a voltage across the cell wall, which allows electrical signals to be transmitted in neurons and in muscles.It also provides the energy for processes in cell-membranes.
