L’œdème maculaire cystoïde (OMC) pseudophaque, également connu sous le nom de syndrome d’Irvine-Gass, entraîne une perte de vision indolore et se manifeste généralement 4 à 6 semaines après une chirurgie de la cataracte, bien que les facteurs de risque de cette complication puissent souvent être identifiés beaucoup plus tôt. Les patients présentant un risque accru d’EMC sont ceux atteints de diabète sucré en l’absence de rétinopathie, ceux atteints de diabète avec rétinopathie (risque relatif de 1,80 et 6,23, respectivement), les patients ayant des antécédents de membrane épirétinienne (RR 5.60) ou d’uvéite (RR 2,88), et ceux présentant une occlusion de la veine rétinienne (RR 4,47).1
Il est important d’éduquer les patients qui présentent un risque accru d’EMC avant l’intervention, car cela contribuera à atténuer leur consternation si la complication se produit. Certaines complications peropératoires, telles que la rupture capsulaire postérieure et la rétention de matériau du cristallin, sont également connues pour augmenter l’incidence de l’EMC2. Si le patient est confronté à l’une de ces complications, une dilatation fréquente au cours de la période postopératoire peut être indiquée pour faciliter la détection des signes d’EMC.
Voici quelques perles à garder à l’esprit lorsque vous comanagez des patients opérés de la cataracte.
FLEURS ROUGES
Les facteurs étiologiques proposés pour l’EMC postopératoire comprennent l’inflammation, la traction vitréomaculaire et l’instabilité vasculaire. L’étiologie primaire semble être les médiateurs inflammatoires non régulés dans l’humeur aqueuse et le vitré à la suite de la manipulation chirurgicale. Ces médiateurs (par exemple, les leucotriènes et les prostaglandines) perturbent les barrières sang-aqueux et sang-rétine, entraînant une augmentation de la perméabilité3. Le moment de l’apparition typique de l’EMC peut être dû au temps que mettent ces médiateurs inflammatoires à atteindre le fond de l’œil à partir du segment antérieur.
La suspicion d’un EMC est motivée par une diminution de l’AV ou une métamorphopsie qui ne peut pas être expliquée par d’autres étiologies associées à la chirurgie de la cataracte, notamment un défaut de réfraction résiduel, un œdème cornéen, une malposition du cristallin ou une opacification capsulaire postérieure.
L’EMC visuellement significatif est relativement peu fréquent, puisqu’il survient dans 0,1 % à 3,5 % des yeux après une chirurgie de la cataracte.4-6 L’œdème maculaire non visuellement significatif est beaucoup plus fréquent. Il est observé dans 3 à 41 % des yeux évalués par OCT et dans 20 à 55 % des yeux évalués par angiographie à la fluorescéine.7
La VA et les symptômes du patient doivent déterminer la nécessité d’une imagerie OCT. Une vision floue en l’absence d’autres constatations nécessite un examen attentif du fond d’œil dilaté et un OCT maculaire (figure 1). L’imagerie de routine de tous les patients peut en identifier certains qui présentent une MEC asymptomatique et entraîner un traitement inutile et l’angoisse du patient.
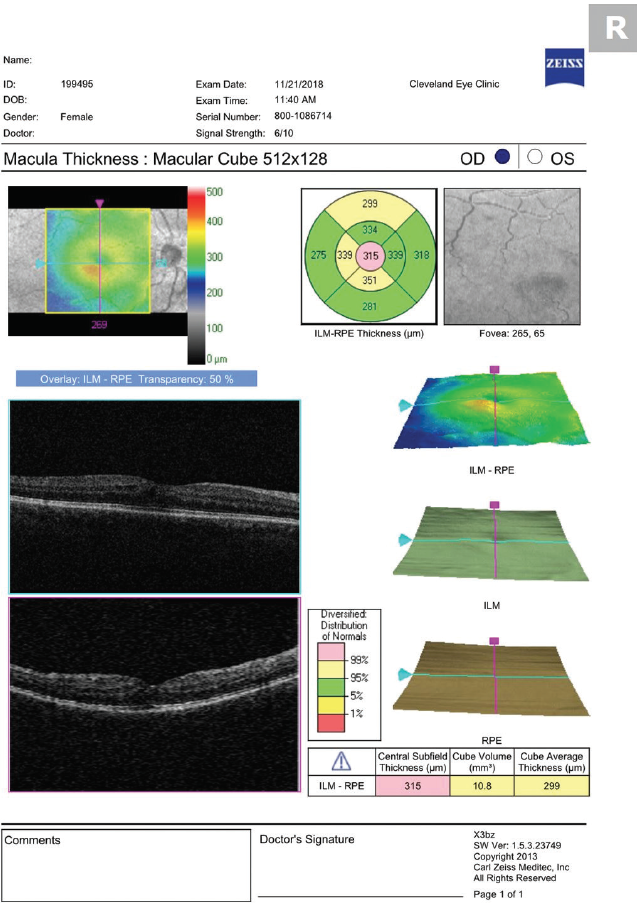
Figure 1. L’OCT réalisé 30 jours après la chirurgie de la cataracte montre un OMEC léger.
Traitement de l’OMEC
Il n’existe pas de consensus définissant le besoin optimal de prévention ou de traitement de l’OMEC. On a constaté qu’un traitement prophylactique avec un anti-inflammatoire non stéroïdien (AINS) topique avant une chirurgie de la cataracte réduisait l’incidence de l’EMC en postopératoire ; cependant, les effets visuels de l’EMC qui se sont produits étaient insignifiants à long terme (>3 mois).8
Récemment, la suspension intraoculaire de dexaméthasone 9% (Dexycu, Eyepoint Pharmaceuticals) a reçu l’approbation de la FDA pour une injection derrière l’iris au moment de la chirurgie de la cataracte. Cette formulation s’est avérée sûre et efficace dans le traitement de l’inflammation survenant après une chirurgie de la cataracte et peut constituer une alternative à l’instillation postopératoire de gouttes de stéroïdes.9
Les anti-inflammatoires topiques postopératoires prophylactiques réduisent l’incidence de l’EMC. Une analyse de 30 essais cliniques randomisés, comprenant une chirurgie de la cataracte sans complication chez des patients non diabétiques, a démontré que les AINS topiques postopératoires réduisaient significativement les chances de développer un EMC par rapport aux corticostéroïdes topiques postopératoires.10 Cette analyse a également révélé qu’une combinaison de corticostéroïdes et d’AINS était supérieure aux corticostéroïdes topiques seuls.
Si un patient développe un EMC malgré un traitement prophylactique, la condition peut généralement être gérée avec des médicaments topiques. Bien que l’œdème soit souvent autolimité au cours de plusieurs mois, le traitement AINS topique est efficace pour réduire l’EMC détecté par l’OCT et peut accélérer la récupération visuelle après la chirurgie par rapport au placebo.11 L’association d’un corticostéroïde et d’un AINS semble également être supérieure à l’un ou l’autre des anti-inflammatoires seuls. Dans une étude, l’amélioration moyenne de l’AV de Snellen sur 3 mois était de 1,6 ligne chez les patients recevant un AINS, de 1,1 ligne chez les patients recevant un stéroïde et de 3,8 lignes chez les patients recevant une combinaison.12
Dans notre pratique, nous prescrivons de l’acétate de prednisolone à 1 % et du kétorolac à 0,5 % à utiliser quatre fois par jour jusqu’à la résolution de l’EMC, suivis d’une diminution progressive de 3 semaines. Nous diminuons ces deux médicaments selon les recommandations du groupe de rétine avec lequel nous travaillons (trois fois par jour pendant une semaine, puis deux fois par jour pendant une semaine, puis une fois par jour pendant une semaine). Ne vous inquiétez pas si la gravité de l’EMC s’aggrave juste après le début du traitement topique. Tout comme l’apparition tardive de l’œdème (que l’on suppose être due au temps que mettent les médiateurs inflammatoires à atteindre la rétine à partir du segment antérieur), il faut également du temps pour que les médicaments atteignent la rétine à partir de la surface oculaire (figures 2 et 3).
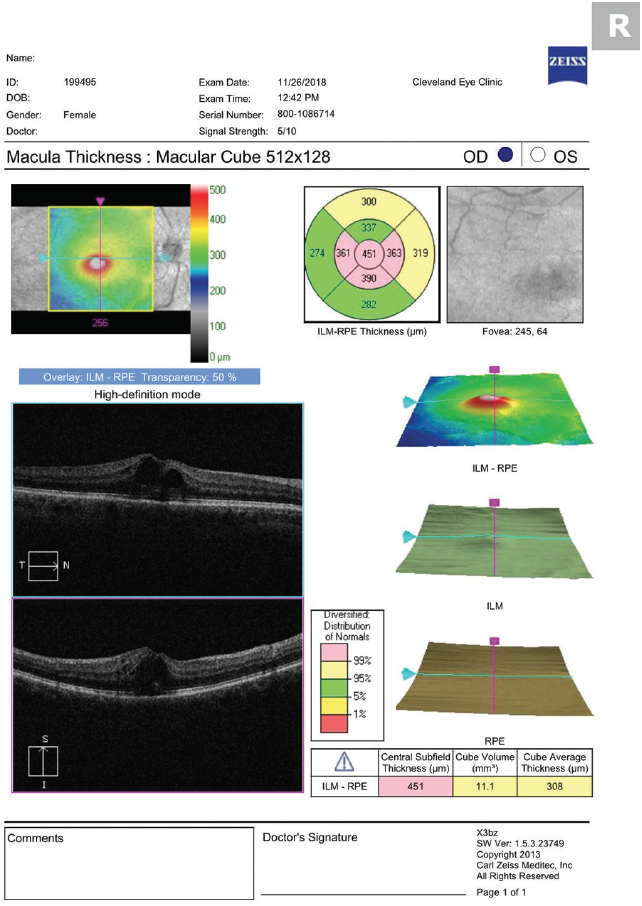
Figure 2. Un OCT réalisé 5 jours après le début du traitement par acétate de prednisolone et kétorolac quatre fois par jour montre une aggravation de l’OMEC.
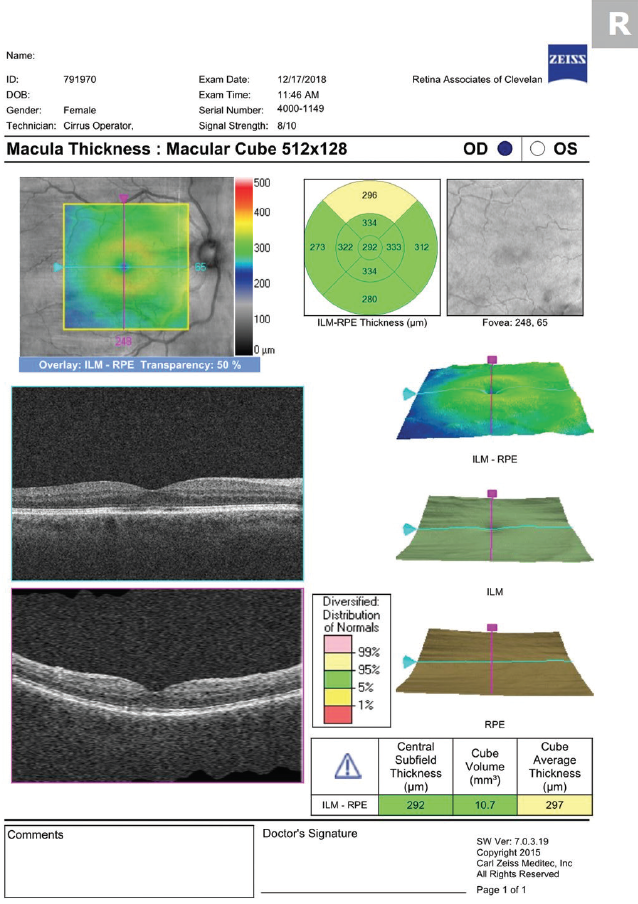
Figure 3. L’OCT réalisé 1 mois après le début du traitement démontre la résolution de l’EMC.
L’EMC récalcitrant nécessite souvent une intervention supplémentaire pour une récupération visuelle. Si des améliorations structurelles (résultats de l’OCT) et fonctionnelles (VA) ne se produisent pas dans le mois qui suit le traitement topique, une orientation vers un spécialiste de la rétine est indiquée. Il a été démontré que les injections périoculaires de stéroïdes (sous-ténoniennes et rétrobulbaires) réduisent l’œdème et améliorent l’AV dans l’EMC réfractaire au traitement topique.13 Les injections intraoculaires de stéroïdes et les implants intravitréens à libération prolongée ont également amélioré les résultats chez les patients atteints d’EMC chronique.14
Les injections d’anti-VEGF se sont également avérées bénéfiques pour le traitement de l’EMC chronique. Une étude rétrospective multicentrique a révélé que 72 % des yeux atteints d’EMC réfractaire traités par au moins une injection intravitréenne de bevacizumab (Avastin, Genentech) présentaient une amélioration de l’AV et une réduction de l’épaisseur maculaire centrale moyenne à 12 mois.15
Dans certains cas, des méthodes chirurgicales doivent être employées pour traiter l’EMC. Par exemple, l’ablation chirurgicale du matériau retenu dans le cristallin peut être nécessaire pour résoudre un ECM récalcitrant. La vitrectomie pars plana a également permis d’améliorer les résultats visuels pour l’EMC qui n’a pas répondu au traitement médical16.
Points à retenir
Dans la cogestion des patients ayant subi une chirurgie de la cataracte, il est utile de pouvoir reconnaître les complications courantes telles que l’EMC et de savoir comment procéder lorsqu’elles sont détectées.
En résumé, identifiez les patients à risque (ceux qui ont un diabète, une membrane épirétinienne, une uvéite ou une occlusion veineuse rétinienne) avant l’opération. Soyez également conscient des complications peropératoires qui peuvent augmenter le risque d’EMC (par exemple, rupture capsulaire postérieure, rétention de fragments de lentille). Éliminez les autres causes de flou postopératoire et effectuez un examen dilaté minutieux et une OCT maculaire pour identifier l’OMC. Expliquez au patient et rassurez-le sur le fait que l’OMÉ est une affection traitable. Traiter topiquement avec des AINS et des stéroïdes, et référer à un spécialiste de la rétine pour une intervention plus poussée si l’ECM est récalcitrant.
1. Henderson BA, Kim JY, Ament CS, Ferrufino-Ponce ZK, Grabowska A, Cremers SL. Œdème maculaire cystoïde pseudophaque clinique. Risk factors for development and duration after treatment. J Cataract Refract Surg. 2007;33(9):1550-1558.
2. Kim SJ, Belair ML, Bressler NM, et al. Une méthode pour signaler l’œdème maculaire après une chirurgie de la cataracte en utilisant la tomographie par cohérence optique. Retina. 2008;28(6):870-876.
3. Benitah NR, Arroyo JG. Œdème maculaire cystoïde pseudophaque. Int Ophthalmol Clin. 2010;50(1):139-153.
4. Powe NR, Schein OD, Gieser SC, et al. Synthèse de la littérature sur l’acuité visuelle et les complications après une extraction de cataracte avec implantation de lentille intraoculaire. Équipe de recherche sur les résultats des patients atteints de cataracte. Arch Ophthalmol. 1994;112(2):239-252.
5. Greenberg PB, Tseng VL, Wu WC, et al. Prévalence et prédicteurs des complications oculaires associées à la chirurgie de la cataracte chez les vétérans des États-Unis. Ophtalmology. 2011;118(3):507-514.
6. Clark A, Morlet N, Ng JQ, et al. Whole population trends in complications of cataract surgery over 22 years in Western Australia. Ophtalmology. 2011;118(6):1055-1061.
7. Bélair ML, Kim SJ, Thorne JE, et al. Incidence de l’œdème maculaire cystoïde après une chirurgie de la cataracte chez les patients avec et sans uvéite en utilisant la tomographie par cohérence optique. Am J Ophthalmol. 2009;148(1):128-135.
8. Grzybowski A, Kim SJ. Corticostéroïdes substitués par des anti-inflammatoires non stéroïdiens : la médecine factuelle le justifie-t-elle ? J Cataract Refract Surg. 2016;42(3):510-511.
9. Donnenfeld E, Holland E. Suspension intra-camérale de dexaméthasone pour l’inflammation associée à la chirurgie de la cataracte : un essai de phase III randomisé, contrôlé par placebo. Ophtalmologie. 2018;125(6):799-806.
10. Heier JS, Topping TM, Baumann W, et al. Kétorolac versus prednisolone versus thérapie combinée dans le traitement de l’œdème maculaire cystoïde pseudophaque aigu. Ophtalmology. 2000;107(11):2034-2039.
11. Kim SJ, Schoenberger SD, Thorne JE, Ehlers JP, Yeh S, Bakri SJ. Les anti-inflammatoires non stéroïdiens topiques et la chirurgie de la cataracte : un rapport de l’Académie américaine d’ophtalmologie. Ophtalmologie. 2015;122(11):2159-2168.
12. Shelsta HN, Jampol LM. Traitement pharmacologique de l’œdème maculaire cystoïde pseudophaque : mise à jour 2010. Retina. 2011;31(1):4-12.
13. Benhamou N, Massin P, Haouchine B, Audren F, Tadayoni R, Gaudric A. Triamcinolone intravitréenne pour l’oedème maculaire pseudophaque réfractaire. Am J Ophthalmol. 2003;135(2):246-249.
14. Bellocq D, Korobelnik JF, Burillon C, et al. Effectiveness and safety of dexamethasone implants for post-surgical macular oedema including Irvine-Gass syndrome: the EPISODIC study. Br J Ophthalmol. 2015;99(7):979-983.
15. Arevalo JF, Maia M, Garcia-Amaris RA, et al; Pan-American Collaborative Retina Study Group. Intravitreal bevacizumab for refractory pseudophakic cystoid macular edema: The Pan-American Collaborative Retina Study Group results. Ophthalmology. 2009;116:1481-1487.
16. Cardone S, et al. The role of pars plana vitrectomy for pseudophakic cystoid macular edema. Invest Ophthalmol Vis Sci. 2003;44(7):3012.

Charles A. Roseman, OD
- Cleveland Eye Clinic, Ohio
- [email protected]
- Financial disclosure: None