Introduction
Deux signaux visuels apparaissant simultanément sont détectés plus rapidement que chacun des signaux apparaissant seul (Hershenson, 1962 ; Raab, 1962). Une partie de cet effet de cible redondante (RTE) peut être expliquée de manière stochastique par un modèle de » course de chevaux « . C’est-à-dire que si deux stimuli sont traités dans des canaux parallèles et indépendants pour lesquels la vitesse de traitement varie aléatoirement d’un essai à l’autre, à chaque présentation, le stimulus le plus rapide gagne la course et atteint le seuil de détection pour déclencher la réponse ; par conséquent, en moyenne, deux stimuli sont plus susceptibles de produire une réponse plus rapide que le temps de réponse moyen à un seul stimulus traité dans l’un ou l’autre des deux canaux.
Cependant, les analyses des distributions de fréquences cumulées ont montré qu’il existe une contribution supplémentaire au RTE qui ne peut être prise en compte par un modèle de course de chevaux entre deux canaux indépendants. Miller (1982) a proposé un modèle de » co-activation » dans lequel les deux signaux sont additionnés dans un pool d’activation. Miniussi et al. (1998) ont montré que les cibles redondantes produisaient des latences plus courtes pour les potentiels cérébraux liés à l’événement P1 et N1, ce qui indique que la sommation neurale se produit tôt dans la voie visuelle. Des expériences menées chez des patients hémianopes ont également montré que la RTE ne peut pas être entièrement expliquée par une course de chevaux pour atteindre le seuil de détection, puisqu’une RTE peut se manifester même en l’absence de conscience phénoménale d’un des deux stimuli (Marzi et al., 1986 ; Tomaiuolo, 1997 ; de Gelder et al., 2001 ; Leh et al., 2006a,b). En effet, chez les patients hémisphérectomisés, une cible redondante dans le champ aveugle ne génère pas seulement un RTE, le RTE est augmenté lorsque le stimulus redondant complète un motif de gestalt (Georgy et al., 2016). Ces observations chez les hémianopsiques suggèrent que la sommation neuronale se produit de manière sous-corticale et ne dépend pas du cortex visuel primaire.
Les preuves indirectes cumulées ont impliqué le colliculus supérieur (SC) comme substrat de la sommation neuronale qui contribue à la RTE. Cependant, aucune preuve directe n’a encore été rapportée. La présente étude porte sur la voie neuronale qui transmet les signaux visuels qui sont intégrés dans le CS. Le SC est constitué de couches superficielles et profondes. Les couches profondes du colliculus reçoivent des afférences, à la fois directement et via les ganglions de la base, du cortex oculomoteur (Hikosaka et Wurtz, 1983 ; Pare et Wurtz, 1997 ; Sommer et Wurtz, 2000). Les afférences visuelles aux couches superficielles du colliculus, cependant, sont transmises à la fois de la rétine (via le tractus rétino-tectal) et du cortex visuel précoce (Fries, 1984), via le brachium du SC.
Puisque des effets de sommation neuronale ont été démontrés chez des patients neurologiques dépourvus de cortex visuel, les signaux visuels sommés dans le colliculus pourraient être transmis directement de la rétine aux couches superficielles du colliculus via le tractus rétino-tectal. Si tel est le cas, la sommation neuronale pourrait être abolie par des lésions du brachium du SC.
Les lésions qui perturbent le brachium du SC sont très rares. Nous rapportons ici des études de cas uniques de deux patients présentant des lésions sous-corticales unilatérales qui ont désafférenté le SC de l’entrée visuelle, et qui n’ont pas manifesté de RTE. L’un des patients présentait une lésion endommageant à la fois le noyau pulvinaire du thalamus, le SC rostral et son brachium. Chez l’autre patient, présentant des lésions du mésencéphale dorsal dues à un traumatisme crânien, le SC semblait intact, mais son brachium était perturbé.
Matériel et méthodes
Participants
Deux patients neurologiques, chacun avec son propre groupe de contrôle apparié à l’âge, ont été testés dans le cadre d’une expérience visant à mesurer le RTE.
RE était âgé de 71 ans au moment du test. Une hémorragie thalamique postérieure 3 ans plus tôt a détruit le pulvinar médian, les noyaux thalamiques ventro-latéraux et la branche postérieure de la capsule interne avec des dommages s’étendant dans le mésencéphale dorsal, y compris le pretectum et le SC rostral (Figure 1).La tractographie probabiliste DTI (Behrens et al., 2003, Behrens et al., 2007) a confirmé que la lésion a détruit le brachium du SC (Figure 2). RE était paralysée sur le côté gauche de son corps avec une perte de sensation dans le visage et le bras gauche. Elle présentait des mouvements oculaires anormaux, notamment une rétraction des paupières, des mouvements oculaires verticaux paralysés et une convergence altérée, conséquence de l’extension de la lésion dans le mésencéphale dorsal.
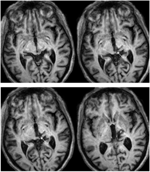
FIGURE 1. IRM haute résolution (0,7 mm3) pondérée en T1 de la patiente RE. Coupes axiales du ventral (en haut à gauche) au dorsal (en bas à droite) montrant la lésion dans le mésencéphale dorsal droit et le thalamus. Extension de la lésion dans le colliculus supérieur rostral (SC) indiquée par des flèches blanches.
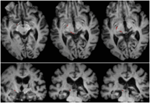
FIGURE 2. Tractographie démontrant le tractus rétinotectal chez le patient RE coïncidant avec des coupes axiales pondérées en T1 (en haut de ventral à dorsal) et des coupes coronales (en bas d’antérieur à postérieur). Le tracé du tractus rétinotectal est montré dans l’hémisphère gauche (rouge). Aucune ligne de courant n’a été tracée dans l’hémisphère droit et, par comparaison avec l’hémisphère intact, on peut voir que la lésion a détruit le brachium du SC dans l’hémisphère droit. La ligne de courant représentée en rouge a été générée par tractographie probabiliste à l’aide de FSL FDT (FMRIB Diffusion Toolbox ; Behrens et al., 2003, Behrens et al., 2007 ; http://fsl.fmrib.ox.ac.uk/fsl/fslwiki). Les images de résonance magnétique écho-planaires pondérées en diffusion ont été acquises à une résolution de 1,5 mm3 avec 32 directions d’encodage de diffusion distribuées de manière isotrope (b = 800) et une ligne de base (b = 0). Temps de répétition = 2 s, et temps d’écho = 35 ms. Pour la tractographie probabiliste, nous avons marqué manuellement la région de départ (c’est-à-dire dessiné des masques d’ensemencement) sur le tractus optique de chaque hémisphère juste en arrière du chiasma et une région cible (masque cible) sur le SC.
ML était âgée de 23 ans au moment du test. Elle avait subi une grave lésion cérébrale traumatique lors d’un accident de la route 7 ans auparavant, entraînant une lésion axonale diffuse avec une hémorragie dans le putamen droit et le mésencéphale dorsal. Les détails de son histoire, de son examen neurologique et des résultats de la neuro-imagerie ont été rapportés par (Poliva et al., 2015). Bien qu’il y ait eu quelques déficiences motrices, notamment une spasticité et une ataxie, elle a retrouvé son indépendance. Son principal handicap était une agnosie auditive sévère due à des lésions des voies auditives du tronc cérébral, y compris le colliculus inférieur gauche. L’acuité visuelle et les champs visuels n’étaient pas altérés et il n’y avait pas de négligence ou d’extinction visuelle. Les signes oculomoteurs d’un dysfonctionnement du mésencéphale comprenaient des saccades en ondes macro-carrées et un spasme de convergence lors du regard vertical (vers le bas plus que vers le haut.) Il n’y avait ni ptosis ni anomalie pupillaire. L’IRM à haute résolution a montré une cavité kystique dans le putamen droit, au site de l’hémorragie précédente, et une petite lésion périventriculaire dans la partie inférieure du pons droit, dans la région du pédoncule cérébelleux inférieur (figure 3). Elle présentait une avulsion presque complète du colliculus inférieur gauche, n’épargnant que ses parties les plus médiales et caudales. Les dommages s’étendaient dans le pretectum latéral et le tegmentum cérébral moyen, détruisant la brachie des colliculi supérieurs et inférieurs, et ventralement dans le noyau rouge. La tractographie probabiliste DTI a confirmé que la lésion a détruit le brachium du SC (Figure 4).
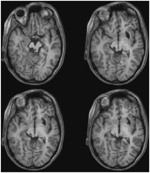
FIGURE 3. IRM haute résolution (0,7 mm3) pondérée en T1 du patient ML. Coupes axiales du ventral (en haut à gauche) au dorsal (en bas à droite) montrant des dommages au colliculus inférieur gauche et au tegmentum mésencéphalique ventral et latéral au SC.
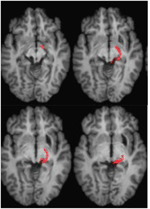
FIGURE 4. Tractographie DTI chez le patient ML montrant le tractus rétino-tectal dans l’hémisphère droit (rouge) coïncidant avec les images RM pondérées en T1 dans le plan axial, de ventral (en haut à gauche) à dorsal (en bas à droite). Les images de résonance magnétique écho-planaires pondérées en fonction de la diffusion ont été acquises à une résolution de 2 mm3 avec 63 directions d’encodage de diffusion distribuées de manière isotrope (b = 1000) et une ligne de base (b = 0). Temps de répétition = 2 s, et temps d’écho = 35 ms. La tractographie a été mise en œuvre comme décrit dans la figure 2.
Les sujets témoins neurologiquement sains pour le patient RE comprenaient 11 adultes âgés (six femmes et cinq hommes, âge moyen : 68,5, fourchette 59-73). Ils ont été recrutés à partir du panel de participants communautaires de l’Université de Bangor. Les participants ne présentaient aucune déficience neurologique, psychologique, psychiatrique ou cognitive connue et tous les participants avaient une vision normale/corrigée à la normale. Les participants ont reçu un paiement de 6 £ pour leur participation.
Les sujets témoins neurologiquement sains pour le patient ML comprenaient 11 étudiants de premier cycle et de troisième cycle de l’Université de Bangor âgés de 18 à 26 ans (sept femmes et quatre hommes).
Appareil et conditions de visualisation
Le logiciel de programmation Presentation® fonctionnant sur un ordinateur PC a enregistré les réponses de temps de réaction (RT) et a généré des stimuli qui ont été présentés sur un moniteur Dell (12,5″ × 25″, fréquence de rafraîchissement 60 Hz.) placé au niveau des yeux à 57 cm devant les participants avec une visualisation binoculaire dans des conditions de lumière tamisée. Un menton et un appui-tête étaient utilisés pour assurer la stabilité de la tête. Les réponses des participants ont été enregistrées via une pression sur la barre d’espacement d’un clavier.
Stimuli
Les stimuli expérimentaux consistaient en des carrés de marqueurs blancs non remplis (1 cm × 1 cm) positionnés à 8° à gauche et à droite d’une petite boîte de fixation (0,2 cm × 0,2 cm) au centre de l’écran. Les stimuli cibles consistaient à remplir l’une ou les deux cases de marquage périphériques pour produire un carré blanc plein. Tous les stimuli étaient présentés en blanc sur un fond gris.
La figure 5 montre la séquence d’un seul essai. Les cases de marqueurs sont restées visibles tout au long de l’expérience. Après un intervalle inter-essai de 1750 ms, la boîte de fixation est apparue pour commencer l’essai. Après un intervalle aléatoire allant de 250 à 750 ms (par incréments de 25 ms), une cible nécessitant une simple pression sur la barre d’espacement du clavier apparaissait à l’emplacement d’une ou des deux cases de marquage. La cible était un carré blanc rempli généré par le remplissage de l’une ou des deux cases de marqueur. De façon aléatoire et avec une probabilité égale, les cibles apparaissaient à gauche, à droite ou aux deux simultanément. Aucune cible n’est apparue lors des essais de capture (10 % des essais).
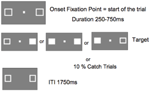
FIGURE 5. Séquence d’affichage d’un essai unique (ITI, intervalle inter-essai entre la réponse du participant et l’apparition du point de fixation débutant l’essai suivant).
Procédure
Chaque participant a été testé en une seule session. Après avoir lu les instructions à l’écran, les participants ont vu des exemples de tous les stimuli qui ont été présentés dans la tâche (la boîte de fixation et chacune des trois présentations de la cible) et a été invité à confirmer la reconnaissance de chaque cible par une pression sur la touche de la barre d’espace. Les instructions étaient de maintenir la fixation sur la boîte centrale pendant la durée de chaque essai, et de répondre aussi rapidement que possible en appuyant sur la barre d’espacement du clavier avec la main droite dès qu’une cible apparaissait.
Une fois que le participant a confirmé verbalement et par pression sur une touche que toutes les instructions étaient comprises, la présentation des essais de pratique (10 de chaque condition de présentation de la cible et 3 essais » catch » sans cible) a eu lieu. Un feedback à l’écran était présenté pendant la réalisation des essais d’entraînement, comprenant les énoncés suivants : (1) « Correct », (2) « Essayez de répondre plus vite ! » et (3) « Ne répondez que si vous voyez une cible ». Une fois la session d’entraînement terminée et que le participant et l’expérimentateur étaient convaincus que les instructions de la tâche avaient été comprises correctement, le participant était invité à commencer l’expérience. Les 30 premiers essais de chaque bloc expérimental ont été exclus comme essais de pratique. Chaque bloc comprenait un total de 233 essais : 70 essais à droite, 70 essais à gauche, 70 essais à droite et 70 essais à gauche et 23 essais de « rattrapage ». Une courte pause était accordée à la moitié du bloc. Le patient ML et les jeunes témoins ont été testés dans un seul bloc. En raison de la variabilité liée à l’âge et à l’état de la patiente RE, elle a été testée dans deux blocs sur des jours distincts ; et ses participants témoins appariés en âge ont également été testés dans deux sessions sur un seul jour.
Analyses
Pour chaque groupe témoin, le TR médian de chaque participant dans chaque condition (cible gauche, cible droite, cibles bilatérales) a été calculé après avoir exclu les essais suivant des essais de rattrapage et ceux dont le TR était <100 ms ou >800 ms. Un test t d’échantillon apparié a été effectué pour confirmer qu’il n’y avait pas d’asymétrie pour les réponses aux cibles unilatérales droites et gauches, et un RT moyen pour les cibles unilatérales a été calculé. Le RTE a été calculé en soustrayant les TR pour les essais bilatéraux des TR pour les essais unilatéraux. Un test t d’échantillon apparié a comparé l’unilatéral au bilatéral pour établir si le RTE était statistiquement fiable.
Pour chaque patient, après avoir exclu les essais suivant les essais de capture et ceux avec des RT de <100 ms ou >800 ms, un test t d’échantillon apparié a comparé les RT médians pour les cibles unilatérales contralatérales et ipsilatérales. Comme indiqué ci-dessous, les temps de réponse pour les cibles contralatérales étaient plus longs que pour les cibles unilatérales ipsilatérales. Afin de déterminer si la présence d’une cible contralésionnelle engendrait un RTE statistiquement fiable, un test t à échantillons appariés a comparé les RT médians pour les essais de cibles bilatérales avec les essais de cibles unilatérales ipsilésionnelles.
Pour tester si le RTE était plus petit de manière fiable pour chaque patient que pour leur groupe de contrôle respectif, le RTE a été calculé pour chaque participant au contrôle et les limites supérieures et inférieures des intervalles de confiance (IC) à 95 % ont été calculées. Le Z-score de l’ETR de chaque patient a été calculé par rapport à son groupe de contrôle et testé pour la fiabilité statistique avec le test t de Crawford.
Les valeurs P pour les tests t d’échantillons appariés ont été rapportées pour deux queues et pour le t de Crawford, une queue.
Résultats
RE des patients
Participants au contrôle : La moyenne des TR médians ne différait pas pour les réponses gauches et droites (t = 0,6.) La figure 6 montre que les TR étaient plus courts (le RTE) pour les cibles bilatérales que pour les cibles unilatérales gauches (t = 6,8, p < 0,001, ou droites (t1,10) = 3,8, p = 0,003). Le TR médian des essais de cibles bilatérales a été soustrait de la moyenne du TR médian des cibles unilatérales afin de calculer un TR moyen pour chaque participant du groupe témoin. Le RTE moyen du groupe témoin était de 24,3 ms (SEM = 2,75).

FIGURE 6. TR médians du patient RE, et moyenne des TR médians des participants du groupe témoin pour les cibles apparaissant dans le champ visuel gauche (‘Left’), le champ visuel droit (‘Right’), et simultanément dans les deux champs visuels (‘Both’). Les barres d’erreur des participants du groupe témoin indiquent les erreurs standard.
Les TR médians du patient RE étaient plus longs que ceux des témoins (figure 6), et étaient supérieurs à la limite supérieure de l’IC à 95 % des TR moyens du groupe témoin pour les trois conditions (gauche = 457 ms ; droite = 449 ms ; les deux = 426 ms). Les RT aux cibles unilatérales dans le champ contralésionnel (gauche) étaient plus longs que pour les cibles unilatérales dans le champ ipsilésionnel (droit) (t = 6,0, p < 0,001).
Important, il n’y avait pas de RTE : le RT médian pour les cibles bilatérales (500 ms) n’était pas plus court que pour les cibles unilatérales dans le champ visuel ipsilésionnel (droit) (494 ms ; t = 1,141), p = ns (figure 6). Le tableau 1 (en haut) montre que l’ETR calculé pour la patiente RE était significativement inférieur à l’ETR de son groupe témoin.

TABLE 1. Effet de cible redondante pour les patients RE (en haut) et ML (en bas), et RTE moyen pour leurs groupes de contrôle respectifs avec intervalles de confiance (IC) à 95 %, scores Z et test t de Crawford comparant chaque patient à son groupe de contrôle respectif.
Patient ML
Participants au contrôle : La moyenne des RT médians ne différait pas pour les réponses aux cibles gauches et droites (t = 0,86. La figure 7 montre que les RT étaient plus courts (le RTE) pour les cibles bilatérales que pour les cibles unilatérales gauches (t = 4,7, p = 0,001, ou droites (t1,11) = 7,8, p < 0,001).

FIGURE 7. RT médians pour le patient ML, et moyenne des RT médians pour les participants du groupe de contrôle pour les cibles apparaissant dans le champ visuel gauche, le champ visuel droit, et simultanément dans les deux champs visuels. Les barres d’erreur pour les participants du groupe témoin indiquent les erreurs standard.
Le RT médian pour les essais de cibles bilatérales a été soustrait de la moyenne du RT médian pour les cibles unilatérales gauche et droite afin de calculer un RTE pour chaque participant du groupe témoin.
L’ETR moyen du groupe était de 33 ms (SEM = 6,65).
Les TR médians du patient ML étaient plus longs que ceux des témoins (figure 7), et étaient supérieurs à la limite supérieure de l’IC à 95 % des TR moyens du groupe témoin pour les trois conditions (gauche = 322 ms ; droite = 307 ms ; les deux = 277 ms). Les TR pour les cibles unilatérales dans le champ droit (contralésionnel) étaient plus longs que pour les cibles unilatérales dans le champ gauche (ipsilésionnel) (t = 4,9, p = 0,001). Il n’y avait pas de RTE. Les RT pour les cibles bilatérales (361 ms) n’étaient pas plus courts que pour les cibles unilatérales dans le champ visuel ipsilésionnel (gauche) (363 ms). Le tableau 1 (en bas) montre que l’ETT calculé pour la patiente ML était significativement inférieur à l’ETT de son groupe témoin.
Discussion
Les RT simples ont été mesurés pour détecter des cibles uniques dans le champ contralésionnel ou ipsilésionnel, et des cibles bilatérales, chez deux patients chez qui le brachium du SC était endommagé dans un hémisphère. Chez l’un des patients (une jeune femme), la lésion se situait dans l’hémisphère gauche et était due à un traumatisme crânien ; et, bien que la lésion ait touché le colliculus inférieur et se soit étendue au tegmentum du mésencéphale, la neuro-imagerie à haute résolution n’a pas mis en évidence de dommages au SC en tant que tel. Chez l’autre patient (une femme âgée), la lésion se situait dans l’hémisphère droit et était due à une hémorragie hypertensive qui a également causé des dommages importants au pulvinar médian et au thalamus latéral et s’est étendue au mésencéphale dorsal, y compris au SC rostral. Chez les deux patients, le temps de réaction simple pour détecter des cibles visuelles dans le champ contralésionnel était plus lent que dans le champ ipsilésionnel. Aucun des deux patients n’a montré un effet de sommation spatiale (RTE) pour la détection des cibles lorsque les stimuli étaient présentés aux deux champs visuels.
Ces observations éclairent le rôle du SC dans la détection des cibles et, plus spécifiquement, le rôle des afférences visuelles au SC. Posner et al. (1980) ont défini de manière opérationnelle la détection comme étant mise en évidence par la capacité à effectuer une réponse arbitraire à un signal visuel (par exemple, une simple pression sur une touche avec un doigt, comme dans l’expérience actuelle). Ils ont postulé que la détection nécessite une allocation d’attention pour sélectionner la cible à traiter dans un système à capacité limitée qui lui donne la priorité pour agir.
Song et al. (2011) ont montré que l’inactivation du SC des singes provoque des déficits frappants de sélection de cible qui ne peuvent pas être facilement expliqués comme une simple déficience de la perception visuelle ou de l’exécution motrice, et ont suggéré qu’il contribue à une carte de priorité à but plus général. Dans cette expérience, on a présenté à des singes deux stimuli situés dans des champs visuels opposés et ils devaient indiquer, par une réponse d’atteinte, lequel apparaissait en premier. Un singe a été entraîné à tendre la main vers le stimulus qui apparaissait en premier et un autre a été entraîné à tendre la main vers la cible qui apparaissait en second. Dans les deux cas, il y avait une forte tendance à ne pas sélectionner la cible qui se trouvait dans le champ visuel controlatéral à la lésion. Étant donné que le même biais a été observé chez le singe qui a tendu la main vers la deuxième cible apparue, le biais ne pouvait pas être attribuable à un retard dans la perception de la cible contralésionnelle. L’inactivation du collet n’a pas entraîné une altération du jugement perceptif du stimulus apparu en premier. Au contraire, les stimuli dans le champ visuel controlatéral au colliculus inactivé étaient désavantagés dans leur priorité d’action.
Zhaoping (2016) a récemment mis en évidence une distinction entre les cartes de saillance neuronales et les cartes de priorité, et a plaidé pour une migration évolutive d’une carte de saillance perceptive du tectum optique/SC vers le cortex visuel primaire. Elle a proposé que les signaux de saillance puissent être transmis à une carte de priorité dans le SC sans projeter la propriété d’accord des caractéristiques.
Le brachium du SC transmet des signaux visuels afférents aux couches superficielles du colliculus depuis la rétine via le tractus rétino-tectal ; mais la majorité des fibres afférentes visuelles transmises par le brachium sont des projections du cortex visuel primaire. Si le brachium est perturbé, les signaux de saillance du cortex visuel primaire peuvent être relayés au colliculus via les champs oculaires frontaux. Mais en l’absence de projections directes vers les couches superficielles du colliculus à partir de la rétine ou du cortex visuel, comme nous supposons que c’est le cas chez les patients présentant des lésions du brachium, il faut plus de temps pour que la carte de priorité colliculaire soit activée, ce qui entraîne des réponses plus lentes aux signaux visuels contralésionnels.
Comme indiqué dans l’introduction, la contribution à l’ETT qui repose sur un modèle probabiliste de cheval de course dépend de la détection des deux cibles ; et d’une course dans laquelle l’efficacité des canaux indépendants dans lesquels les deux cibles sont transmises est équivalente, de sorte que le résultat de la course pour atteindre le seuil de détection est aléatoire d’un essai à l’autre. Puisque le seuil de détection des signaux contralésionnels est plus élevé chez les patients rapportés ici, les cibles redondantes ne pourraient pas bénéficier sur la base d’une course de chevaux stochastique ; c’est-à-dire que le résultat de la course entre les signaux ipsilésionnels et contralésionnels n’est pas aléatoire – les signaux contralésionnels sont plus susceptibles de perdre la course que de la gagner.
Néanmoins, la recherche chez les patients hémianopes a montré qu’il existe également une composante de sommation neuronale qui contribue à la RTE qui ne dépend pas de la détection des deux cibles (Marzi et al, 1986 ; Tomaiuolo, 1997 ; de Gelder et al., 2001). Puisqu’il a été démontré que les patients commissurotomisés ont une RTE(Marzi et al., 1986 ; Reuter-Lorenz et al., 1995), il a été avancé que l’intégration interhémisphérique des signaux à travers le méridien vertical doit se produire de manière sous-corticale.
Savazzi et Marzi (2004) ont montré que la sommation neuronale ne se produisait pas avec des stimuli de cibles chromatiques de courte longueur d’onde, que ce soit chez des personnes neurologiquement intactes ou des patients au cerveau divisé. Leh et al. (2006b) ont rapporté que, bien qu’une RTE se produise avec des stimuli achromatiques chez certains patients hémianopiques hémisphérectomisés, il n’y avait pas de RTE chez ces patients lorsque des stimuli chromatiques de courte longueur d’onde étaient utilisés comme cibles. Les stimuli à courte longueur d’onde (c’est-à-dire violets) n’activent que les cônes S de la rétine. Les cellules ganglionnaires de la rétine qui reçoivent une entrée des cônes S ne se projettent pas directement vers le SC, ni vers les couches magnocellulaires du noyau géniculé latéral (De Monasterio, 1978). Étant donné que les projections du cortex visuel primaire vers le SC à travers le brachium du SC ne relaient que les signaux visuels provenant des afférences magnocellulaires du noyau géniculé (Schiller et al., 1979), l’incapacité des stimuli du cône S à engendrer une RTE suggère que la sommation neuronale se produit dans le SC et dépend des afférences visuelles transmises par son brachium.
Il existe donc des preuves convergentes chez les patients à cerveau divisé, chez les patients hémianopiques atteints de cécité et à partir d’expériences utilisant des stimuli de courte longueur d’onde, que la sommation neuronale se produit dans le SC. Néanmoins, si les stimuli de courte longueur d’onde n’activent pas les cellules ganglionnaires de la rétine qui se projettent dans le SC via le brachium, on ne peut conclure que le colliculus est entièrement aveugle à ces stimuli. Des enregistrements d’unités individuelles dans le système nerveux central de singe ont démontré que les stimuli de courte longueur d’onde activent les réponses dans les couches superficielles du colliculus. En outre, la tractographie a démontré, chez les patients hémisphérectomisés présentant un RTE (c’est-à-dire une cécité), mais pas chez les patients qui ne présentaient pas de signes de cécité, que le SC était connecté à l’hémisphère intact (Leh et al, 2006a).
Les résultats de la présente enquête fournissent donc la première preuve directe que la sommation spatiale se produit dans le SC qui dépend de la transmission des signaux visuels par son brachium.
Déclaration éthique
Cette étude a été réalisée conformément aux directives et avec l’approbation du protocole du comité d’éthique du NHS, Bangor, Royaume-Uni, et du comité d’éthique de l’école de psychologie de l’Université de Bangor, Royaume-Uni. Le consentement éclairé oral et écrit a été obtenu de tous les participants conformément à la Déclaration d’Helsinki.
Contributions des auteurs
MvK : A conçu la recherche, a conçu et programmé l’expérience, a collecté et analysé les données des patients et a contribué à la rédaction du manuscrit. KK : A collecté les données de contrôle, a examiné la littérature pertinente, a analysé les données de contrôle et a contribué à la rédaction du manuscrit. RR : A recruté les patients et analysé les études de neuro-imagerie, y compris la dissection virtuelle avec tractographie DTI, a préparé les histoires de cas des patients et a contribué à la rédaction du manuscrit.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Behrens, T., Woolrich, M. W., Jenkinson, M., Johansen-Berg, H., Nunes, R. G., Clare, S., et al. (2003). Characterization and propagation of uncertainty in diffusion-weighted MR imaging. Magn. Reson. Med. 50, 1077-1088. doi : 10.1002/mrm.10609
PubMed Abstract | CrossRef Full Text | Google Scholar
Behrens, T. E., Berg, H. J., Jbabdi, S., Rushworth, M. F., and Woolrich, M. W. (2007). Tractographie de diffusion probabiliste avec orientations multiples des fibres : que pouvons-nous gagner ? Neuroimage 34, 144–155.
Google Scholar
de Gelder, B., Pourtois, G., van Raamsdonk, M., Vroomen, J., and Weiskrantz, L. (2001). Unseen stimuli modulate conscious visual experience: evidence from interhemispheric summation. Neuroreport 12, 385–391. doi: 10.1097/00001756-200102120-00040
CrossRef Full Text | Google Scholar
De Monasterio, F. M. (1978). Properties of ganglion cells with atypical receptive-field organization in retina of macaques. J. Neurophysiol. 41, 1435–1449.
PubMed Abstract | Google Scholar
Fries, W. (1984). Cortical projections to the superior colliculus in the macaque monkey: a retrograde study using horseradish peroxidase. J. Comp. Neurol. 230, 55–76. doi: 10.1002/cne.902300106
PubMed Abstract | CrossRef Full Text | Google Scholar
Georgy, L., Celeghin, A., Marzi, C. A., Tamietto, M., and Ptito, A. (2016). Le colliculus supérieur est sensible à une configuration de stimulus de type gestaltiste chez les patients atteints d’hémisphèrectomie. Cortex 81, 151-161. doi : 10.1016/j.cortex.2016.04.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Hershenson, M. (1962). Le temps de réaction comme mesure de la facilitation intersensorielle. J. Exp. Psychol. 63, 289-293. doi : 10.1037/h0039516
CrossRef Full Text | Google Scholar
Hikosaka, O., et Wurtz, R. (1983). Fonctions visuelles et oculomotrices de la substantia nigra pars reticulata du singe. III. mémoire contingente des réponses visuelles et de saccade. J. Neurophysiol. 49, 1268-1284.
PubMed Abstract | Google Scholar
Leh, S. E., Johansen-Berg, H., et Ptito, A. (2006a). Unconscious vision : new insights into the neuronal correlate of blindsight using diffusion tractography. Brain 129(Pt 7), 1822–1832.
PubMed Abstract | Google Scholar
Leh, S. E., Mullen, K. T., and Ptito, A. (2006b). Absence of S-cone input in human blindsight following hemispherectomy. Eur. J. Neurosci. 24, 2954–2960.
PubMed Abstract | Google Scholar
Marzi, C., Tassinari, G., Aglioti, S., and Lutzemberger, L. (1986). Spatial summation across the vertical meridian in hemianopics: a test of blindsight. Neuropsychologia 24, 749–758. doi: 10.1016/0028-3932(86)90074-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Miller, J. (1982). Divided attention: evidence for coactivation with redundant signals. Cogn. Psychol. 14, 247–279. doi: 10.1016/0010-0285(82)90010-X
CrossRef Full Text | Google Scholar
Miniussi, C., Girelli, M., and Marzi, C. A. (1998). Neural site of the redundant target effect electrophysiological evidence. J. Cogn. Neurosci. 10, 216–230. doi: 10.1162/089892998562663
CrossRef Full Text | Google Scholar
Pare, M., and Wurtz, R. (1997). Monkey posterior parietal cortex neurons antidromically activated from superior colliculus. J. Neurophysiol. 78, 3493–3497.
PubMed Abstract | Google Scholar
Poliva, O., Bestelmeyer, P. E., Hall, M., Bultitude, J. H., Koller, K., and Rafal, R. D. (2015). Cartographie fonctionnelle du cortex auditif humain : étude par IRMf d’un patient atteint d’agnosie auditive due à un traumatisme du colliculus inférieur. Cogn. Behav. Neurol. 28, 160-180. doi : 10.1097/WNN.000000000072
PubMed Abstract | CrossRef Full Text | Google Scholar
Posner, M., Snyder, C., et Davidson, B. (1980). L’attention et la détection des signaux. J. Exp. Psychol. Gen. 109, 160-174. doi : 10.1037/0096-3445.109.2.160
CrossRef Full Text | Google Scholar
Raab, D. H. (1962). La facilitation statistique des temps de réaction simples. Trans. N. Y. Acad. Sci. 24, 574-590. doi : 10.1111/j.2164-0947.1962.tb01433.x
CrossRef Full Text | Google Scholar
Reuter-Lorenz, P., Nozawa, G., Gazzaniga, M. S., et Hughes, H. C. (1995). Fate of neglected targets : a chronometric analysis of redundant target effects in the bisected brain. J. Exp. Psychol. Hum. Percept. Perform. 21, 211-230. doi : 10.1037/0096-1523.21.2.211
PubMed Abstract | CrossRef Full Text | Google Scholar
Savazzi, S., et Marzi, C. A. (2004). Le colliculus supérieur subserve la sommation neuronale interhémisphérique à la fois chez les normaux et les patients présentant une section totale ou une agénésie du corps calleux. Neuropsychologia 42, 1608-1618. doi : 10.1016/j.neuropsychologia.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiller, P. H., Malpeli, J. G., and Schein, S. J. (1979). Composition de l’entrée géniculostriée ot colliculus supérieur du singe rhésus. J. Neurophysiol. 42, 1124-1133.
PubMed Abstract | Google Scholar
Sommer, M., et Wurtz, R. (2000). Composition et organisation topographique des signaux envoyés du champ oculaire frontal au colliculus supérieur. J. Neurophysiol. 83, 1979–2001.
PubMed Abstract | Google Scholar
Song, J. H., Rafal, R. D., and McPeek, R. M. (2011). PNAS Plus: deficits in reach target selection during inactivation of the midbrain superior colliculus. Proc. Natl. Acad. Sci. U.S.A. 108, E1433–E1440. doi: 10.1073/pnas.1109656108
PubMed Abstract | CrossRef Full Text
Tomaiuolo, F. (1997). Blindsight in hemispherectomized patients as revealed by spatial summation across the vertical meridian. Brain 120, 795–803. doi: 10.1093/brain/120.5.795
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhaoping, L. (2016). From the optic tectum to the primary visual cortex: migration through evolution of the saliency map for exogenous attentional guidance. Curr. Opin. Neurobiol. 40, 94–102. doi: 10.1016/j.conb.2016.06.017
PubMed Abstract | CrossRef Full Text | Google Scholar