L’évasion de la nature de son emprisonnement génétique
Modifications post-traductionnelles : Un bref aperçu
Comment fonctionne la modification post-traductionnelle ?
Les modifications post-traductionnelles les plus courantes
L’impact de la modification post-traductionnelle sur la santé et les maladies
Un bref aperçu
Que signifie PTM ?
Les cellules doivent détecter et réagir aux changements des conditions internes et externes. Une méthode utilisée pour s’adapter à ces changements consiste à modifier chimiquement les protéines. Les changements chimiques conditionnels sont relayés des capteurs aux effecteurs via des modifications post-traductionnelles (PTM) réversibles des protéines. Les PTM jouent un rôle important dans la modification du produit final de l’expression, contribuent aux processus biologiques et aux états pathologiques, jouant un rôle clé dans de nombreux processus cellulaires tels que la différenciation cellulaire (1), la dégradation des protéines, les processus de signalisation et de régulation, la régulation de l’expression des gènes et les interactions protéine-protéine (2,3).
Comment fonctionne la modification post-traductionnelle ?
Les MPT peuvent se produire à n’importe quelle étape de la vie d’une protéine. De nombreuses protéines sont modifiées peu de temps après la fin de la traduction pour médier un repliement correct ou pour diriger la protéine naissante vers des emplacements cellulaires distincts (tels que le noyau ou la membrane). D’autres modifications interviennent après l’achèvement du repliement et de la localisation pour activer ou désactiver l’activité catalytique. Les protéines sont également liées de manière covalente à des étiquettes qui ciblent une protéine pour sa dégradation. Elles sont modifiées par une combinaison de clivage post-traductionnel et d’ajout de groupes fonctionnels par un mécanisme par étapes de maturation ou d’activation des protéines.
Où se produisent les modifications post-traductionnelles ? Les PTM se produisent sur des chaînes latérales d’acides aminés ou des liaisons peptidiques distinctes et sont le plus souvent médiées par une activité enzymatique. En effet, 5% du protéome comprend des enzymes qui effectuent plus de 200 types de PTMs (4). Ces enzymes comprennent les kinases, les phosphatases, les transférases et les ligases, qui ajoutent ou retirent des groupes fonctionnels, des protéines, des lipides ou des sucres aux chaînes latérales d’acides aminés, et les protéases, qui coupent les liaisons peptidiques pour retirer des séquences spécifiques ou des sous-unités régulatrices. De nombreuses protéines peuvent également se modifier elles-mêmes en utilisant des domaines autocatalytiques, tels que les domaines autokinase et autoprotolytique. Les PTM peuvent également être réversibles en fonction de la nature de la modification. À titre d’exemple, les phosphatases hydrolysent le groupe phosphate pour le retirer de la protéine et inverser son activité biologique (figure 1).
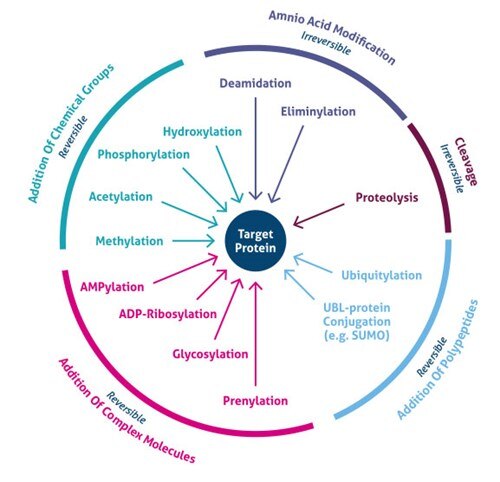
Figure 1. Types de modifications post-traductionnelles (PTM).
Modifications post-traductionnelles les plus courantes
Les développements récents des méthodes de spectrométrie de masse (MS) ont permis l’identification de milliers de sites PTM. Par conséquent, de nouvelles stratégies d’enrichissement ont permis de découvrir l’importance cellulaire globale de plusieurs types de modifications (par exemple, l’acétylation, l’ubiquitylation, le O-GlNac, la glycosylation liée à l’azote). Plus de 200 types divers de PTM sont actuellement connus (5,6), allant de petites modifications chimiques (par exemple, la phosphorylation et l’acétylation) à l’ajout de protéines complètes (par exemple, l’ubiquitylation, figure 3).
Phosphorylation
La phosphorylation des protéines (figure 2) est la modification post-traductionnelle la plus étudiée. On estime qu’un tiers des protéines de mammifères peuvent être phosphorylées, et cette modification joue souvent un rôle clé dans la modulation de la fonction des protéines. La phosphorylation a lieu sur des résidus de sérine, de thréonine et de tyrosine, agissant pour réguler la fonction des protéines, l’activité enzymatique, les interactions protéine-protéine et la localisation des protéines. La phosphorylation est catalysée par des phosphatases et peut être réversible – les protéines phosphorylées peuvent être déphosphorylées par des protéines déphosphatases.
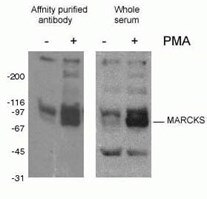
Figure 2. Résultat de la BM de l’anticorps phospho-Marcks (10018-3-AP, 1:1500) avec des cellules macrophages J774 de souris traitées par PMA.
Glycosylation et Glycanation
La majorité des protéines qui sont synthétisées sur les ribosomes associés au réticulum endoplasmique subissent une glycosylation. Cela signifie qu’une fixation covalente de fragments de sucre est ajoutée à la chaîne polypeptidique. Les deux types de glycosylation les plus courants chez les Eucaryotes sont la glycosylation liée à l’azote – à l’asparagine, et la glycosylation liée à l’oxygène – à la sérine et à la thréonine.
Ubiquitination
L’ubiquitination des protéines signifie qu’une ubiquitine covalente est ajoutée à la lysine, la cystéine, la sérine, la thréonine, ou directement à l’extrémité N-terminale de la protéine. L’ubiquitine est une petite protéine (+/-8,6 kDa) exprimée dans presque tous les types de tissus (figure 3). L’ubiquitination est une réaction enzymatique catalysée par une cascade de trois enzymes (E1, E2 et E3). Cela assure la spécificité du substrat et les étapes d’activation, de conjugaison et de ligature. Les protéines peuvent être monoubiquitinées (avec une seule molécule d’ubiquitine) ou polyubiquitinées. La polyubiquitination a lieu lorsque des molécules d’ubiquitine supplémentaires sont ajoutées à la molécule d’ubiquitine initiale. L’ubiquitination via le protéome peut marquer les protéines pour la dégradation. Elle est également importante pour la signalisation cellulaire, l’internalisation des protéines membranaires , et le développement et la régulation de la transcription.

Figure 3. Les cellules MDA-MB-453s ont été soumises à un SDS PAGE suivi d’un western blot avec 10201-2-AP (anticorps anti-ubiquitine) à une dilution de 1:600.
L’impact des PTM sur la santé et les maladies
L’analyse des protéines et de leurs PTM est particulièrement importante pour l’étude des maladies cardiaques, du cancer, des maladies neurodégénératives et du diabète (7). Les principaux défis de l’étude des protéines modifiées post-traductionnellement sont le développement de méthodes de détection et de purification spécifiques. Heureusement, ces obstacles techniques sont en train d’être surmontés grâce à une variété de technologies protéomiques nouvelles et raffinées.
- Biologie chimique : des protéines habillées.
- Concepts de sumoylation : une décennie plus tard.
- L’analyse protéomique dans les neurosciences.
- Les rôles des modifications post-traductionnelles dans le contexte des réseaux d’interactions protéiques
- Décryptage d’un réseau global de modifications post-traductionnelles fonctionnellement associées.
- PTMcode: a database of known and predicted functional associations between post-translational modifications in proteins.
- Citrullination: a posttranslational modification in health and disease.
