THE ACID-BASE BEHAVIOUR OF AMINO ACIDS
This page looks at what happens to amino acids as you change the pH by adding either acids or alkalis to their solutions.
For simplicity, the page only looks at amino acids which contain a single -NH2 group and a single -COOH group.
Amino acids as zwitterions
Zwitterions in simple amino acid solutions
An amino acid has both a basic amine group and an acidic carboxylic acid group.
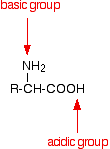
There is an internal transfer of a hydrogen ion from the -COOH group to the -NH2 group to leave an ion with both a negative charge and a positive charge.
This is called a zwitterion.

This is the form that amino acids exist in even in the solid state. Si vous dissolvez l’acide aminé dans l’eau, une solution simple contient également cet ion.
Un zwitterion est un composé sans charge électrique globale, mais qui contient des parties distinctes qui sont chargées positivement et négativement.
Ajout d’un alcali à une solution d’acide aminé
Si vous augmentez le pH d’une solution d’un acide aminé en ajoutant des ions hydroxyde, l’ion hydrogène est retiré du groupe -NH3+.
![]()

Vous pourriez montrer que l’acide aminé existait maintenant sous forme d’ion négatif en utilisant l’électrophorèse.
Dans sa forme la plus simple, l’électrophorèse peut juste consister en un morceau de papier filtre humidifié sur une lame de microscope avec une pince crocodile à chaque extrémité reliée à une batterie. Une goutte de solution d’acide aminé est placée au centre du papier.
Bien que la solution d’acide aminé soit incolore, sa position après un certain temps peut être retrouvée en la pulvérisant avec une solution de ninhydrine. Si on laisse sécher le papier puis qu’on le chauffe doucement, l’acide aminé apparaît comme une tache colorée.
On constaterait que l’acide aminé se déplace vers l’anode (l’électrode positive).
Ajout d’un acide à une solution d’acide aminé
Si vous diminuez le pH en ajoutant un acide à une solution d’un acide aminé, la partie -COO- du zwitterion capte un ion hydrogène.
![]()
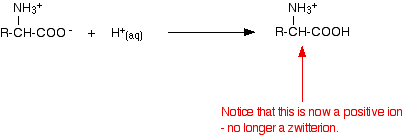
Cette fois, lors de l’électrophorèse, l’acide aminé se déplacerait vers la cathode (l’électrode négative).
Déplacement du pH d’un extrême à l’autre
Supposons que l’on commence avec l’ion que nous venons de produire dans des conditions acides et que l’on y ajoute lentement un alcali.
Cet ion contient deux hydrogènes acides – celui du groupe -COOH et celui du groupe -NH3+.
Le plus acide d’entre eux est celui du groupe -COOH, et il est donc éliminé en premier – et on revient au zwitterion.
![]()
![]()
Donc, lorsque vous avez ajouté juste la bonne quantité d’alcali, l’acide aminé n’a plus de charge nette positive ou négative. Cela signifie qu’il ne se déplacerait pas vers la cathode ou l’anode pendant l’électrophorèse.
Le pH auquel cette absence de mouvement pendant l’électrophorèse se produit est connu comme le point isoélectrique de l’acide aminé. Ce pH varie d’un acide aminé à l’autre.
Si vous continuez à ajouter des ions hydroxyde, vous obtiendrez la réaction que nous avons déjà vue, au cours de laquelle un ion hydrogène est retiré du groupe -NH3+.
![]()
![]()
.