BEVEZETÉS
Az intersticiális tüdőbetegségek a rendellenességek rendkívül heterogén csoportját alkotják, amelyek közös jellemzője a tüdőparenchima gyulladásos komponensének megléte, amely végül fibrózissá alakulhat, és funkcionális szempontból korlátozó elváltozást okoz, amely végül légzési elégtelenséghez vezethet.
Noha olyan betegségekről van szó, amelyek diagnosztizálása és kezelése a tüdőgyógyászat szakterületén történik, a kezelés alapvetően ambulánsan követhető, és mivel ezt különböző szövődmények kísérhetik és gyakran meg is szakítják, fontos, hogy az alapellátó orvos tisztában legyen az e betegségek kezelésére vonatkozó aktuális irányelvekkel, mivel sokszor fordulnak hozzá ilyen típusú problémával rendelkező betegek, akár légúti, akár más típusú szövődmények miatt.
Ez az áttekintés célja, hogy naprakésszé tegye azokat a terápiás módszereket, amelyeket ma ezeknek a betegeknek fel lehet ajánlani. Úgy gondoljuk, hogy nemcsak az alapellátó orvos számára kiemelkedően fontos, hogy naprakész ismeretekkel rendelkezzen e témában, hanem a pulmonológussal való együttműködés is, hogy a beteg kezelésének megfelelő betartása, valamint az esetlegesen fellépő szövődmények korai felismerése és kezelése érdekében.
Az intersticiális betegségek közül gyakorisága és súlyossága miatt az idiopátiás tüdőfibrózis (IPF) a legjelentősebb. Másrészt a kezelése az a modell, amelyre szinte valamennyi ilyen betegség kezelése épül, kivéve azokat, amelyekben ismert etiológiai ágens található, mivel ezekben az esetekben ennek az ágensnek a megszüntetése lesz a terápia alapvető alapja. Ezért az IPF kezelésére vonatkozó jelenlegi iránymutatások áttekintésére fogunk összpontosítani. Először röviden áttekintjük klinikai jellemzőit, majd részletesen kifejtjük az IPF jelenlegi kezelését.
KLINIKAI LEÍRÁS
Az IPF valószínűleg a diffúz intersticiális tüdőbetegségek legagresszívebb prototípusát képviseli. Prevalenciáját egyes szerzők 100 000 lakosra vetítve 5 esetre becsülik1 , bár a valóságban ez az arány nem ismert. Patogenezise az immunrendszer komplex útvonalainak megváltozásához kapcsolódik2,3. 2,3 Ezért a legtöbb alkalmazott gyógyszer immunszuppresszív szer.
A leggyakoribb klinikai tünet az alattomosan kezdődő, száraz köhögéssel kísért dyspnoe, amely paroxizmális és légszomj nélküli jellege miatt a beteg számára a leginkább zavaró tünet lehet. Általában a légzési zavar kezdetben nem feltűnő, és a korai diagnózishoz magas gyanúindexre van szükség. Előfordul, hogy a betegség gyors lefolyású, és néhány hónapon belül visszafordíthatatlan légzési elégtelenséghez vezet, ahogyan az Hamman és Rich kezdeti leírásaiban szerepelt. Leggyakrabban azonban az állapot már hónapok óta fennáll, mire a beteg először jelentkezik.
A fizikális vizsgálat során nagyon jellemzőek a finom, száraz reccsenések (tépelődések), amelyek az esetek több mint 80%-ában hallhatók. Előrehaladott esetekben enyhe megerőltetésre jelentkező nehézlégzés vagy akár ajakcianózis is előfordulhat. Az esetek 30-50%-ában akropaciák láthatók. Az IPF gyanúja megerősödik, ha a mellkas röntgenfelvételén és a CT-vizsgálaton olyan jelek jelennek meg, mint a retikuláris mintázat, a talajüveges infiltráció területei és a tüdőtérfogat csökkenése. Végül a funkcionális vizsgálat megerősíti a restriktív mintázat meglétét, az artériás vérgázelemzés pedig a hypoxaemia meglétét. Kétséges esetekben nagy értéket képvisel a terheléses hypoxaemia kimutatása.
A diagnózis végleges megerősítése csak tüdőbiopsziával lehetséges. A valóság azonban az, hogy még számos publikált sorozatban is a szövettani diagnózis nélküli esetek vannak túlsúlyban. Az Amerikai Tüdőgyógyászati Társaság (ATS) nemrégiben azt javasolta, hogy mindezen kritériumok megléte azt jelenti, hogy gyógyszereknek, környezeti elemeknek vagy kötőszöveti betegségnek való kitettség hiányában az IPF diagnózisa nagy valószínűséggel tüdőbiopszia nélkül is felállítható4 , olyan esetekben, amikor a tüdőbiopszia elfogadhatatlan kockázatot jelentene.
Az egyszerű intersticiális pneumónia (UIP) az a szövettani minta, amely azonosítja ezeket a betegeket4. A deszkamatív interstitialis tüdőgyulladás, a légúti bronchiolitiszhez társuló interstitialis betegség, a nem specifikus interstitialis tüdőgyulladás, a lymphoid interstitialis tüdőgyulladás, az akut interstitialis tüdőgyulladás és a szerveződő tüdőgyulladással járó bronchiolitis obliterans különböző entitásoknak tekinthetők.
Amint a diagnózis és a klinikai súlyosság megállapításra kerül, a legtöbb beteg kezelésre szorul, mivel ez egy halálos betegség, amelynek nincs spontán remissziója. A kezelésre adott válasz gyenge. Az ötéves túlélés 50%5,2,6-8. A kezelésnek körülbelül 3-6 hónapra van szüksége a hatékonyság megállapításához. Az e betegségek kezeléséről szóló jelentések ritkák: kontrollálatlan terápiás kísérletek, többnyire kis betegszámmal9.
A betegség elkerülhetetlenül alattomos és visszafordíthatatlan progressziója ellenére a terápiás nihilizmus nem indokolt. Van példa arra, hogy a kezeletlen fibrózis lassú progresszióval irreverzibilis fibrózishoz vezet, amely nem reagál a kezelésre, vagy gyorsan progresszív fázisba kerül. Valószínűleg mindannyian kezelést igényelnek a megjelenés időpontjában. Azok a betegek azonban, akiknek ellenjavallt a kezelés, vagy akiknél nincs bizonyíték a funkcionális károsodásra, 3-6 hónapos időközönként követhetnek nyomon követési programot. A fibrózis domináns szövettannal és súlyos tüdőfunkció-csökkenéssel rendelkező idős betegek kezelése szintén nehéz. Ezek a betegek rövid, 3-6 hónapos kezelésben részesülnek a reverzibilitás megállapítása érdekében. Közülük csak kevesen fognak pozitívan reagálni.
Sokszor nehéz megállapítani, hogy a kezelés meghozza-e a kívánt hatást. Szubjektív javulás gyakran előfordul (a betegek akár 70%-ánál). Objektív javulás 20-30%-ban következik be. A funkcionális (objektív) javulás meghatározására leggyakrabban használt paraméterek a teljes tüdőkapacitás (TLC) vagy a vitálkapacitás (VC) növekedése, a diffúziós kapacitás növekedése és a terhelés alatti SaO2-csökkenés csökkenése vagy normalizálódása4,10-12 .
KEZELÉS
Kortikoszteroidok
A kortikoszteroidok jelentik az IPF kezelésének fő pillérét, bár sikerük meglehetősen gyenge, a betegek egyharmadánál jelentkezik kedvező válasz. Alkalmazásuk indoka a krónikus alveolitisz elnyomása. A feltételezések szerint úgy hatnak, hogy elnyomják a neutrofil és limfocita migrációt a tüdőben, csökkentik az immunkomplexek koncentrációját, megváltoztatják az alveoláris makrofágok működését és a neutrofilok endotélfelülethez való tapadását.
Nem világos, hogy egyes betegek miért reagálnak, mások pedig miért nem. Ez összefügghet a tüdőparenchimasejtek felszíni receptorainak jelenlétével. Úgy tűnik, hogy a tünetek rövid lefolyása, az enyhe funkcionális és radiológiai károsodás, a női nem és a betegek fiatalabb kora jobb kimenetellel jár.
Mindamellett, hogy ez a legszélesebb körben alkalmazott kezelés, hosszú távú teljesítményét egyetlen prospektív, egyszeri vak, placebokontrollos vizsgálat sem igazolta.
Izumi és munkatársai 222 beteg túlélését elemezték, és megállapították, hogy 10 év elteltével nem volt különbség a szteroidokat kapó betegek és a kezeletlen betegek túlélése között13. Mindazonáltal, ha egy IPF-es betegnél a tüdőfunkció károsodása vagy a normális életet zavaró tünetek jelentkeznek, indokolt a kortikoszteroidterápia megkezdése. Valójában a betegség spontán javulása nagyon ritka, és ha a kezelés megkezdésének késleltetése mellett döntenek, azt a beteg szoros megfigyelése árán kell megtenni, hogy a kezelés megkezdhető legyen, amint a rosszabbodás nyilvánvalóvá válik.
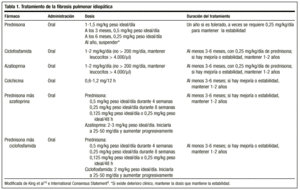
A klasszikus kezelés prednizonnal kezdődik, 1,5-2 mg/ideális testtömeg-kilogramm/nap egyszeri adagban reggel, amely nem haladhatja meg a 100 mg-os adagot. 2-3 hónap elteltével a pácienst röntgenfelvétellel és funkcionális vizsgálattal újra kiértékelik. Ha a beteg reagál, a prednizon adagját csökkentik (1-2 mg/hét) 0,5 mg/kg ideális testtömeg/nap fenntartó adagra, amely ezt követően csökkenthető. Ha nincs válasz, immunszuppresszív gyógyszert adnak hozzá. Általában nem valószínű, hogy a kezelést le lehet állítani, és a 0,25 mg/kg ideális testtömeg/nap dózisokat általában fenntartják.
A közelmúltban az Amerikai és az Európai Tüdőgyógyászati Társaságok a gyógyszer mellékhatásainak elkerülése és a jobb túlélési arány elérése érdekében konszenzusra jutottak abban, hogy a kezelést prednizon vagy más, azonos dózisú kortikoszteroid és egy immunszuppresszáns (azatioprin vagy ciklofoszfamid)4 kombinációjával kell kezdeni: prednizon 0,5 mg/kg ideális testtömeg/nap 4 hétig; 0,25 mg/kg ideális testtömeg/nap 8 hétig, majd 0,125 mg/kg ideális testtömeg/nap vagy 0,25 mg/kg ideális testtömeg/48 óra.
A kezelés időtartamára vonatkozóan nincsenek iránymutatások; a minimális időtartam egy év. Lehetséges, hogy hónapok vagy évek múlva a betegség újra aktiválódik, és ebben az esetben ugyanezekkel a szerekkel kell kezdeni a kezelést. A kezelésre adott választ minden esetben az objektív javulás szempontjából kell értékelni, és a beteg krónikus, stabilitást garantáló dózison való tartásának lehetőségét azokra az esetekre kell fenntartani, amikor a kortikoszteroidok hatására javulás, a dózis csökkentésére romlás, majd a dózis újbóli emelésére újabb javulás következik be. Az egyes betegek számára szükséges dózist csak eseti alapon lehet meghatározni, a dózismódosításra adott válaszreakciótól függően. Sok szerző szerint élethosszig tartó kezelésre van szükség.14
A kezdeti súlyos betegség esetén nagy dózisú kortikoszteroidok alkalmazását javasolják. Keogh és munkatársai intermittáló, nagy dózisú parenterális kortikoszteroidokat alkalmaztak súlyos betegségben szenvedő betegeknél: intravénás metilprednizolon, heti egyszer 2 g, plusz orális prednizon, 0,25 mg/kg/nap. Az indoklás szerint ezek kifejezettebb hatást gyakorolnak a neutrofil alveolitiszre (amely rossz prognózissal jár), mint az alacsony dózisú szteroidok15. Ennek a munkának azonban van néhány hiányossága, mint például a rövid, 6 hónapos követési idő, a betegek kis száma és a szokásosnál alacsonyabb prednizonadagok9. A kezdeti, nagy dózisú intravénás kortikoszteroidokkal (metilprednizolon 250 mg/6 h) történő kezdeti kezelést alkalmazták, hogy a betegséget a lehető legkorábban kordában tartsák, amikor az gyorsan progrediál. Nem állnak rendelkezésre kontrollált vizsgálatok annak megállapítására, hogy ezek a módszerek hatékonyak-e; úgy tűnik azonban, hogy a nagyobb dózisok nagyobb hatékonysággal rendelkeznek, bár a mellékhatások is nagyobbak.14.
CITOTOXIKUMOK
Klasszikusan a kortikoszteroidok alternatívájaként használták, amikor azok hatástalanok voltak, és akkor is, amikor mellékhatásaik kizárják további alkalmazásukat. E cikk rendkívül gyakorlatias szellemének megfelelően áttekintjük azokat a szereket, amelyek a klinikai gyakorlatban hasznosnak bizonyultak, bár – a kortikoszteroidokhoz hasonlóan – nincsenek hosszú, prospektív és randomizált sorozatok, amelyekből pontosan tudhatnánk, hogy pontosan mi a szerepük az IPF kezelésében.
Azatioprin
Hatásmechanizmusa a dezoxiribonukleinsav-szintézisben a purinok helyettesítésén alapul, ezáltal gátolja az adenin-deaminázt és inaktiválja a limfocitákat. Egyéb hatások közé tartozik a természetes ölősejtek aktivitásának, az ellenanyag-termelésnek és az antitest-függő sejtes citotoxicitásnak a szuppressziója.
A javasolt adag 2 mg/kg/nap, amely nem haladhatja meg a 200 mg/napot, 3-6 hónapos időtartamra. Az adagolást 50 mg/nap dózissal kezdik, és ha jól tolerálják, az adagot 1-2 hetes időközönként emelik a tervezett dózis eléréséig.
A fő mellékhatások hematológiai jellegűek: leukopénia, anémia, trombocitopénia, vörösvérsejt aplázia és pancytopénia. Figyelemmel kell kísérni a leukocitaszámot, és ha az 4000/μl alá csökken, az azatioprint abba kell hagyni, amíg ez az érték újra nem emelkedik. Ezenkívül gyomor-bélrendszeri panaszok, például hányinger és hányás, gyomorfekély, hasmenés és a májenzimek enyhe emelkedése is előfordulhat. Összességében az esetek 20-30%-ában a mellékhatások az azatioprin megvonását teszik szükségessé.
Raghu és munkatársai összehasonlították a nagy dózisú glükokortikoidok és a kis dózisú glükokortikoidokkal kombinált azatioprin hatékonyságát. E gyógyszer alkalmazását a légzésfunkciós paraméterek szerény javulása és a túlélés növekedése kísérte17.
Ciklofoszfamid
Ez egy alkiláló szer. Hatásmódja a limfociták kimerítése, és így elnyomja a limfociták működését. Az ajánlott adag 2 mg/kg/nap egyszeri, szájon át szedhető, általában 0,25 mg/kg/nap szájon át szedhető prednizonnal együtt, amely nem haladhatja meg a 200 mg/napot legalább 3 hónapig, de legfeljebb 9-12 hónapig.
A legfontosabb mellékhatás a leukopénia. A leukociták összlétszámának nagyobbnak kell lennie, mint 3000/μl, vagy a neutrofilek számának nagyobbnak kell lennie, mint 1500/μl. Egyéb szövődmények közé tartozik a trombocitopénia, a hemorrhagiás cystitishez kapcsolódó haematuria, anorexia, hányinger és hányás, csontvelő-szuppresszió, azoospermia és amenorrhoea, fertőzés és hematológiai malignitás.
Kolb és munkatársai 18 IPF-es beteget vizsgáltak, hogy meghatározzák a pulzáló ciklofoszfamid-terápia hatékonyságát és biztonságosságát. A ciklofoszfamidot intermittálóan (1-1,3 g/hó) adták szájon át szedhető prednizolon mellett egy éven át. Ezt követően a ciklofoszfamidot abbahagyták, és az elért kortikoszteroiddózisokat folytatták8 . Az érintetteket legalább 14 hónapig követték, figyelemmel kísérve az életminőséget, a TLC-t, a FEV1-et, a CO átviteli kapacitást (DLCO), a SaO2-t, valamint a tüneteket. Egy betegnél meg kellett szakítani a kezelést visszatérő tüdőgyulladás miatt; 11 beteget tekintettek reagálónak (5 javult és 6 stabilizálódott), 6 beteg állapota pedig romlott. A ciklofoszfamid hosszú távú toxicitása a kumulatív dózisoktól függ. Az időszakos adagok ugyanolyan hatékonyak és jobban tolerálhatók, mint a napi adagok. A válaszadóknál magasabb volt a limfociták aránya a BAL-ban. Egy másik figyelemre méltó eredmény, hogy a válaszadók kezdeti életminősége jelentősen jobb volt, mivel rövidebb idő telt el a progresszióig, ami arra utal, hogy ezt a kezelést korán el kell kezdeni.
Baughman és Lower 33 IPF-beteget kezeltek 1000-1 800 mg ciklofoszfamiddal/2 héten keresztül 18 hónapon keresztül. Azoknál, akik túlélték a 18 hónapot, a VCF jelentős javulása a következő évben is fennmaradt. A prednizolon csökkentése 32 mg/napról 4 mg/napra volt lehetséges16.
Penicillamin
Antifibrozáns szer. Azt feltételezik, hogy a kollagénrostok intra- és intermolekuláris kovalens kötéseinek kialakulásába való beavatkozással gátolja a tüdőfibrózis kialakulását. A kötőszöveti betegségek néhány olyan esetét írták le, amelyekhez társuló tüdőfibrózis társult, és amelyekben bizonyos hatékonyságot mutatott, de nincsenek nagy betegszámú, kontrollált vizsgálatok, így jelenleg nem tekinthető érvényes alternatív kezelésnek. Ezért további vizsgálatokra van szükség, mielőtt ajánlást lehetne tenni.
Kolchicin
csökkenti a kollagénszekréciót és növeli a kollagénbontó aktivitást. Gyulladáscsökkentő hatása is van. A betegség kezelésében betöltött szerepének pontosabb meghatározásához vizsgálatokra van szükség, de vannak olyan tanulmányok, amelyekben a kortikoszteroidokhoz hasonló hatékonyságot tulajdonítottak neki, és mellékhatásai nem súlyosak. Naponta egyszer vagy kétszer 0,6 mg-os adagban ajánlott kortikoszteroidokra refrakter betegeknél, önmagában vagy immunszuppresszív szerekkel kombinálva. Bár vannak szerzők, akik a kezelés első vonalába sorolják, jelenleg nincsenek olyan adataink, amelyek alapján ezt meg lehetne állapítani (1. táblázat).
PULMONÁRIAI TRANSZPLANTÁCIÓ
A betegségben sajnos a legtöbb az olyan eset, amikor a betegség a kezelésre való válasz nélkül előrehalad, és végül légzési elégtelenséget okoz. Ezeknek a betegeknek jelenleg a palliáción kívül nincs kilátás orvosi kezelésre. Ebben a kilátástalan helyzetben a tüdőátültetés lehetősége az 1980-as években jelent meg, és mára olyan szintre fejlődött, hogy olyan terápiás lehetőséggé vált, amelyet a klinikai alkalmazásban is figyelembe kell venni, és amely már nem korlátozódik a kísérleti területre. A legmegfelelőbb javallat 65 év alatti személyeknél, akiknél nincs progresszív és visszafordíthatatlan betegség más szervekben, valamint nincs megoldatlan aktív fertőzés vagy multirezisztens kórokozók által okozott fertőzés. Megfelelő személyes hajlam és tápláltsági állapot is szükséges. Azoknál a betegeknél, akiknél a CPT a várt 60%-nál kisebb, vagy a tüdő diffúziós kapacitása 40%-nál kisebb, a túlélés kevesebb, mint 2 év. A diszfunkció ezen fokán oxigénterápiát igényelnek, és minimális testmozgás mellett is könnyen deszaturálódnak. Ezekben az esetekben tüdőátültetést kell fontolóra venni, amint az oxigénterápia szükségessé válik és a betegség megállíthatatlan progressziója igazolt. A választott transzplantációs típus az egytüdős transzplantáció, a kéttüdős transzplantációt olyan esetekre tartogatva, amikor kétségek merülnek fel a maradék tüdő viselkedésével kapcsolatban. Ha a beteg 50 évnél fiatalabb és jobbszívfél-elégtelenségben szenved, a szív- és tüdőátültetés is szóba jöhet. Ebben a helyzetben azonban a betegség már nagyon előrehaladott állapotban van, és nem valószínű, hogy kibírja a várakozást18,19. A transzplantáció utáni túlélés az első évben várhatóan 80%, 5 év múlva pedig 50-60%, ami jelentősen javítja a légzési elégtelenséget elért IPF-betegek prognózisát.
A KEZELÉSRE VALÓ VÁLTOZÁS VÉLEMÉNYE
Szövődmények hiányában akár 6 hónap is eltelhet, mielőtt bármilyen válasz jelentkezik a kezelésre. Ezt követően, ha a beteg állapota javult vagy stabil, ugyanazokat az adagokat kell fenntartani. Ha súlyosbodtak, alternatív terápiára (másik immunszuppresszív szerre vagy akár transzplantációra) kell áttérni. 12 hónap múlva ugyanígy újra kell értékelni, 18 hónap múlva pedig a válasznak megfelelően egyénre szabottan. Se recomienda continuar indefinidamente sólo en aquellos pacientes con mejoría continua o estabilización (tabla 2).

Una respuesta favorable se define por dos o más de los siguientes criterios en dos visitas consecutivas:
1. Mejoría de los síntomas, sobre todo en el grado de esfuerzo requerido para que el paciente deba parar cuando hace un esfuerzo o un descenso en la frecuencia o gravedad de la tos.
2. Reducción de las alteraciones radiológicas.
3. Mejoría funcional definida por dos o más de los siguientes parámetros:
Aumento >= 10% en la TLC o CV (o >= 200 ml).
Aumento >= 15% en DLCO o >= 3 ml/min/mmHg.
Mejoría o normalización de la SaO2 o pO2 (aumento >= 4% o >= 4 mmHg) durante un prueba de esfuerzo cardiorrespiratoria.
Una respuesta estable (también considerada favorable) se define por dos o más de los siguientes criterios en dos visitas consecutivas:
1. Cambio de
2. Cambio de
3. Sin cambios en la SaO2 o pO2 (aumento
Un fracaso del tratamiento se define por dos o más de los siguientes criterios en dos visitas consecutivas:
1. Aumento de los síntomas, sobre todo disnea o tos.
2. Aumento de las alteraciones radiológicas, especialmente imágenes en panal o signos de hipertensión pulmonar.
3. Deterioro funcional definido por dos o más de los siguientes parámetros:
Descenso >= 10% en la TLC o CV (o >= 200 ml).
Descenso >= 15% en DLCO o >= 3 ml/min/mmHg.
A SaO2 romlása (= 4%) vagy az alveoláris-arteriális gradiens (AapO2) emelkedése (= 4 mmHg) nyugalomban vagy kardiorespirációs terheléses vizsgálat során.
ÖSSZEGZÉSEK
Az indiopátiás tüdőfibrózis halálos kimenetelű betegség, amely spontán remisszióval nem jár, és rosszul reagál a kezelésre. Az utóbbival kapcsolatos tanulmányok ritkák, és kis számú beteget érintenek. A legalább egy évig különböző dózisban alkalmazott kortikoszteroidok jelentik a legelfogadottabb kezelési módot, önmagukban vagy más immunszuppresszív szerekkel kombinálva. Az utóbbi időben az Amerikai Tüdőgyógyászati Társaság és az Európai Légzőszervi Társaság4 a kombinált terápiát szorgalmazza. A fibrózisellenes szereket azzal a céllal vizsgálják, hogy megakadályozzák a fibrotikus folyamat kialakulását és ezáltal visszafordíthatatlanná válását, mivel sok betegnél késői stádiumban diagnosztizálják a betegséget. Tekintettel a túlélési arányokra és a fejlődésre, a tüdőátültetést fontolóra kell venni, amint a betegeknél a kezelés sikertelen és oxigénterápiára van szükség. Mindez arra utal, hogy multicentrikus tanulmányokat kell létrehozni, amelyekben elegendő számú beteget kell bevonni az alkalmazott kezelések hatékonyságának értékeléséhez, valamint a betegség természetes lefolyásának, illetve a tényleges előfordulásának és gyakoriságának meghatározásához4,20. Másrészt a magasabb túlélési arány elérése érdekében ajánlott a betegség korai stádiumában felismerni és kezdeni a kezelést.