Az elektrolit olyan kémiai vegyület, amely ionokra disszociál, és így képes elektromos töltést szállítani – azaz az elektrolit elektromos vezető; a fémektől eltérően a töltés áramlása nem az elektronok áramlása, hanem az ionok mozgása.
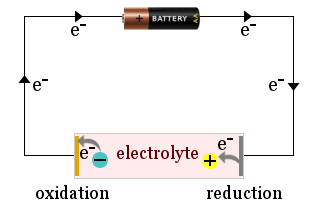
A diagramon például egy háztartási akkumulátort láthatunk, amely egy elektrokémiai cella elektródáihoz vonzza az elektrolit ionjait, ahol az ionok elektronokat nyernek (redukálódnak) vagy elektronokat veszítenek (oxidálódnak).
Néha maguk az elektródák is reagálnak, például egy fémelektród oxidálódhat, és ionokat szabadíthat fel az elektrolitba.
Az elektrolitok lehetnek szilárdak, folyadékok vagy oldatok.
Példák elektrolitokra
1. Az olvasztott nátrium-klorid elektrolitként működik a nátrium-fém előállítása során. Klórgáz is keletkezik.
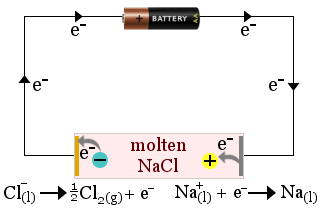 Az elektrolitot ebben az esetben a cella redoxireakciói fogyasztják el.
Az elektrolitot ebben az esetben a cella redoxireakciói fogyasztják el.
2. A vízben oldott kálium-hidroxid nagy vezetőképességű elektrolitot eredményez az Edison-cellában, egy korai újratölthető cellában.
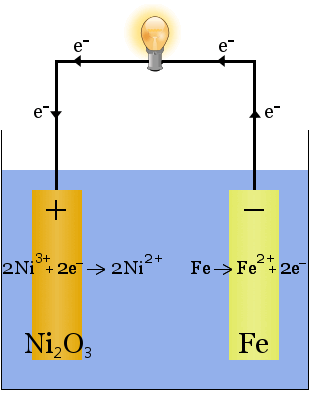
A fenti nátriumtermeléssel ellentétben ebben a reakcióban nem fogy el elektrolit.A kálium-hidroxid szerepe ebben az esetben az, hogy növelje az ionok hozzáférhetőségét, hogy növelje az elektrolit vezetőképességét és teljes legyen az elektromos áramkör.
Az elektródokon lejátszódó reakciók kémiai egyenletei a következők:
A kisüléshez az egyenletek balról jobbra, a töltéshez jobbról balra olvashatók.
3. Hagyományosan az elektrolitok folyadékok voltak, hogy lehetővé tegyék az ionok mozgását. ma már azonban szilárd anyagok állnak rendelkezésre, amelyek lehetővé teszik az ionok könnyű mozgását a szerkezetükön keresztül. a szilárd elektrolitok számos fogyasztói termékben kívánatosak, mert nem szivárognak.
A lítium-ón-foszfor-szulfid, Li10SnP2S12, egy szilárd elektrolit, amelyet lítium-ion akkumulátorokban használnak.A szilárd elektrolit kristályszerkezete a lítiumionokkal való gyenge kölcsönhatással kombinálva olyan környezetet biztosít, amelyen a lítiumionok könnyen átugorhatnak.
4. Az elektrolitok rendkívül fontosak az élő szervezetek elektrokémiai folyamataiban.Az elektrolitok fő ionjai a kalcium (Ca2+), a magnézium (Mg2+), a nátrium (Na+), a kálium (K+), a klorid (Cl-), a hidrogén-karbonát (HCO3-) és a hidrogén-foszfát (HPO42-).
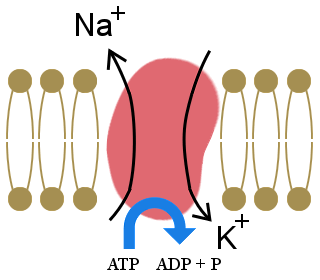
The importance of the sodium-potassium pump, shown in the diagram, to our lives is illustrated by the fact that it uses one-third of our resting energy.The pump maintains our cells’ electrolyte balance, with excess potassium ions inside cells and excess sodium ions outside cells.
This concentration gradient creates a voltage across the cell wall, which allows electrical signals to be transmitted in neurons and in muscles.It also provides the energy for processes in cell-membranes.
