Introduction
Az egyszerre megjelenő két vizuális jelet gyorsabban észleljük, mint bármelyik egyedül megjelenő jelet (Hershenson, 1962; Raab, 1962). Ennek a redundáns célhatásnak (RTE) egy része sztochasztikusan magyarázható egy “lóverseny” modellel. Azaz, ha két inger feldolgozása párhuzamos és független csatornákon történik, amelyek feldolgozási sebessége kísérletről kísérletre véletlenszerűen változik, minden egyes prezentációnál a leggyorsabb inger nyeri a versenyt, és eléri az észlelési küszöböt a válasz kiváltásához; ezért átlagosan két inger nagyobb valószínűséggel eredményez gyorsabb választ, mint a két csatorna bármelyikében feldolgozott egy ingerre adott átlagos válaszidő.
A kumulatív gyakorisági eloszlások elemzése azonban kimutatta, hogy van egy további hozzájárulás az RTE-hez, amelyet nem lehet figyelembe venni a két független csatorna közötti versenyló modellel. Miller (1982) egy “koaktivációs” modellt javasolt, amelyben a két jel egy aktivációs poolban összegződik. Miniussi és munkatársai (1998) kimutatták, hogy a redundáns célpontok rövidebb latenciákat eredményeztek a P1 és N1 eseményhez kapcsolódó agyi potenciálok esetében, ami azt jelzi, hogy a neurális összegzés a látási pálya korai szakaszában történik. Hemianopiás betegeken végzett kísérletek azt is kimutatták, hogy az RTE-t nem lehet teljes mértékben az észlelési küszöb elérésének lóversenyével magyarázni, mivel az RTE a két inger egyikének fenomenális tudatossága hiányában is megnyilvánulhat (Marzi et al., 1986; Tomaiuolo, 1997; de Gelder et al., 2001; Leh et al., 2006a,b). Valóban, hemiszférektómiás betegeknél egy redundáns célpont a vakmezőben nemcsak RTE-t generál, hanem az RTE fokozódik, amikor a redundáns inger kiegészít egy gesztálymintát (Georgy et al., 2016). Ezek a hemianopiásoknál végzett megfigyelések arra utalnak, hogy a neurális összegzés szubkortikálisan történik, és nem függ az elsődleges látókéregtől.
A halmozott közvetett bizonyítékok a superior colliculust (SC) az RTE-hez hozzájáruló neurális összegzés szubsztrátjaként implikálták. Közvetlen bizonyítékról azonban még nem számoltak be. A jelenlegi kutatás azt a neurális pályát vizsgálja, amely az SC-ben integrált vizuális jeleket továbbítja. Az SC felületes és mély rétegekből áll. A colliculus mély rétegei mind közvetlenül, mind a bazális ganglionokon keresztül afferenseket kapnak az oculomotoros kéregből (Hikosaka és Wurtz, 1983; Pare és Wurtz, 1997; Sommer és Wurtz, 2000). A colliculus felszíni rétegeibe irányuló vizuális afferensek azonban mind a retinából (a retino-tectalis traktuson keresztül), mind a korai látókéregből (Fries, 1984), a SC brachiumán keresztül továbbítódnak.
Mivel a látókéreggel nem rendelkező neurológiai betegeknél neurális összegző hatást mutattak ki, a colliculusban összegződő vizuális jelek közvetlenül a retinából a retino-tectalis traktuson keresztül a colliculus felszíni rétegeibe juthatnak. Ha ez a helyzet, akkor a neurális összegződést az SC brachiumának sérülése megszüntetheti.
Az SC brachiumát megzavaró sérülések nagyon ritkák. Itt két olyan beteg egyedi esettanulmányáról számolunk be, akiknél az SC-t a vizuális bemenettől deafferentizáló egyoldali szubkortikális elváltozás történt, és akiknél nem manifesztálódott RTE. Az egyik betegnél a thalamus pulvináris magját, a rostralis SC-t és annak brachiumát egyaránt károsító elváltozás történt. A másik betegnél, akinek traumás agysérülés következtében a háti középagy sérült, az SC épnek tűnt, de a brachiuma megszakadt.
Anyagok és módszerek
A résztvevők
Két neurológiai beteget vizsgáltak az RTE mérésére irányuló kísérletben, mindegyiküknek saját, életkorának megfelelő kontrollcsoportja volt.
RE 71 éves volt a vizsgálat idején. Egy 3 évvel korábbi hátsó talamuszvérzés elpusztította a medialis pulvinart, a ventro-laterális talamuszmagokat és a belső kapszula hátsó végtagját, a károsodás kiterjedt a dorzális középagyra, beleértve a pretectumot és a rostrális SC-t. (1. ábra) A valószínűségi DTI-traktográfia (Behrens et al., 2003, Behrens et al., 2007) megerősítette, hogy az elváltozás elpusztította a SC brachiumát (2. ábra). RE testének bal oldala lebénult, a bal arc és a kar érzékelésének elvesztésével. Rendellenes szemmozgásai voltak, beleértve a szemhéj visszahúzódását, bénult függőleges szemmozgásokat és konvergenciazavarokat, amelyek az elváltozás háti középagyba való kiterjedésének következményei voltak.
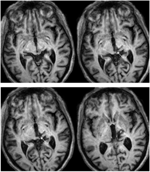
1. ÁBRA. Nagy felbontású (0,7 mm3) T1-súlyozott MRI a RE betegről. Axiális szeletek ventrális (balra fent) és dorzális (jobbra lent) irányban, amelyek a jobb háti középagyban és a thalamusban lévő elváltozást mutatják. Az elváltozás kiterjedése a rostralis superior colliculusra (SC) fehér nyilakkal látható.
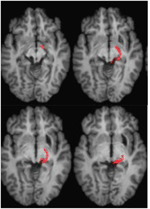
2. ÁBRA. Az RE beteg retinotektális traktusát bemutató traktográfia T1-súlyozott axiális szeletekkel (felülről ventrálisan dorsalisan) és koronális szeletekkel (alulról elölről hátrafelé) együttregisztrálva. A retinotektális traktus lefutása a bal féltekén látható (piros). A jobb féltekén nem követhető áramvonal, és az ép féltekével összehasonlítva látható, hogy az elváltozás a jobb féltekén elpusztította az SC brachiumát. A pirossal ábrázolt áramvonalat valószínűségi tractográfiával generáltuk az FSL FDT (FMRIB Diffusion Toolbox; Behrens et al., 2003, Behrens et al., 2007; http://fsl.fmrib.ox.ac.uk/fsl/fslwiki) segítségével. A diffúzió-súlyozott echo-planáris mágneses rezonanciafelvételeket 1,5 mm3 -es felbontással, 32 izotrópikusan elosztott diffúziós kódoló iránnyal (b = 800) és egy alapvonallal (b = 0) vették fel. Ismétlési idő = 2 s, visszhangidő = 35 ms. A probabilisztikus traktográfiához kézzel jelöltük a kiindulási régiót (azaz magmaszkot rajzoltunk) mindkét félteke optikai traktusán közvetlenül a chiasma után, és egy célterületet (célmaszk) az SC-n.
ML a vizsgálat idején 23 éves volt. Egy közúti közlekedési balesetben 7 évvel korábban súlyos traumás agysérülést szenvedett, amely diffúz axonális sérülést eredményezett a jobb putamenbe és a háti középagyba történő vérzéssel. Anamnézisének, neurológiai vizsgálatának és neuroimaging leleteinek részleteiről (Poliva és mtsai., 2015) számoltak be. Bár maradt némi motoros károsodás, beleértve a spaszticitást és az ataxiát, visszanyerte függetlenségét. Fő fogyatékossága súlyos auditív agnózia volt az agytörzsi hallási pályák károsodása miatt, beleértve a bal oldali inferior colliculust is. A látásélesség és a látómezők nem voltak károsodva, és nem volt vizuális neglect vagy extinctio. A középagyi diszfunkció szemmozgási jelei közé tartoztak a makronégyszögletes rángások és a konvergencia görcs függőleges tekintetnél (inkább lefelé, mint felfelé). A nagy felbontású MRI cisztás üreget mutatott ki a jobb putamenben a korábbi vérzés helyén, valamint kis periventrikuláris elváltozást a jobb alsó ponsban, a kisagyi alsó peduncle régiójában (3. ábra). A bal oldali inferior colliculus csaknem teljesen elszakadt, csak a legmedialisabb és caudalis részét kímélte meg. A károsodás kiterjedt az oldalsó pretectumra és a középagyi tegmentumra, elpusztítva a colliculus superior és inferior brachiáját, valamint ventralisan a vörös magba. A valószínűségi DTI-traktográfia megerősítette, hogy az elváltozás elpusztította a SC brachiumát (4. ábra).
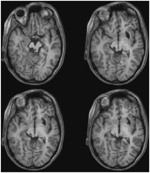
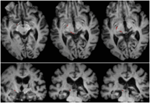
3. ÁBRA. Nagy felbontású (0,7 mm3) T1-súlyozott MRI az ML betegről. Axiális szeletek ventrális (balra fent) és dorzális (jobbra lent) irányban, amelyek a bal alsó colliculus inferior és a mezencephalicus tegmentum ventralis és laterális károsodását mutatják.
4. ÁBRA. DTI-traktográfia az ML betegnél, amely a retino-tektális traktust mutatja a jobb féltekében (piros) a T1-súlyozott MR-képekkel együttregisztrálva az axiális síkban ventrális (balra fent) és dorzális (jobbra lent) irányban. A diffúzió-súlyozott echo-planáris mágneses rezonanciaképeket 2 mm3 -es felbontással, 63 izotrópikusan elosztott diffúziós kódoló iránnyal (b = 1000) és alapvonallal (b = 0) vették fel. Ismétlési idő = 2 s, visszhangidő = 35 ms. A traktográfiát a 2. ábrán leírtak szerint hajtottuk végre.
A RE beteg neurológiailag egészséges kontrollalanyai között 11 idősebb felnőtt volt (hat nő és öt férfi, átlagéletkor: 68,5, tartomány: 59-73). Őket a Bangor Egyetem közösségi résztvevői közül toborozták. A résztvevőknek nem volt ismert neurológiai, pszichológiai, pszichiátriai vagy kognitív károsodásuk, és minden résztvevőnek normális/korrigált normál látása volt. A résztvevők 6 font fizetést kaptak a részvételért.
Az ML páciensek neurológiailag egészséges kontrollalanyai között 11 Bangor Egyetem 18-26 év közötti egyetemi hallgató és doktorandusz volt (hét nő és négy férfi).
Készülék és látási körülmények
A PC számítógépen futó Presentation® programozó szoftver rögzítette a reakcióidő (RT) válaszokat, és ingereket generált, amelyeket egy Dell monitoron (12,5″ × 25″, frissítési frekvencia 60 Hz.) mutattak be, amelyet a résztvevők előtt 57 cm-es szemmagasságban, binokuláris látás mellett, tompított fényviszonyok között helyeztek el. A fej stabilitásának biztosítására áll- és fejtámaszt használtak. A résztvevők válaszait a billentyűzet szóköz billentyű lenyomásával rögzítették.
Stimulusok
A kísérleti ingerek kitöltetlen fehér jelölő négyzetekből álltak (1 cm × 1 cm), amelyek a képernyő közepén lévő kis fixációs doboztól (0,2 cm × 0,2 cm) 8°-kal balra és jobbra helyezkedtek el. A célingerek az egyik vagy mindkét perifériás jelölőnégyzet kitöltéséből álltak, hogy egy tömör fehér négyzetet hozzanak létre. Minden inger szürke háttéren fehér színben jelent meg.
Az 5. ábra egyetlen próba sorrendjét mutatja. A markerdobozok a kísérlet során végig láthatóak maradtak. A próbák közötti 1750 ms-os intervallum után a kísérlet megkezdéséhez megjelent a fixációs doboz. Egy 250 és 750 ms közötti véletlenszerű intervallum után (25 ms-os lépésekben) az egyik vagy mindkét jelölődoboz helyén megjelent egy célpont, amely a billentyűzet szóköz billentyűjének egyszerű lenyomását igényelte. A célpont egy kitöltött fehér négyzet volt, amelyet az egyik vagy mindkét jelölődoboz kitöltésével hoztak létre. Véletlenszerűen és azonos valószínűséggel a célpontok balra, jobbra vagy mindkettőre egyszerre jelentek meg. A fogási próbákban (a próbák 10%-a) nem jelent meg célpont.
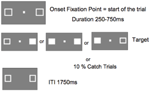
5. ÁBRA. Egyetlen kísérlet megjelenítési sorrendje (ITI, a résztvevő válasza és a következő kísérletet indító fixációs pont megjelenése közötti intervallum).
Procedúra
Minden résztvevőt egyetlen ülésben teszteltünk. A képernyőn megjelenő utasítások elolvasása után a résztvevőknek példákat mutattak a feladatban bemutatott összes ingerre (a fixációs doboz és mindhárom célpont bemutatása), és arra kérték őket, hogy a szóköz billentyű lenyomásával erősítsék meg az egyes célpontok felismerését. Az utasítások szerint minden egyes próba időtartama alatt a központi dobozon kellett tartani a fixációt, és a lehető leggyorsabban reagálni a billentyűzet jobb kézzel történő szóköz megnyomásával, amint egy célpont megjelenik.
Amikor a résztvevő szóban és a billentyű lenyomásával megerősítette, hogy minden utasítást megértett, folytatódott a gyakorló próbák bemutatása (10 próbát minden célpontbemutatási feltételből és 3 célpont nélküli “fogópróbát”). A gyakorló próbák befejezésekor a képernyőn visszajelzés jelent meg, amely a következő kijelentéseket tartalmazta: (1) “Helyes”, (2) “Próbálj meg gyorsabban reagálni!” és (3) “Csak akkor válaszolj, ha célpontot látsz”. Miután a gyakorlás befejeződött, és mind a résztvevő, mind a kísérletvezető megbizonyosodott arról, hogy a feladat utasításait helyesen értette, a résztvevőt felkérték a kísérlet megkezdésére. Az egyes kísérleti blokkok első 30 próbáját kizárták a gyakorló próbák közül. Minden blokk összesen 233 próbából állt: 70 jobb oldali, 70 bal oldali, 70 mindkét próbából és 23 “fogópróbából”. A blokk felénél rövid szünetet tartottunk. Az ML beteget és a fiatalabb kontrollokat egyetlen blokkban vizsgálták. Az RE páciens életkorával és állapotával kapcsolatos változékonyság miatt őt két blokkban, külön napokon teszteltük; és a vele egykorú kontroll résztvevőit is egy nap két blokkban teszteltük.
Elemzések
Az egyes kontrollcsoportok esetében minden egyes feltételben (bal oldali célpont, jobb oldali célpont, kétoldali célpontok) minden egyes résztvevőre vonatkozóan kiszámítottuk a medián RT-t, miután kizártuk a próbákat, amelyek a fogási próbákat követték, valamint azokat, amelyek RT-je <100 ms vagy >800 ms volt. Párosított mintás t-próbát végeztünk annak megerősítésére, hogy nincs aszimmetria a jobb és bal oldali egyoldalú célpontokra adott válaszok esetében, és kiszámítottuk az egyoldalú célpontok átlagos RT-jét. Az RTE-t úgy számoltuk ki, hogy a kétoldali próbák RT-jét kivontuk az egyoldali próbák RT-jéből. Páros mintás t-próbával hasonlítottuk össze az egyoldalú és a kétoldalú célpontokat, hogy megállapítsuk, hogy az RTE statisztikailag megbízható-e.
Minden beteg esetében, miután kizártuk a fogási próbákat követő próbákat és azokat, amelyek RT-je <100 ms vagy >800 ms volt, páros mintás t-próbával hasonlítottuk össze a kontralaterális és ipsilaterális egyoldalú célpontok átlagos RT-jét. Amint arról alább beszámolunk, a contralesionalis célpontokra adott válaszok RT-ideje hosszabb volt, mint az ipsilesionalis egyoldalú célpontoké. Annak megállapítására, hogy a kontrális célpont jelenléte statisztikailag megbízható RTE-t eredményezett-e, páros mintás t-próbával összehasonlítottuk a kétoldali célpontpróbák medián RT-it az egyoldali ipsilaterális célpontpróbákkal.
Az RTE megbízhatóan kisebb volt-e az egyes betegeknél, mint a megfelelő kontrollcsoportnál, az RTE-t minden egyes kontroll résztvevőre kiszámítottuk, és kiszámítottuk a 95%-os konfidenciaintervallum (CI) felső és alsó határát. Az egyes betegek RTE-jének Z-pontszámát kiszámítottuk a kontrollcsoportjukhoz viszonyítva, és a statisztikai megbízhatóságot Crawford t-próbával teszteltük.
P értékeket a párosított mintás t-próbák esetében kétfarkú, a Crawford t esetében pedig egyfarkú értékeket közöltünk.
Eredmények
Beteg RE
Kontroll résztvevők: A medián RT-k átlaga nem különbözött a bal és jobb oldali válaszok esetében (t = 0,6.) A 6. ábra azt mutatja, hogy az RT-k rövidebbek voltak (az RTE) a kétoldali célok esetében, mint akár a bal (t = 6,8, p < 0,001, akár a jobb (t1,10) = 3,8, p = 0,003) egyoldali célok esetében. A kétoldali célpróbák medián RT-jét kivontuk az egyoldali célok medián RT-jének átlagából, hogy kiszámítsuk az átlagos RTE-t minden egyes kontroll résztvevő számára. A kontrollcsoport átlagos RTE értéke 24,3 ms (SEM = 2,75) volt.

6. ÁBRA. Medián RT-k a beteg RE esetében és a medián RT-k átlaga a kontrollcsoport résztvevői esetében a bal oldali látómezőben (“Bal”), a jobb oldali látómezőben (“Jobb”) és egyszerre mindkét látómezőben (“Mindkettő”) megjelenő célpontok esetében. A kontrollcsoport résztvevőinek hibasávjai a standard hibákat jelölik.
A RE beteg medián RT-je hosszabb volt, mint a kontrollcsoporté (6. ábra), és mindhárom feltétel esetében a kontrollcsoport átlagos RT-je 95%-os CI-jének felső határa felett volt (bal = 457 ms; jobb = 449 ms; mindkét = 426 ms). A kontrális (bal oldali) mezőben lévő egyoldali célpontok RT-je hosszabb volt, mint az ipsilesionalis (jobb oldali) mezőben lévő egyoldali célpontoké (t = 6,0, p < 0,001).
Fontos, hogy nem volt RTE: a kétoldali célok medián RT-je (500 ms) nem volt rövidebb, mint az ipsilesionalis (jobb) látómezőben lévő egyoldali céloké (494 ms; t = 1,141), p = ns (6. ábra). Az 1. táblázat (fent) azt mutatja, hogy a RE betegre számított RTE szignifikánsan kisebb volt, mint a kontrollcsoportjára számított RTE.

TABLE 1. TÁBLA. Redundáns célhatás a beteg RE (fent) és ML (lent) esetében, valamint az RTE átlaga a megfelelő kontrollcsoportok esetében, 95%-os konfidenciaintervallummal (CI), Z-pontszámokkal és Crawford t-próbával, amely összehasonlítja az egyes betegeket a megfelelő kontrollcsoportjukkal.
Beteg ML
Kontroll résztvevők: A medián RT-k átlaga nem különbözött a bal és jobb oldali célpontokra adott válaszok esetében (t = 0,86. A 7. ábra azt mutatja, hogy a kétoldali célpontok esetében az RT-k rövidebbek voltak (az RTE), mint a bal (t = 4,7, p = 0,001, vagy jobb (t1,11) = 7,8, p < 0,001) egyoldali célpontok esetében.

7. ábra. Az ML páciensek medián RT-je és a kontrollcsoport résztvevőinek medián RT-jének átlaga a bal oldali látómezőben, jobb oldali látómezőben és mindkét látómezőben egyidejűleg megjelenő célpontok esetében. A kontroll résztvevőre vonatkozó hibasávok a standard hibákat jelölik.
A kétoldali célpontpróbák medián RT-jét kivontuk a bal és jobb oldali egyoldali célpontok medián RT-jének átlagából, hogy kiszámítsuk az RTE-t minden kontroll résztvevőre.
A csoport átlagos RTE-je 33 ms volt (SEM = 6,65).
Az ML beteg medián RT-je hosszabb volt, mint a kontrolloké (7. ábra), és mindhárom feltétel esetében a kontrollcsoport átlagos RT-je 95%-os CI-jének felső határa felett volt (bal = 322 ms; jobb = 307 ms; mindkét = 277 ms). A jobb oldali (kontrális) mezőben lévő egyoldali célpontoknál hosszabbak voltak az egyoldali célpontoknál a bal oldali (ipsilesionalis) mezőben lévő egyoldali célpontoknál (t = 4,9, p = 0,001). Nem volt RTE. A kétoldali célpontokra adott válaszidő (361 ms) nem volt rövidebb, mint az ipsilesionalis (bal oldali) látómezőben lévő egyoldali célpontokra adott válaszidő (363 ms). Az 1. táblázat (alul) azt mutatja, hogy az ML betegre számított RTE szignifikánsan kisebb volt, mint a kontrollcsoportjára vonatkozó RTE.
Diszkusszió
Az egyszerű RT-ket a kontrális vagy ipsilesionalis mezőben lévő egyes célpontok, valamint a kétoldali célpontok észlelésére mértük két olyan betegnél, akiknél az SC brachiuma az egyik féltekén sérült. Az egyik betegnél (egy fiatal nő) a károsodás a bal féltekén történt, és traumás agysérülés következménye volt; és bár a károsodás érintette az inferior colliculust, és kiterjedt a középagyi tegmentumra, az SC önmagában való károsodása nem volt nyilvánvaló a nagy felbontású idegképalkotás alapján. A másik betegnél (egy idősebb nő) a károsodás a jobb féltekében volt, és hipertóniás vérzés okozta, amely a medialis pulvináris és laterális talamusz kiterjedt károsodását is okozta, és kiterjedt a háti középagyra, beleértve a rostrális SC-t is. Mindkét betegnél a kontrális mezőben lévő vizuális célpontok észlelésének egyszerű RT-je lelassult az ipsilesionalis mezőhöz képest. Egyik beteg sem mutatott térbeli összegző hatást (RTE) a célpontok észlelésében, amikor az ingereket mindkét vizuális mezőben mutatták be.
Ezek a megfigyelések megvilágítják az SC szerepét a célpontok észlelésében, pontosabban az SC vizuális afferenseinek szerepét. Posner és munkatársai (1980) operatívan úgy definiálták a detektálást, hogy azt egy vizuális jelre adott tetszőleges válaszadás képessége bizonyítja (pl. egy egyszerű billentyű lenyomása az ujjal, mint a jelenlegi kísérletben). Feltételezték, hogy az észlelés a figyelem kiosztását igényli a célpont kiválasztásához a feldolgozáshoz egy korlátozott kapacitású rendszerben, amely prioritást ad a cselekvéshez.
Song és munkatársai (2011) kimutatták, hogy a majom SC inaktiválása olyan feltűnő célkiválasztási hiányosságokat okoz, amelyeket nem lehet könnyen magyarázni a vizuális észlelés vagy a motoros végrehajtás egyszerű károsodásaként, és azt javasolták, hogy hozzájárul egy általánosabb célú prioritási térképhez. Ebben a kísérletben a majmoknak két inger került bemutatásra ellentétes vizuális mezőkben, és egy elérési válasszal kellett jelezniük, hogy melyik jelent meg előbb. Az egyik majmot arra képezték ki, hogy az elsőként megjelenő inger felé nyúljon, a másik majmot pedig arra, hogy a másodikként megjelenő célpont felé nyúljon. Mindkét esetben erős elfogultság mutatkozott a sérüléssel kontralaterális látómezőben lévő célpont kiválasztása ellen. Mivel ugyanez a torzítás volt megfigyelhető annál a majomnál, amelyik a másodikként megjelenő célpont felé nyúlt, a torzítás nem lehetett a kontrális célpont észlelésének késedelmére visszavezethető. A kollikuláris inaktiváció nem okozott károsodást annak észlelési megítélésében, hogy melyik inger jelent meg először. Inkább az inaktivált colliculussal kontralaterális látómezőben lévő ingerek voltak hátrányban a cselekvés prioritásának meghatározásában.”
Zhaoping (2016) nemrégiben kiemelte a neurális saliencia-térképek és a prioritási térképek közötti különbséget, és a perceptuális saliencia-térképnek a látóidegből/SC-ből az elsődleges vizuális kéregbe való evolúciós migrációja mellett érvelt. Azt javasolta, hogy az üdvösségjelek a funkcióhangolási tulajdonság kivetítése nélkül is továbbíthatók az SC-ben lévő prioritási térképre.
A SC brachiuma a retinából a retino-tectalis traktuson keresztül afferens vizuális jeleket továbbít a colliculus felszíni rétegeibe; a brachiumon keresztül továbbított vizuális afferens rostok többsége azonban az elsődleges látókéregből származó vetületek. Ha a brachium megszakad, az elsődleges látókéregből érkező szalienciajelek a frontális szemmezőkön keresztül továbbíthatók a colliculushoz. De a retinából vagy a látókéregből a colliculus felszíni rétegeibe irányuló közvetlen projekciók hiányában, ahogyan feltételezzük, hogy ez a brachium sérülésében szenvedő betegek esetében a colliculus prioritási térképének aktiválódása hosszabb időt vesz igénybe, ami lassabb válaszokat eredményez a kontrális vizuális jelekre.
Amint a bevezetőben említettük, az RTE-hez való hozzájárulás, amely egy valószínűségi versenyló-modellen alapul, mindkét célpont észlelésétől függ; és egy olyan versenytől, amelyben a két célpontot továbbító független csatornák hatékonysága egyenértékű, úgy, hogy az észlelési küszöb eléréséért folytatott verseny kimenetele kísérletről kísérletre véletlenszerű. Mivel a kontrális jelek észlelési küszöbe magasabb az itt közölt betegeknél, a redundáns célpontok nem részesülhetnek előnyben egy sztochasztikus lóverseny alapján; vagyis az ipsilesionalis és kontrális jelek közötti verseny kimenetele nem véletlenszerű – a kontrális jelek nagyobb valószínűséggel veszítik el a versenyt, mint hogy megnyerik azt.
A hemianopiás betegeknél végzett kutatások mindazonáltal kimutatták, hogy van egy olyan neurális összegző komponens is, amely hozzájárul az RTE-hez, és amely nem függ mindkét célpont észlelésétől (Marzi et al, 1986; Tomaiuolo, 1997; de Gelder et al., 2001). Mivel a commissurotomizált betegeknél kimutatták, hogy van RTE (Marzi és mtsai., 1986; Reuter-Lorenz és mtsai., 1995), azzal érveltek, hogy a függőleges meridiánon keresztüli jelek interhemiszférikus integrációjának szubkortikálisan kell történnie.
Savazzi és Marzi (2004) kimutatták, hogy a neurális összegzés nem következik be rövid hullámhosszú kromatikus célingerek esetén sem neurológiailag ép embereknél, sem osztott agyú betegeknél. Leh és munkatársai (2006b) arról számoltak be, hogy míg néhány hemianopiás féltekeektomizált betegnél akromatikus ingerek esetén RTE lépett fel, ezeknél a betegeknél nem volt RTE, amikor rövid hullámhosszú kromatikus ingereket használtak célpontként. A rövid hullámhosszú (azaz lila) ingerek csak az S-kúpokat aktiválják a retinában. Az S-kúpoktól bemenetet kapó retinális ganglionsejtek nem vetülnek sem közvetlenül az SC-be, sem az oldalsó geniculáris mag magnocelluláris rétegeibe (De Monasterio, 1978). Mivel a primer látókéregből az SC-hez az SC brachiumán keresztül történő projekciók csak a magnocelluláris geniculostriátus afferensek vizuális jeleit közvetítik (Schiller et al., 1979), az S-kúp ingerek RTE létrehozásának kudarca arra utal, hogy a neurális összegzés az SC-ben történik, és a brachiumon keresztül továbbított vizuális afferensektől függ.
Az osztott agyú betegeknél, a vakságban szenvedő hemianopiás betegeknél és a rövid hullámhosszú ingerekkel végzett kísérletekből tehát egybehangzó bizonyíték van arra, hogy a neurális összegzés az SC-ben történik. Mindazonáltal, bár a rövid hullámhosszú ingerek nem aktiválják azokat a retinális ganglionsejteket, amelyek a brachiumon keresztül az SC-be vetülnek, nem lehet arra következtetni, hogy a colliculus teljesen vak az ilyen ingerekre. A majom SC-ben végzett egyedi egységfelvételek kimutatták, hogy a rövid hullámhosszú ingerek valóban aktiválják a válaszokat a colliculus felszíni rétegeiben. Továbbá, a traktográfia kimutatta, hogy azoknál a féltekeektomizált betegeknél, akiknél RTE (azaz vaklátás) volt, de nem azoknál a betegeknél, akiknél nem mutatkozott vaklátás, az SC kapcsolatban állt az ép féltekével (Leh et al., 2006a).
A jelen vizsgálat eredményei tehát az első közvetlen bizonyítékot szolgáltatják arra, hogy az SC-ben olyan térbeli összegzés történik, amely a vizuális jeleknek a brachiumon keresztül történő továbbításától függ.
Etikai nyilatkozat
A vizsgálatot az NHS Ethics Committee, Bangor, UK, és a School of Psychology Ethics Committee of Bangor University, UK iránymutatásainak megfelelően és a protokoll jóváhagyásával végeztük. Minden résztvevőtől szóbeli és írásbeli beleegyezést kaptunk a Helsinki Nyilatkozatnak megfelelően.
A szerzők hozzájárulása
MvK: Elgondolta a kutatást, megtervezte és programozta a kísérletet, összegyűjtötte és elemezte a betegadatokat, és hozzájárult a kézirat megírásához. KK: Kontrolladatokat gyűjtött, áttekintette a vonatkozó irodalmat, elemezte a kontrolladatokat és hozzájárult a kézirat megírásához. RR: Pácienseket toborzott és neuroimaging vizsgálatokat elemzett, beleértve a virtuális boncolást DTI-traktográfiával, elkészítette a betegek esettörténetét és hozzájárult a kézirat megírásához.
Enyilatkozat az érdekellentétről
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális érdekellentétként értelmezhetők.
Behrens, T., Woolrich, M. W., Jenkinson, M., Johansen-Berg, H., Nunes, R. G., Clare, S., et al. (2003). A bizonytalanság jellemzése és terjedése diffúzió-súlyozott MR-képalkotásban. Magn. Reson. Med. 50, 1077-1088. doi: 10.1002/mrm.10609
PubMed Abstract | CrossRef Full Text | Google Scholar
Behrens, T. E., Berg, H. J., Jbabdi, S., Rushworth, M. F., and Woolrich, M. W. (2007). Valószínűségi diffúziós traktográfia több szálorientációval: mit nyerhetünk? Neuroimage 34, 144–155.
Google Scholar
de Gelder, B., Pourtois, G., van Raamsdonk, M., Vroomen, J., and Weiskrantz, L. (2001). Unseen stimuli modulate conscious visual experience: evidence from interhemispheric summation. Neuroreport 12, 385–391. doi: 10.1097/00001756-200102120-00040
CrossRef Full Text | Google Scholar
De Monasterio, F. M. (1978). Properties of ganglion cells with atypical receptive-field organization in retina of macaques. J. Neurophysiol. 41, 1435–1449.
PubMed Abstract | Google Scholar
Fries, W. (1984). Cortical projections to the superior colliculus in the macaque monkey: a retrograde study using horseradish peroxidase. J. Comp. Neurol. 230, 55–76. doi: 10.1002/cne.902300106
PubMed Abstract | CrossRef Full Text | Google Scholar
Georgy, L., Celeghin, A., Marzi, C. A., Tamietto, M., and Ptito, A. (2016). A superior colliculus érzékeny a gesztusszerű inger-konfigurációra hemiszférektómiás betegeknél. Cortex 81, 151-161. doi: 10.1016/j.cortex.2016.04.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Hershenson, M. (1962). A reakcióidő mint az interszenzoros facilitáció mérőszáma. J. Exp. Psychol. 63, 289-293. doi: 10.1037/h0039516
CrossRef Full Text | Google Scholar
Hikosaka, O., and Wurtz, R. (1983). A majom substantia nigra pars reticulata vizuális és oculomotoros funkciói. III. memóriafüggő vizuális és szakkádválaszok. J. Neurophysiol. 49, 1268-1284.
PubMed Abstract | Google Scholar
Leh, S. E., Johansen-Berg, H., and Ptito, A. (2006a). Tudattalan látás: új betekintés a vaklátás neuronális korrelátumába diffúziós traktográfia segítségével. Brain 129(Pt 7), 1822–1832.
PubMed Abstract | Google Scholar
Leh, S. E., Mullen, K. T., and Ptito, A. (2006b). Absence of S-cone input in human blindsight following hemispherectomy. Eur. J. Neurosci. 24, 2954–2960.
PubMed Abstract | Google Scholar
Marzi, C., Tassinari, G., Aglioti, S., and Lutzemberger, L. (1986). Spatial summation across the vertical meridian in hemianopics: a test of blindsight. Neuropsychologia 24, 749–758. doi: 10.1016/0028-3932(86)90074-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Miller, J. (1982). Divided attention: evidence for coactivation with redundant signals. Cogn. Psychol. 14, 247–279. doi: 10.1016/0010-0285(82)90010-X
CrossRef Full Text | Google Scholar
Miniussi, C., Girelli, M., and Marzi, C. A. (1998). Neural site of the redundant target effect electrophysiological evidence. J. Cogn. Neurosci. 10, 216–230. doi: 10.1162/089892998562663
CrossRef Full Text | Google Scholar
Pare, M., and Wurtz, R. (1997). Monkey posterior parietal cortex neurons antidromically activated from superior colliculus. J. Neurophysiol. 78, 3493–3497.
PubMed Abstract | Google Scholar
Poliva, O., Bestelmeyer, P. E., Hall, M., Bultitude, J. H., Koller, K., and Rafal, R. D. (2015). Az emberi hallókéreg funkcionális feltérképezése: fMRI-vizsgálat egy, az inferior colliculus trauma miatt hallási agnóziában szenvedő betegnél. Cogn. Behav. Neurol. 28, 160-180. doi: 10.1097/WNN.00000000000000000072
PubMed Abstract | CrossRef Full Text | Google Scholar
Posner, M., Snyder, C., and Davidson, B. (1980). A figyelem és a jelek észlelése. J. Exp. Psychol. Gen. 109, 160-174. doi: 10.1037/0096-3445.109.2.160
CrossRef Full Text | Google Scholar
Raab, D. H. (1962). Az egyszerű reakcióidők statisztikai megkönnyítése. Trans. N. Y. Acad. Sci. 24, 574-590. doi: 10.1111/j.2164-0947.1962.tb01433.x
CrossRef Full Text | Google Scholar
Reuter-Lorenz, P., Nozawa, G., Gazzaniga, M. S., and Hughes, H. C. (1995). Az elhanyagolt célpontok sorsa: a redundáns célponthatások kronometriai elemzése a kettévágott agyban. J. Exp. Psychol. Hum. Percept. Perform. 21, 211-230. doi: 10.1037/0096-1523.21.2.211
PubMed Abstract | CrossRef Full Text | Google Scholar
Savazzi, S., and Marzi, C. A. (2004). A superior colliculus alárendeli az interhemiszférikus neurális összegzést normális és a corpus callosum teljes szakaszával vagy agenezisével rendelkező betegeknél egyaránt. Neuropsychologia 42, 1608-1618. doi: 10.1016/j.neuropsychologia.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiller, P. H., Malpeli, J. G., and Schein, S. J. (1979). A geniculostriate input ot superior colliculus összetétele a rhesus majomban. J. Neurophysiol. 42, 1124-1133.
PubMed Abstract | Google Scholar
Sommer, M., and Wurtz, R. (2000). A frontális szemmezőből a superior colliculusba küldött jelek összetétele és topográfiai szerveződése. J. Neurophysiol. 83, 1979–2001.
PubMed Abstract | Google Scholar
Song, J. H., Rafal, R. D., and McPeek, R. M. (2011). PNAS Plus: deficits in reach target selection during inactivation of the midbrain superior colliculus. Proc. Natl. Acad. Sci. U.S.A. 108, E1433–E1440. doi: 10.1073/pnas.1109656108
PubMed Abstract | CrossRef Full Text
Tomaiuolo, F. (1997). Blindsight in hemispherectomized patients as revealed by spatial summation across the vertical meridian. Brain 120, 795–803. doi: 10.1093/brain/120.5.795
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhaoping, L. (2016). From the optic tectum to the primary visual cortex: migration through evolution of the saliency map for exogenous attentional guidance. Curr. Opin. Neurobiol. 40, 94–102. doi: 10.1016/j.conb.2016.06.017
PubMed Abstract | CrossRef Full Text | Google Scholar