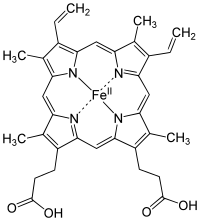
A heme csoport egy protoporfirin gyűrűből és egy központi vas (Fe) atomból álló protetikus csoport. A protoporfirin gyűrű négy pirrolgyűrűből áll, amelyeket metinhidak kötnek össze. Négy metil-, két vinil- és két propionát-oldallánc kapcsolódik hozzá.
A hemoglobin fehérje hemje a vasatomot tartalmazó porfirin heterociklusos gyűrűjének protéziscsoportja; a csoport biológiai funkciója az oxigén szállítása a testszövetekbe, úgy, hogy a gázmolekulák ligandumának kötődése a fehérjecsoport vasatomjához a hem-molekula körüli hisztidin-maradék aminosavcsoport révén megváltoztatja a fehérje szerkezetét.
A vas középpontjában egy protoporfirin nevű szerves komponens fekszik, amely négy pirrol nitrogénatomhoz kötődik, amelyeket egy metinhíd köt össze, amely egy tetrapirrolgyűrűt alkot. A vas lehet vasas (Fe2+) vagy vasas (Fe3+) oxidációs állapotban. Azonban csak akkor képes oxigénhez kötődni, ha vasas állapotban van. A vas két további kötést tud kialakítani az ötödik és a hatodik koordinációban, amelyek a hem-sík mindkét oldalán helyezkednek el. Az ötödik koordinációs hely egy disztális hisztidinhez kapcsolódik, míg a hatodik koordinációs hely nem mindig képes oxigénhez kötődni. A kötődéskor a heme-csoport valójában összezsugorodik, és lejjebb ereszkedik a porfiringyűrű síkjába. Ezzel együtt a disztális hisztidin is követi, és ez a hisztidin az alfa-béta határfelülethez kapcsolódik, így lokális vagy teljes konformációváltozást eredményez.
A specifikus prosztetikus csoportjával kombinált konjugált fehérjét holoproteinnek, míg az annak hiányában lévő fehérjét apoproteinnek nevezzük. A protéziscsoportoknak különböző funkciói vannak, például oxidáló-redukáló reakciók (redox), metilációs reakciók, oxigenizációs reakciók stb.
A heme-csoport adja az izmok és a vér jellegzetes vörös színét.