THE ACID-BASE BEHAVIOUR OF AMINO ACIDS
This page looks at what happens to amino acids as you change the pH by adding either acids or alkalis to their solutions.
For simplicity, the page only looks at amino acids which contain a single -NH2 group and a single -COOH group.
Amino acids as zwitterions
Zwitterions in simple amino acid solutions
An amino acid has both a basic amine group and an acidic carboxylic acid group.
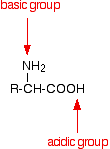
There is an internal transfer of a hydrogen ion from the -COOH group to the -NH2 group to leave an ion with both a negative charge and a positive charge.
This is called a zwitterion.

This is the form that amino acids exist in even in the solid state. Ha az aminosavat vízben feloldjuk, az egyszerű oldat ezt az iont is tartalmazza.
A zwitterion olyan vegyület, amelynek nincs teljes elektromos töltése, de különálló, pozitív és negatív töltésű részeket tartalmaz.
Lúg hozzáadása egy aminosav oldatához
Ha egy aminosav oldatának pH-ját hidroxidionok hozzáadásával növeljük, a hidrogénion eltávolodik az -NH3+ csoportból.
![]()

Elektroforézissel kimutathatod, hogy az aminosav most negatív ionként létezik.
Az elektroforézis a legegyszerűbb formájában csak egy darab megnedvesített szűrőpapírból állhat egy mikroszkópos tárgylemezen, amelynek mindkét végén egy krokodilcsipesz van egy elemre erősítve. A papír közepére egy csepp aminosavoldatot helyezünk.
Az aminosavoldat ugyan színtelen, de egy idő után a helyzete megállapítható, ha ninhidrinoldattal permetezzük be. Ha a papírt hagyjuk megszáradni, majd óvatosan felmelegítjük, az aminosav színes foltként jelenik meg.
Az aminosav az anód (a pozitív elektród) felé halad.
Sav hozzáadása egy aminosav oldatához
Ha egy aminosav oldatához sav hozzáadásával csökkentjük a pH-t, a zwitterion -COO- része hidrogéniont vesz fel.
![]()
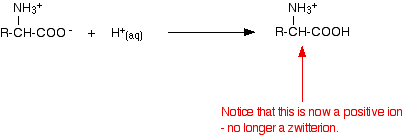
Ezúttal az elektroforézis során az aminosav a katód (a negatív elektród) felé mozogna.
A pH-t az egyik végletből a másikba toljuk
Tegyük fel, hogy az imént savas körülmények között előállított ionból indulunk ki, és lassan lúgot adunk hozzá.
Az ion két savas hidrogént tartalmaz – egyet a -COOH csoportban és egyet az -NH3+ csoportban.
Ezek közül a savasabb a -COOH-csoportban levő, így először ezt távolítjuk el – és máris visszakapjuk a zwitteriont.
![]()
![]()
Amikor tehát éppen a megfelelő mennyiségű lúgot adtuk hozzá, az aminosavnak már nincs nettó pozitív vagy negatív töltése. Ez azt jelenti, hogy az elektroforézis során sem a katód, sem az anód felé nem mozdulna el.
A pH-értéket, amelynél ez a mozgáshiány az elektroforézis során bekövetkezik, az aminosav izoelektromos pontjának nevezzük. Ez a pH-érték aminosavanként változik.
Ha továbbra is hidroxidionokat adunk hozzá, akkor a már látott reakciót kapjuk, amelyben egy hidrogénion eltávolodik az -NH3+ csoportból.
![]()
![]()