A természet menekülése a genetikai fogságból
Post transzlációs módosítás:
Hogyan működik a poszttranszlációs módosítás?
A leggyakoribb poszttranszlációs módosítások
A poszttranszlációs módosítások hatása az egészségre és a betegségekre
Rövid áttekintés
Mit jelent a PTM?
A sejteknek érzékelniük kell a belső és külső körülmények változásait, és reagálniuk kell rájuk. Az egyik módszer, amelyet e változásokhoz való alkalmazkodásra használnak, a fehérjék kémiai módosítása. A feltételes kémiai változásokat a fehérjék reverzibilis poszttranszlációs módosításain (PTM) keresztül továbbítják az érzékelőktől az effektorokhoz. A PTM-ek fontos szerepet játszanak a kifejeződés végtermékének módosításában, hozzájárulnak a biológiai folyamatokhoz és a kóros állapotokhoz, kulcsszerepet játszanak számos sejtfolyamatban, például a sejtdifferenciálódásban (1), a fehérjék lebontásában, a jelátviteli és szabályozási folyamatokban, a génexpresszió szabályozásában és a fehérje-fehérje kölcsönhatásokban (2,3).
Hogyan működik a poszttranszlációs módosítás?
A PTM-ek a fehérje élettartamának bármelyik szakaszában megtörténhetnek. Sok fehérje röviddel a transzláció befejezése után módosul, hogy közvetítse a megfelelő hajtogatást, vagy hogy a születő fehérjét meghatározott sejtes helyekre (például a sejtmagba vagy a membránba) irányítsa. Más módosítások a hajtogatás és a lokalizáció befejezése után következnek be, hogy aktiválják vagy inaktiválják a katalitikus aktivitást. A fehérjék kovalensen kötődnek olyan címkékhez is, amelyek a fehérjét lebontás céljából célba veszik. A fehérjéket a poszttranszlációs hasítás és a funkcionális csoportok hozzáadásának kombinációjával módosítják a fehérje érésének vagy aktiválásának lépésenkénti mechanizmusa révén.
Hol történik a poszttranszlációs módosítás? A PTM-ek különböző aminosav-oldalláncokon vagy peptidkötéseken következnek be, és leggyakrabban enzimatikus aktivitás közvetítésével. A proteom 5%-a olyan enzimeket tartalmaz, amelyek több mint 200 féle PTM-et végeznek (4). Ezek közé az enzimek közé tartoznak a kinázok, foszfatázok, transzferázok és ligázok, amelyek funkcionális csoportokat, fehérjéket, lipideket vagy cukrokat adnak hozzá vagy távolítanak el az aminosav-oldalláncokhoz vagy azokról, valamint a proteázok, amelyek peptidkötéseket hasítanak el specifikus szekvenciák vagy szabályozó alegységek eltávolítása érdekében. Sok fehérje képes önmagát is módosítani autokatalitikus domének, például autokináz és autoprotolitikus domének segítségével. A PTM-ek a módosítás jellegétől függően reverzibilisek is lehetnek. A foszfatázok például hidrolizálják a foszfátcsoportot, hogy eltávolítsák azt a fehérjéből és visszafordítsák annak biológiai aktivitását (1. ábra).
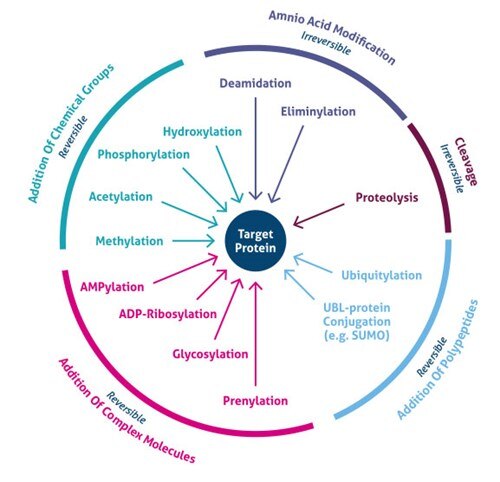
1. ábra. A poszttranszlációs módosítások (PTM) típusai.
A leggyakoribb poszttranszlációs módosítások
A tömegspektrometriai (MS) módszerek közelmúltbeli fejlődése lehetővé tette több ezer PTM-hely azonosítását. Következésképpen az új dúsítási stratégiák feltárták a módosítások számos típusának (pl. acetiláció, ubikvitiláció, O-GlNac, N-hez kötött glikoziláció) globális celluláris jelentőségét. Jelenleg több mint 200 különféle PTM-típus ismert (5,6), a kis kémiai módosításoktól (pl. foszforiláció és acetiláció) a teljes fehérjék hozzáadásáig (pl. ubikvitiláció, 3. ábra).
Foszforiláció
A fehérjék foszforilációja (2. ábra) a leggyakrabban vizsgált poszttranszlációs módosítás. Becslések szerint az emlős fehérjék egyharmada foszforilálódhat, és ez a módosítás gyakran kulcsszerepet játszik a fehérje funkciójának modulálásában. A foszforiláció szerin-, treonin- és tirozin-maradványokon megy végbe, és a fehérjefunkció, az enzimatikus aktivitás, a fehérje-fehérje kölcsönhatások és a fehérje lokalizáció szabályozására szolgál. A foszforilációt foszfatázok katalizálják, és az reverzibilis lehet – a foszforilált fehérjéket fehérje-defoszfatázok defoszforilálhatják.
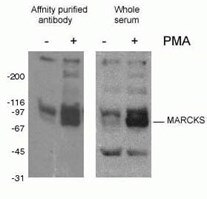
2. ábra. Foszfo-Marcks antitest (10018-3-AP, 1:1500) WB eredménye PMA-val kezelt egér J774 makrofág sejtekkel.
Glikoziláció és glikanizáció
Az endoplazmatikus retikulumhoz kapcsolódó riboszómákon szintetizálódó fehérjék többsége glikoziláción megy keresztül. Ez azt jelenti, hogy a polipeptidlánchoz cukorrészek kovalens kötését adják hozzá. Az Eukariótákban a glikoziláció két leggyakoribb típusa az N-kötésű glikoziláció – aszparaginhoz, és az O-kötésű glikoziláció – szerinhez és treoninhoz.
Ubikvitináció
A fehérjék ubikvitinációja azt jelenti, hogy a lizinhez, ciszteinhez, szerinhez, treoninhoz vagy közvetlenül a fehérje N-terminusához kovalens ubikvitint adnak. Az ubikvitin egy kicsi (+/-8,6 kDa) fehérje, amely szinte minden szövettípusban kifejeződik (3. ábra). Az ubikvitináció egy enzimatikus reakció, amelyet egy három enzimkaszkád (E1, E2 és E3) katalizál. Ez biztosítja a szubsztrátspecifikusságot és az aktiválási, konjugációs és ligációs lépéseket. A fehérjék lehetnek monoubikvitináltak (egy ubikvitinmolekulával) vagy poliubikvitináltak. A poliubikvitinációra akkor kerül sor, amikor a kezdeti ubikvitinmolekulához további ubikvitinmolekulák adódnak. Az ubikvitináció a fehérjeállományon keresztül jelölheti meg a fehérjéket lebontásra. Fontos továbbá a sejtek jelátvitelében, a membránfehérjék internalizációjában , valamint a transzkripció kialakulásában és szabályozásában.

3. ábra. Az MDA-MB-453s sejteket SDS PAGE-nek vetettük alá, majd western blotot végeztünk 10201-2-AP (ubikvitin antitest) 1:600-as hígítással.
PTM-ek hatása az egészségre és a betegségekre
A fehérjék és PTM-jeik elemzése különösen fontos a szívbetegségek, a rák, a neurodegeneratív betegségek és a cukorbetegség tanulmányozása szempontjából (7). A poszttranszlációsan módosított fehérjék vizsgálatának fő kihívása a specifikus kimutatási és tisztítási módszerek kifejlesztése. Szerencsére ezeket a technikai akadályokat számos új és kifinomult proteomikai technológiával sikerül leküzdeni.
- Kémiai biológia: felöltöztetett fehérjék.
- A szumoiláció koncepciói: egy évtizede.
- Proteomikai elemzés az idegtudományokban.
- A poszt-transzlációs módosulások szerepe a fehérje interakciós hálózatok kontextusában
- A funkcionálisan kapcsolódó poszt-transzlációs módosulások globális hálózatának megfejtése.
- PTMcode: a database of known and predicted functional associations between post-translational modifications in proteins.
- Citrullination: a posttranslational modification in health and disease.
