Identificare gli elementi costitutivi della materia
Al suo livello più fondamentale, la vita è fatta di materia. La materia è qualsiasi sostanza che occupa spazio e ha massa. Gli elementi sono forme uniche di materia con proprietà chimiche e fisiche specifiche che non possono essere scomposte in sostanze più piccole dalle reazioni chimiche ordinarie. Ci sono 118 elementi, ma solo 92 si trovano in natura. I restanti elementi sono sintetizzati in laboratorio e sono instabili.
Ogni elemento è designato dal suo simbolo chimico, che è una singola lettera maiuscola o, quando la prima lettera è già “presa” da un altro elemento, una combinazione di due lettere. Alcuni elementi seguono il termine inglese per l’elemento, come C per il carbonio e Ca per il calcio. I simboli chimici di altri elementi derivano dai loro nomi latini; per esempio, il simbolo del sodio è Na, riferendosi a natrium, la parola latina per il sodio.
I quattro elementi comuni a tutti gli organismi viventi sono ossigeno (O), carbonio (C), idrogeno (H) e azoto (N). Nel mondo non vivente, gli elementi si trovano in proporzioni diverse, e alcuni elementi comuni agli organismi viventi sono relativamente rari sulla terra nel suo complesso, come mostrato nella tabella 1. Per esempio, l’atmosfera è ricca di azoto e ossigeno ma contiene poco carbonio e idrogeno, mentre la crosta terrestre, sebbene contenga ossigeno e una piccola quantità di idrogeno, ha poco azoto e carbonio. Nonostante le loro differenze di abbondanza, tutti gli elementi e le reazioni chimiche tra loro obbediscono alle stesse leggi chimiche e fisiche indipendentemente dal fatto che facciano parte del mondo vivente o non vivente.
| Tabella 1. Approximate Percentage of Elements in Living Organisms (Humans) Compared to the Non-living World | |||
|---|---|---|---|
| Element | Life (Humans) | Atmosphere | Earth’s Crust |
| Oxygen (O) | 65% | 21% | 46% |
| Carbon (C) | 18% | trace | trace |
| Hydrogen (H) | 10% | trace | 0.1% |
| Nitrogen (N) | 3% | 78% | trace |
Learning Objectives
- Draw a diagram of an atom, according to current scientific understanding
- Understand the periodic table of elements and how to use it to understand elements
- Describe the behavior and location of electrons, e come questi fattori influenzano la formazione dei legami tra gli atomi
Atomi
La struttura dell’atomo
Per capire come gli elementi si uniscono, dobbiamo prima discutere il più piccolo componente o blocco di costruzione di un elemento, l’atomo. Un atomo è la più piccola unità di materia che conserva tutte le proprietà chimiche di un elemento. Per esempio, un atomo d’oro ha tutte le proprietà dell’oro in quanto è un metallo solido a temperatura ambiente. Una moneta d’oro è semplicemente un numero molto grande di atomi d’oro modellati nella forma di una moneta e contenenti piccole quantità di altri elementi noti come impurità. Gli atomi d’oro non possono essere scomposti in qualcosa di più piccolo pur mantenendo le proprietà dell’oro.
Un atomo è composto da due regioni: il nucleo, che è al centro dell’atomo e contiene protoni e neutroni, e la regione più esterna dell’atomo che tiene i suoi elettroni in orbita intorno al nucleo, come illustrato nella figura 1. Gli atomi contengono protoni, elettroni e neutroni, tra le altre particelle subatomiche. L’unica eccezione è l’idrogeno (H), che è fatto di un protone e un elettrone senza neutroni.

Figura 1. Gli elementi, come l’elio, qui raffigurato, sono costituiti da atomi. Gli atomi sono costituiti da protoni e neutroni situati all’interno del nucleo, con gli elettroni negli orbitali che circondano il nucleo.
Protoni e neutroni hanno circa la stessa massa, circa 1,67 × 10-24 grammi. Gli scienziati definiscono arbitrariamente questa quantità di massa come un’unità di massa atomica (amu) o un Dalton, come mostrato nella tabella 1. Anche se simili nella massa, protoni e neutroni differiscono nella loro carica elettrica. Un protone ha una carica positiva, mentre un neutrone è privo di carica. Pertanto, il numero di neutroni in un atomo contribuisce significativamente alla sua massa, ma non alla sua carica. Gli elettroni sono molto più piccoli in massa dei protoni, pesando solo 9,11 × 10-28 grammi, o circa 1/1800 di un’unità di massa atomica. Quindi, non contribuiscono molto alla massa atomica complessiva di un elemento. Pertanto, quando si considera la massa atomica, è consuetudine ignorare la massa degli elettroni e calcolare la massa dell’atomo in base al solo numero di protoni e neutroni. Anche se non contribuiscono significativamente alla massa, gli elettroni contribuiscono notevolmente alla carica dell’atomo, poiché ogni elettrone ha una carica negativa uguale alla carica positiva di un protone. Negli atomi neutri senza carica, il numero di elettroni che orbitano attorno al nucleo è uguale al numero di protoni all’interno del nucleo. In these atoms, the positive and negative charges cancel each other out, leading to an atom with no net charge.
Accounting for the sizes of protons, neutrons, and electrons, most of the volume of an atom—greater than 99 percent—is, in fact, empty space. With all this empty space, one might ask why so-called solid objects do not just pass through one another. The reason they do not is that the electrons that surround all atoms are negatively charged and negative charges repel each other.
| Table 1. Protons, Neutrons, and Electrons | |||
|---|---|---|---|
| Charge | Mass (amu) | Location | |
| Proton | +1 | 1 | nucleus |
| Neutron | 0 | 1 | nucleo |
| Elettrone | -1 | 0 | orbitali |
Numero atomico e massa
Gli atomi di ogni elemento contengono un numero caratteristico di protoni ed elettroni. Il numero di protoni determina il numero atomico di un elemento ed è usato per distinguere un elemento da un altro. Il numero di neutroni è variabile, dando luogo agli isotopi, che sono forme diverse dello stesso atomo che variano solo nel numero di neutroni che possiedono. Insieme, il numero di protoni e il numero di neutroni determinano il numero di massa di un elemento, come illustrato nella figura 2. Si noti che il piccolo contributo di massa degli elettroni non è considerato nel calcolo del numero di massa. Questa approssimazione della massa può essere usata per calcolare facilmente quanti neutroni ha un elemento semplicemente sottraendo il numero di protoni dal numero di massa. Poiché gli isotopi di un elemento avranno numeri di massa leggermente diversi, gli scienziati determinano anche la massa atomica, che è la media calcolata del numero di massa per i suoi isotopi presenti in natura. Spesso, il numero risultante contiene una frazione. Per esempio, la massa atomica del cloro (Cl) è 35,45 perché il cloro è composto da diversi isotopi, alcuni (la maggioranza) con massa atomica 35 (17 protoni e 18 neutroni) e alcuni con massa atomica 37 (17 protoni e 20 neutroni).
Domanda pratica
Il carbonio ha un numero atomico di sei, e due isotopi stabili con numeri di massa rispettivamente dodici e tredici. La sua massa atomica è 12,11.

Figura 2. Carbonio-12 e carbonio-13
Quanti neutroni hanno rispettivamente il carbonio-12 e il carbonio-13?
La tavola periodica degli elementi
I diversi elementi sono organizzati e visualizzati nella tavola periodica. Ideata dal chimico russo Dmitri Mendeleev (1834-1907) nel 1869, la tavola raggruppa gli elementi che, pur essendo unici, condividono alcune proprietà chimiche con altri elementi. Le proprietà degli elementi sono responsabili del loro stato fisico a temperatura ambiente: possono essere gas, solidi o liquidi. Gli elementi hanno anche una specifica reattività chimica, la capacità di combinarsi e di legarsi chimicamente tra loro.
Nella tavola periodica, mostrata nella figura 3, gli elementi sono organizzati e visualizzati secondo il loro numero atomico e sono disposti in una serie di righe e colonne basate sulle proprietà chimiche e fisiche condivise. Oltre a fornire il numero atomico di ogni elemento, la tavola periodica mostra anche la massa atomica dell’elemento. Guardando il carbonio, per esempio, appare il suo simbolo (C) e il suo nome, così come il suo numero atomico di sei (in alto a sinistra) e la sua massa atomica di 12,11.

Figura 3. La tavola periodica mostra la massa atomica e il numero atomico di ogni elemento. Il numero atomico appare sopra il simbolo dell’elemento e la massa atomica approssimativa appare sotto di esso.
La tavola periodica raggruppa gli elementi secondo le proprietà chimiche. Le differenze di reattività chimica tra gli elementi si basano sul numero e sulla distribuzione spaziale degli elettroni di un atomo. Gli atomi che reagiscono chimicamente e si legano tra loro formano molecole. Le molecole sono semplicemente due o più atomi legati chimicamente insieme. Logicamente, quando due atomi si legano chimicamente per formare una molecola, i loro elettroni, che formano la regione più esterna di ogni atomo, si uniscono per primi quando gli atomi formano un legame chimico.
Guarda questo video per un’introduzione più approfondita alla tavola periodica:
Elettroni
Gusci di elettroni e il modello di Bohr

Figura 4. Il modello di Bohr.
Va sottolineato che c’è una connessione tra il numero di protoni in un elemento, il numero atomico che distingue un elemento da un altro, e il numero di elettroni che possiede. In tutti gli atomi elettricamente neutri, il numero di elettroni è uguale al numero di protoni. Così, ogni elemento, almeno quando è elettricamente neutro, ha un numero caratteristico di elettroni uguale al suo numero atomico.
Un primo modello dell’atomo fu sviluppato nel 1913 dallo scienziato danese Niels Bohr (1885-1962). In questo modello, gli elettroni esistono all’interno di gusci principali. Un elettrone normalmente esiste nel guscio a più bassa energia disponibile, che è quello più vicino al nucleo. L’energia di un fotone di luce può portarlo in un guscio di energia più alta, ma questa situazione è instabile, e l’elettrone decade rapidamente allo stato fondamentale. Nel processo, viene rilasciato un fotone di luce.
Il modello Bohr mostra l’atomo come un nucleo centrale contenente protoni e neutroni, con gli elettroni in orbite circolari a distanze specifiche dal nucleo, come illustrato nella figura 4. Queste orbite formano gusci di elettroni o livelli di energia, che sono un modo di visualizzare il numero di elettroni nei gusci più esterni. Questi livelli di energia sono designati da un numero e dal simbolo “n”. Per esempio, 1n rappresenta il primo livello energetico situato più vicino al nucleo.
Gli elettroni riempiono gli orbitali in un ordine coerente: prima riempiono gli orbitali più vicini al nucleo, poi continuano a riempire orbitali di energia crescente più lontani dal nucleo. Se ci sono più orbitali di uguale energia, saranno riempiti con un elettrone in ogni livello energetico prima che venga aggiunto un secondo elettrone. Gli elettroni del livello energetico più esterno determinano la stabilità energetica dell’atomo e la sua tendenza a formare legami chimici con altri atomi per formare molecole.
In condizioni standard, gli atomi riempiono prima i gusci interni, spesso risultando in un numero variabile di elettroni nel guscio più esterno. Il guscio più interno ha un massimo di due elettroni, ma i due gusci successivi possono avere ciascuno un massimo di otto elettroni. Questo è noto come la regola dell’ottetto, che afferma, con l’eccezione del guscio più interno, che gli atomi sono più stabili energeticamente quando hanno otto elettroni nel loro guscio di valenza, il guscio elettronico più esterno. Esempi di alcuni atomi neutri e delle loro configurazioni elettroniche sono mostrati nella figura 5. Notate che in questa figura, l’elio ha un guscio elettronico esterno completo, con due elettroni che riempiono il suo primo e unico guscio. Allo stesso modo, il neon ha un guscio esterno completo 2n che contiene otto elettroni. Al contrario, il cloro e il sodio hanno rispettivamente sette e uno nei loro gusci esterni, ma teoricamente sarebbero più stabili dal punto di vista energetico se seguissero la regola dell’ottetto e ne avessero otto.
Domanda pratica
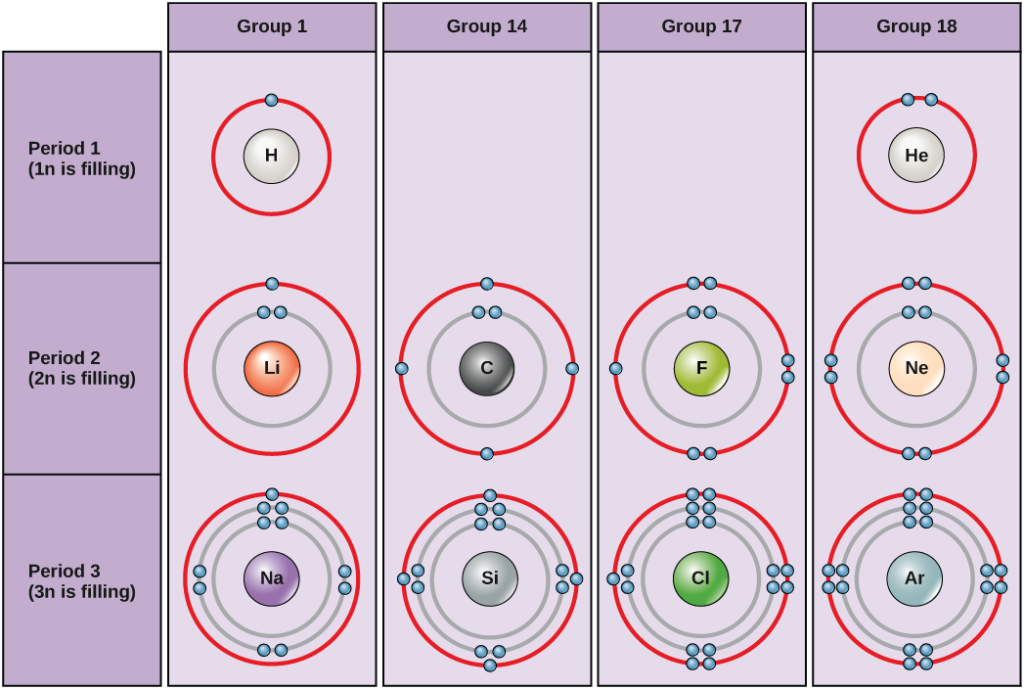
I diagrammi di Bohr indicano quanti elettroni riempiono ogni guscio principale. Gli elementi del gruppo 18 (elio, neon e argon sono mostrati nella figura 5) hanno un guscio esterno, o di valenza, pieno. Un guscio di valenza pieno è la configurazione elettronica più stabile. Gli elementi degli altri gruppi hanno gusci di valenza parzialmente pieni e guadagnano o perdono elettroni per raggiungere una configurazione elettronica stabile.
Un atomo può dare, prendere o condividere elettroni con un altro atomo per raggiungere un guscio di valenza pieno, la configurazione elettronica più stabile. Guardando questa figura, quanti elettroni devono perdere gli elementi del gruppo 1 per raggiungere una configurazione elettronica stabile? Quanti elettroni devono guadagnare gli elementi dei gruppi 14 e 17 per raggiungere una configurazione stabile?
Capire che l’organizzazione della tavola periodica è basata sul numero totale di protoni (ed elettroni) ci aiuta a sapere come gli elettroni sono distribuiti nel guscio esterno. La tavola periodica è organizzata in colonne e righe in base al numero di elettroni e a dove questi elettroni si trovano. Dai un’occhiata più da vicino ad alcuni degli elementi nella colonna all’estrema destra della tavola periodica nella figura 3.
Gli atomi del gruppo 18 elio (He), neon (Ne) e argon (Ar) hanno tutti gusci di elettroni esterni pieni, il che rende inutile per loro condividere elettroni con altri atomi per raggiungere la stabilità; sono altamente stabili come singoli atomi. La loro non reattività li ha portati ad essere chiamati gas inerti (o gas nobili). Confronta questo con gli elementi del gruppo 1 nella colonna di sinistra. Questi elementi, tra cui l’idrogeno (H), il litio (Li) e il sodio (Na), hanno tutti un elettrone nei loro gusci più esterni. Ciò significa che possono ottenere una configurazione stabile e un guscio esterno pieno donando o condividendo un elettrone con un altro atomo o una molecola come l’acqua. L’idrogeno donerà o condividerà il suo elettrone per raggiungere questa configurazione, mentre il litio e il sodio doneranno il loro elettrone per diventare stabili. Come risultato della perdita di un elettrone carico negativamente, diventano ioni carichi positivamente. Gli elementi del gruppo 17, tra cui il fluoro e il cloro, hanno sette elettroni nei loro gusci più esterni, quindi tendono a riempire questo guscio con un elettrone da altri atomi o molecole, rendendoli ioni carichi negativamente. Gli elementi del gruppo 14, di cui il carbonio è il più importante per i sistemi viventi, hanno quattro elettroni nel loro guscio esterno che permette loro di fare diversi legami covalenti (discussi in seguito) con altri atomi. Così, le colonne della tavola periodica rappresentano il potenziale stato condiviso dei gusci esterni degli elettroni di questi elementi che è responsabile delle loro caratteristiche chimiche simili.
Orbitali degli elettroni
Anche se utile per spiegare la reattività e il legame chimico di alcuni elementi, il modello Bohr dell’atomo non riflette accuratamente come gli elettroni sono distribuiti spazialmente intorno al nucleo. Non circondano il nucleo come la terra orbita intorno al sole, ma si trovano in orbitali di elettroni. Queste forme relativamente complesse derivano dal fatto che gli elettroni si comportano non solo come particelle, ma anche come onde. Le equazioni matematiche della meccanica quantistica, conosciute come funzioni d’onda, possono prevedere con un certo livello di probabilità dove un elettrone potrebbe trovarsi in un dato momento. L’area in cui un elettrone ha più probabilità di trovarsi è chiamata il suo orbitale.

Figura 6. Clicca per un’immagine più grande. I sottogusci s hanno la forma di sfere. Entrambi i gusci principali 1n e 2n hanno un orbitale s, ma la dimensione della sfera è maggiore nell’orbitale 2n. Ogni sfera è un singolo orbitale. I sottogusci p sono costituiti da tre orbitali a forma di manubrio. Il guscio principale 2n ha un sottoguscio p, ma il guscio 1 no.
Ricorda che il modello di Bohr rappresenta la configurazione del guscio elettronico di un atomo. All’interno di ogni guscio elettronico ci sono dei sottogusci, e ogni sottoguscio ha un numero specifico di orbitali contenenti elettroni. Mentre è impossibile calcolare esattamente dove si trova un elettrone, gli scienziati sanno che molto probabilmente si trova nel suo percorso orbitale. I sottogusci sono designati dalle lettere s, p, d e f. Il sottoguscio s è di forma sferica e ha un orbitale. Il guscio principale 1n ha un solo orbitale s, che può contenere due elettroni. Il guscio principale 2n ha un sottoguscio s e uno p, e può contenere un totale di otto elettroni. Il sottoguscio p ha tre orbitali a forma di manubrio, come illustrato nella figura 6. I sottogusci d e f hanno forme più complesse e contengono cinque e sette orbitali, rispettivamente. Questi non sono mostrati nell’illustrazione. Il guscio principale 3n ha sottogusci s, p e d e può contenere 18 elettroni. Il guscio principale 4n ha orbitali s, p, d e f e può contenere 32 elettroni. Allontanandosi dal nucleo, il numero di elettroni e di orbitali che si trovano nei livelli di energia aumenta. Procedendo da un atomo all’altro nella tavola periodica, la struttura elettronica può essere elaborata inserendo un elettrone in più nel prossimo orbitale disponibile.
L’orbitale più vicino al nucleo, chiamato orbitale 1s, può contenere fino a due elettroni. Questo orbitale è equivalente al guscio elettronico più interno del modello Bohr dell’atomo. Si chiama orbitale 1s perché è sferico attorno al nucleo. L’orbitale 1s è l’orbitale più vicino al nucleo e viene sempre riempito per primo, prima che qualsiasi altro orbitale possa essere riempito. L’idrogeno ha un solo elettrone; quindi, ha solo un punto dell’orbitale 1s occupato. Questo è designato come 1s1, dove l’apice 1 si riferisce all’unico elettrone nell’orbitale 1s. L’elio ha due elettroni; quindi, può riempire completamente l’orbitale 1s con i suoi due elettroni. Questo è designato come 1s2, riferendosi ai due elettroni dell’elio nell’orbitale 1s. Sulla tavola periodica Figura 6, l’idrogeno e l’elio sono gli unici due elementi nella prima riga (periodo); questo perché hanno solo elettroni nel loro primo guscio, l’orbitale 1s. L’idrogeno e l’elio sono gli unici due elementi che hanno l’1s e nessun altro orbitale elettronico nello stato elettricamente neutro.
Il secondo guscio elettronico può contenere otto elettroni. Questo guscio contiene un altro orbitale s sferico e tre orbitali p a forma di “manubrio”, ognuno dei quali può contenere due elettroni, come mostrato nella figura 6. Dopo che l’orbitale 1s è riempito, il secondo guscio di elettroni viene riempito, riempiendo prima il suo orbitale 2s e poi i suoi tre orbitali p. Quando si riempiono gli orbitali p, ognuno prende un singolo elettrone; una volta che ogni orbitale p ha un elettrone, un secondo può essere aggiunto. Il litio (Li) contiene tre elettroni che occupano il primo e il secondo guscio. Due elettroni riempiono l’orbitale 1s, e il terzo elettrone riempie l’orbitale 2s. La sua configurazione elettronica è 1s22s1. Il neon (Ne), d’altra parte, ha un totale di dieci elettroni: due sono nel suo orbitale 1s più interno e otto riempiono il suo secondo guscio (due ciascuno negli orbitali 2s e tre p); così, è un gas inerte ed energeticamente stabile come un singolo atomo che raramente formerà un legame chimico con altri atomi. Gli elementi più grandi hanno orbitali aggiuntivi, che costituiscono il terzo guscio elettronico. Mentre i concetti di guscio elettronico e orbitali sono strettamente correlati, gli orbitali forniscono una rappresentazione più accurata della configurazione elettronica di un atomo perché il modello orbitale specifica le diverse forme e gli orientamenti speciali di tutti i posti che gli elettroni possono occupare.
Guarda questa animazione visiva per vedere la disposizione spaziale degli orbitali p e s. Note that this video has no audio.
Video Review
This video gives another overview of the electron:
Check Your Understanding
Answer the question(s) below to see how well you understand the topics covered in the previous section. This short quiz does not count toward your grade in the class, and you can retake it an unlimited number of times.
Use this quiz to check your understanding and decide whether to (1) study the previous section further or (2) move on to the next section.