Un elettrolita è un composto chimico che si dissocia in ioni e quindi è capace di trasportare la carica elettrica – cioè un elettrolita è un conduttore elettrico; a differenza dei metalli il flusso di carica non è un flusso di elettroni, ma è un movimento di ioni.
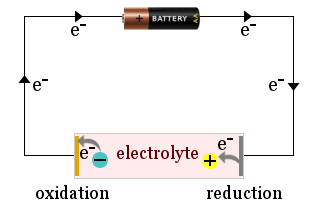
Per esempio, lo schema mostra una batteria domestica utilizzata per attrarre ioni elettroliti agli elettrodi di una cella elettrochimica, dove gli ioni guadagnano elettroni (sono ridotti) o perdono elettroni (sono ossidati).
A volte gli elettrodi stessi reagiscono, per esempio un elettrodo metallico potrebbe essere ossidato e rilasciare ioni nell’elettrolita.
Gli elettroliti possono essere solidi, liquidi o soluzioni.
Esempi di elettroliti
1. Il cloruro di sodio fuso agisce come elettrolita nella produzione di sodio metallico. Viene prodotto anche il gas cloro.
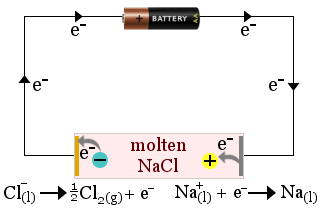 In questo caso, l’elettrolita viene consumato dalle reazioni redox della cella.
In questo caso, l’elettrolita viene consumato dalle reazioni redox della cella.
2. L’idrossido di potassio dissolto in acqua produce un elettrolita altamente conduttivo nella cella Edison, una prima cella ricaricabile.
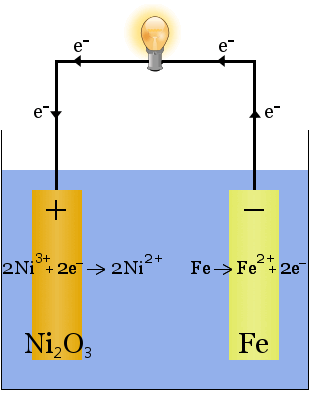
A differenza del caso della produzione di sodio di cui sopra, nessun elettrolita viene consumato in questa reazione.Il ruolo dell’idrossido di potassio in questo caso è di aumentare la disponibilità di ioni per aumentare la conduttività dell’elettrolita e completare il circuito elettrico.
Le equazioni chimiche per le reazioni agli elettrodi sono:
Per la scarica le equazioni si leggono da sinistra a destra; per la carica da destra a sinistra.
3. Tradizionalmente gli elettroliti erano liquidi per permettere il movimento degli ioni.Tuttavia, sono ora disponibili materiali solidi che permettono agli ioni di muoversi facilmente attraverso le loro strutture.Gli elettroliti solidi sono desiderabili in molti prodotti di consumo, perché non perdono.
Il solfuro di litio-stagno-fosforo, Li10SnP2S12, è un elettrolita solido da usare nelle batterie agli ioni di litio.La struttura cristallina dell’elettrolita solido combinata con la sua debole interazione con gli ioni di litio fornisce un ambiente in cui gli ioni di litio possono facilmente passare.
4. Gli elettroliti sono enormemente importanti per i processi elettrochimici negli organismi viventi.I principali ioni di questi elettroliti sono il calcio (Ca2+), il magnesio (Mg2+), il sodio (Na+), il potassio (K+), il cloruro (Cl-), l’idrogeno carbonato (HCO3-) e l’idrogeno fosfato (HPO42-).
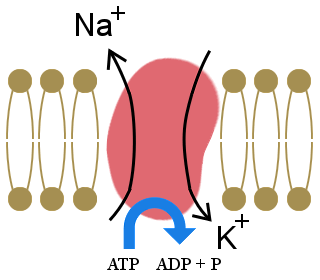
The importance of the sodium-potassium pump, shown in the diagram, to our lives is illustrated by the fact that it uses one-third of our resting energy.The pump maintains our cells’ electrolyte balance, with excess potassium ions inside cells and excess sodium ions outside cells.
This concentration gradient creates a voltage across the cell wall, which allows electrical signals to be transmitted in neurons and in muscles.It also provides the energy for processes in cell-membranes.
