Introduzione
Due segnali visivi che appaiono simultaneamente sono rilevati più rapidamente di uno dei due segnali che appare da solo (Hershenson, 1962; Raab, 1962). Parte di questo effetto bersaglio ridondante (RTE) può essere spiegato stocasticamente da un modello di “corsa dei cavalli”. Cioè, se due stimoli vengono elaborati in canali paralleli e indipendenti per i quali la velocità di elaborazione varia casualmente da un processo all’altro, ad ogni presentazione lo stimolo più veloce vince la gara e raggiunge la soglia di rilevamento per innescare la risposta; quindi, in media, due stimoli hanno maggiori probabilità di produrre una risposta più veloce rispetto al tempo medio di risposta a uno stimolo elaborato in uno dei due canali.
Tuttavia, le analisi delle distribuzioni di frequenza cumulative hanno dimostrato che esiste un ulteriore contributo all’RTE che non può essere spiegato da un modello a cavallo tra due canali indipendenti. Miller (1982) ha proposto un modello di “co-attivazione” in cui i due segnali sono sommati in un pool di attivazione. Miniussi et al. (1998) hanno dimostrato che gli obiettivi ridondanti producono latenze più brevi per i potenziali cerebrali evento-correlati P1 e N1, indicando che la somma neurale si verifica all’inizio del percorso visivo. Esperimenti in pazienti emianopici hanno anche dimostrato che l’RTE non può essere completamente spiegato da una corsa di cavalli per raggiungere la soglia di rilevamento, poiché un RTE può essere manifesto anche in assenza di consapevolezza fenomenica di uno dei due stimoli (Marzi et al., 1986; Tomaiuolo, 1997; de Gelder et al., 2001; Leh et al., 2006a,b). Infatti, nei pazienti emisferectomici un bersaglio ridondante nel campo cieco non solo genera un RTE, il RTE è aumentato quando lo stimolo ridondante completa un modello di gestalt (Georgy et al., 2016). Queste osservazioni nell’emianopica suggeriscono che la sommatoria neurale avviene a livello sottocorticale e non dipende dalla corteccia visiva primaria.
Le prove indirette cumulative hanno implicato il collicolo superiore (SC) come substrato per la sommatoria neurale che contribuisce alla RTE. Tuttavia, le prove dirette non sono ancora state riportate. La ricerca attuale studia il percorso neurale che trasmette i segnali visivi che sono integrati nella SC. La SC consiste di strati superficiali e profondi. Gli strati profondi del collicolo ricevono afferenze, sia dirette che attraverso i gangli della base, dalla corteccia oculomotoria (Hikosaka e Wurtz, 1983; Pare e Wurtz, 1997; Sommer e Wurtz, 2000). Le afferenze visive agli strati superficiali del collicolo, tuttavia, sono trasmesse sia dalla retina (attraverso il tratto retino-tettale) che dalla corteccia visiva precoce (Fries, 1984), attraverso il brachio del SC.
Siccome gli effetti di somma neurale sono stati dimostrati in pazienti neurologici privi di corteccia visiva, i segnali visivi sommati nel collicolo potrebbero essere trasmessi direttamente dalla retina agli strati superficiali del collicolo attraverso il tratto retino-tettale. Se questo è il caso, la sommatoria neurale potrebbe essere abolita da lesioni del brachio della SC.
Le lesioni che interrompono il brachio della SC sono molto rare. Qui riportiamo lo studio di due pazienti con lesioni subcorticali unilaterali che hanno deafferenziato la SC dall’input visivo e che non hanno manifestato un RTE. Un paziente aveva una lesione che danneggiava sia il nucleo pulvinare del talamo, la SC rostrale e il suo brachium. Nell’altro paziente, con danni al mesencefalo dorsale da una lesione cerebrale traumatica, la SC appariva intatta, ma il suo brachio era danneggiato.
Materiali e metodi
Partecipanti
Due pazienti neurologici, ciascuno con il suo gruppo di controllo di pari età, sono stati testati in un esperimento per misurare l’RTE.
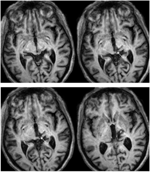
RE aveva 71 anni al momento del test. Un’emorragia talamica posteriore 3 anni prima ha distrutto il pulvinare mediale, i nuclei talamici ventro-laterali e l’arto posteriore della capsula interna con danni che si estendono nel mesencefalo dorsale tra cui il pretetto e la SC rostrale (Figura 1) La trattografia DTI probabilistica (Behrens et al., 2003, Behrens et al., 2007) ha confermato che la lesione ha distrutto il brachium della SC (Figura 2). RE era paralizzata sul lato sinistro del corpo con perdita di sensibilità nel viso e nel braccio sinistro. Aveva movimenti oculari anormali compresa la retrazione delle palpebre, movimenti oculari verticali paralizzati e convergenza compromessa, che erano una conseguenza dell’estensione della lesione nel mesencefalo dorsale.
 www.frontiersin.org
www.frontiersin.orgFIGURA 1. RM ad alta risoluzione (0,7 mm3) T1-pesata del paziente RE. Fette assiali da ventrale (in alto a sinistra) a dorsale (in basso a destra) che mostrano la lesione nel mesencefalo dorsale destro e talamo. Estensione della lesione nel collicolo superiore rostrale (SC) mostrato da frecce bianche.
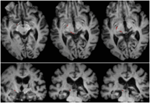
FIGURA 2. Tractografia che dimostra il tratto retinotettale nel paziente RE co-registrato alle fette assiali pesate in T1 (in alto da ventrale a dorsale) e fette coronali (in basso da anteriore a posteriore). Il corso del tratto retinotettale è mostrato nell’emisfero sinistro (rosso). Nessuna linea di flusso è stata tracciata nell’emisfero destro e, per confronto con l’emisfero intatto si può vedere che la lesione ha distrutto il brachium della SC nell’emisfero destro. La linea di flusso mostrato in rosso è stato generato con trattografia probabilistica utilizzando FSL FDT (FMRIB Diffusion Toolbox; Behrens et al., 2003, Behrens et al., 2007; http://fsl.fmrib.ox.ac.uk/fsl/fslwiki). Le immagini di risonanza magnetica eco-planare pesate in diffusione sono state acquisite con una risoluzione di 1,5 mm3 con 32 direzioni di codifica della diffusione distribuite isotropicamente (b = 800) e una linea di base (b = 0). Tempo di ripetizione = 2 s, e tempo di eco = 35 ms. Per la trattografia probabilistica, abbiamo segnato manualmente la regione di partenza (cioè, ha disegnato maschere seme) sul tratto ottico di ogni emisfero appena posteriore al chiasmo e una regione di destinazione (maschera di destinazione) sul SC.
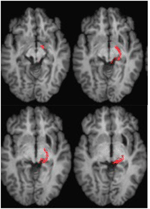
ML aveva 23 anni al momento del test. Aveva subito una grave lesione cerebrale traumatica in un incidente stradale 7 anni prima con conseguente lesione assonale diffusa con emorragia nel putamen destro e nel mesencefalo dorsale. I dettagli della sua storia, l’esame neurologico e i risultati di neuroimaging sono stati riportati da (Poliva et al., 2015). Anche se a sinistra c’era qualche danno motorio, tra cui spasticità e atassia, aveva riacquistato l’indipendenza. La sua principale disabilità era una grave agnosia uditiva dovuta a danni alle vie uditive del tronco cerebrale, compreso il collicolo inferiore sinistro. L’acuità visiva e i campi visivi non erano compromessi e non c’era negligenza visiva o estinzione. I segni oculomotori della disfunzione del mesencefalo includevano scatti a onde macro-quadrate e spasmi di convergenza sullo sguardo verticale (più verso il basso che verso l’alto), senza ptosi o anomalie pupillari. La risonanza magnetica ad alta risoluzione ha mostrato una cavità cistica nel putamen destro nel sito della sua precedente emorragia, e una piccola lesione periventricolare sul ponte inferiore destro, nella regione del peduncolo cerebellare inferiore (Figura 3). Aveva un’avulsione quasi completa del collicolo inferiore sinistro, risparmiando solo le sue parti più mediali e caudali. Il danno si estendeva nel pretetto laterale e nel tegmento del mesencefalo distruggendo la brachia dei collicoli superiori e inferiori, e ventralmente nel nucleo rosso. La trattografia DTI probabilistica ha confermato che la lesione ha distrutto il brachium della SC (Figura 4).
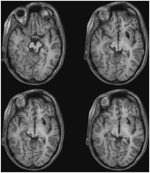
FIGURA 3. RM ad alta risoluzione (0,7 mm3) T1-pesata del paziente ML. Fette assiali da ventrale (in alto a sinistra) a dorsale (in basso a destra) che mostrano danni al collicolo inferiore sinistro e al tegmento mesencefalico ventrale e laterale alla SC.
 www.frontiersin.org
www.frontiersin.orgFIGURA 4. DTI tractography nel paziente ML che mostra il tratto retino-tettale nell’emisfero destro (rosso) co-registrato alle immagini RM pesate in T1 nel piano assiale da ventrale (in alto a sinistra) a dorsale (in basso a destra). Diffusione ponderata eco-planare immagini di risonanza magnetica sono stati acquisiti a 2 mm3 risoluzione con 63 isotropicamente distribuiti diffusione-codifica direzioni (b = 1000) e una linea di base (b = 0). Tempo di ripetizione = 2 s, e tempo di eco = 35 ms. La trattografia è stata implementata come descritto nella Figura 2.
Soggetto di controllo neurologicamente sano per il paziente RE incluso 11 adulti anziani (sei donne e cinque uomini, età media: 68.5, gamma 59-73). Sono stati reclutati dal pannello dei partecipanti della comunità della Bangor University. I partecipanti non avevano problemi neurologici, psicologici, psichiatrici o cognitivi noti e tutti i partecipanti avevano una vista normale/corretta. I partecipanti hanno ricevuto un pagamento di 6 sterline per la loro partecipazione.
I soggetti di controllo neurologicamente sani per il paziente ML comprendevano 11 laureandi e post laureati della Bangor University di età compresa tra 18 e 26 anni (sette donne e quattro uomini).
Apparato e condizioni di visualizzazione
Il software di programmazione Presentation® in esecuzione su un computer PC ha registrato i tempi di reazione (RT) e generato stimoli che sono stati presentati su un monitor Dell (12,5″ × 25″, frequenza di aggiornamento 60 Hz.) posto a livello degli occhi 57 cm di fronte ai partecipanti con visione binoculare in condizioni di luce attenuata. Un mento e un poggiatesta sono stati utilizzati per garantire la stabilità della testa. Le risposte dei partecipanti sono state registrate tramite la pressione della barra spaziatrice su una tastiera.
Stimoli
Gli stimoli sperimentali consistevano in quadrati bianchi non riempiti (1 cm × 1 cm) posizionati a 8° a sinistra e a destra di una piccola scatola di fissazione (0,2 cm × 0,2 cm) al centro dello schermo. Gli stimoli target consistevano nel riempimento di una o entrambe le caselle periferiche per produrre un quadrato bianco solido. Tutti gli stimoli erano bianchi presentati su uno sfondo grigio.
La figura 5 mostra la sequenza di una singola prova. Le caselle di marcatura sono rimaste visibili per tutto l’esperimento. Dopo un intervallo inter-trial di 1750 ms, la casella di fissazione è apparsa per iniziare il processo. Dopo un intervallo casuale che andava da 250 a 750 ms (in incrementi di 25 ms), un obiettivo che richiedeva una semplice risposta di pressione del tasto sulla barra spaziatrice della tastiera, è apparso nella posizione di una o entrambe le caselle di marcatura. L’obiettivo era un quadrato bianco riempito generato dal riempimento di una o entrambe le caselle di marcatura. In modo casuale e con uguale probabilità, gli obiettivi apparivano a sinistra, a destra o entrambi contemporaneamente. Nessun bersaglio è apparso nelle prove di cattura (10% delle prove).
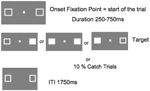
FIGURA 5. Sequenza di visualizzazione di un singolo trial (ITI, intervallo inter-trial tra la risposta del partecipante e l’inizio del punto di fissazione che dà inizio al trial successivo).
Procedura
Ogni partecipante è stato testato in una singola sessione. Dopo aver letto le istruzioni sullo schermo, ai partecipanti sono stati mostrati esempi di tutti gli stimoli che sono stati presentati nel compito (la casella di fissazione e ciascuna delle tre presentazioni del target) ed è stato chiesto di confermare il riconoscimento di ogni target tramite la pressione della barra spaziatrice. Le istruzioni erano di mantenere la fissazione sul riquadro centrale per la durata di ogni prova, e di rispondere il più rapidamente possibile premendo la barra spaziatrice della tastiera con la mano destra non appena un bersaglio appariva.
Una volta che il partecipante confermava verbalmente e tramite la pressione del tasto che tutte le istruzioni erano state comprese, la presentazione di prove pratiche (10 di ogni condizione di presentazione del bersaglio e 3 prove di ‘cattura’ senza bersaglio) procedeva. Il feedback sullo schermo è stato presentato durante il completamento delle prove pratiche, comprese le seguenti affermazioni: (1) “Corretto”, (2) “Prova a rispondere più velocemente!” e (3) “Rispondi solo se vedi un bersaglio”. Una volta che la sessione di pratica è stata completata e sia il partecipante che lo sperimentatore erano sicuri che le istruzioni del compito erano state comprese correttamente, il partecipante è stato invitato a iniziare l’esperimento. Le prime 30 prove di ogni blocco sperimentale sono state escluse come prove di pratica. Ogni blocco consisteva di un totale di 233 prove: 70 a destra, 70 a sinistra, 70 entrambi, e 23 prove di “cattura”. Una breve pausa è stata data a metà del blocco. Il paziente ML e i controlli più giovani sono stati testati in un unico blocco. A causa della variabilità legata all’età e alla condizione della paziente RE, è stata testata in due blocchi in giorni separati; e anche i suoi partecipanti di controllo di pari età sono stati testati in due sessioni in un solo giorno.
Analisi
Per ogni gruppo di controllo, è stata calcolata la RT mediana per ogni partecipante in ogni condizione (target sinistro, target destro, target bilaterale) dopo aver escluso le prove che seguivano le prove di catch e quelle con RT di <100 ms o >800 ms. Un t-test a campione appaiato è stato fatto per confermare che non c’era asimmetria per le risposte agli obiettivi unilaterali destro e sinistro, ed è stato calcolato un RT medio per gli obiettivi unilaterali. L’RTE è stato calcolato sottraendo i RT per le prove bilaterali dai RT per le prove unilaterali. Per ogni paziente, dopo aver escluso le prove successive alle prove di cattura e quelle con RT di <100 ms o >800 ms, un t-test a coppie ha confrontato le RT mediane per gli obiettivi unilaterali controlaterali e ipsilaterali. Come riportato di seguito, le RT per le risposte agli obiettivi controlaterali erano più lunghe di quelle per gli obiettivi unilaterali ipsilaterali. Per determinare se la presenza di un bersaglio contralesionale generava un RTE statisticamente affidabile, un test t-test a campioni appaiati ha confrontato i RT mediani per le prove con bersaglio bilaterale con le prove con bersaglio ipsilesionale unilaterale.
Per verificare se l’RTE era attendibilmente più piccolo per ogni paziente rispetto al rispettivo gruppo di controllo, l’RTE è stato calcolato per ogni partecipante di controllo e sono stati calcolati i limiti superiore e inferiore degli intervalli di confidenza (CI) al 95%. Lo Z-score per l’RTE di ogni paziente è stato calcolato rispetto al gruppo di controllo e testato per l’affidabilità statistica con il t-test di Crawford.
I valori P per i test t a coppie di campioni sono stati riportati per due code e per il t di Crawford, una coda.
Risultati
RE dei pazienti
Partecipanti di controllo: La media dei RT mediani non differiva per le risposte di sinistra e di destra (t = 0,6.) La figura 6 mostra che i RT erano più brevi (l’RTE) per gli obiettivi bilaterali che per la sinistra (t = 6,8, p < 0,001, o destra (t1,10) = 3,8, p = 0,003) obiettivi unilaterali. La RT mediana per le prove bilaterali è stata sottratta dalla media della RT mediana per gli obiettivi unilaterali per calcolare un RTE medio per ogni partecipante di controllo. L’RTE medio del gruppo di controllo era di 24,3 ms (SEM = 2,75).

FIGURA 6. RT mediani per il paziente RE, e media dei RT mediani per i partecipanti del gruppo di controllo per gli obiettivi che appaiono nel campo visivo sinistro (‘Left’), campo visivo destro (‘Right’), e contemporaneamente in entrambi i campi visivi (‘Both’). Le barre di errore per i partecipanti al controllo indicano gli errori standard.
I RT mediani del paziente RE erano più lunghi dei controlli (Figura 6), ed erano al di sopra del limite superiore del 95% CI dei RT medi del gruppo di controllo per tutte e tre le condizioni (sinistra = 457 ms; destra = 449 ms; entrambi = 426 ms). I RT agli obiettivi unilaterali nel campo contralesionale (sinistra) erano più lunghi rispetto agli obiettivi unilaterali nel campo ipsilesionale (destra) (t = 6.0, p < 0.001).
Importante, non c’era RTE: RT mediana per gli obiettivi bilaterali (500 ms) non era più breve rispetto agli obiettivi unilaterali nel campo visivo ipsilesionale (destra) (494 ms; t = 1.141), p = ns (Figura 6). La tabella 1 (in alto) mostra che l’RTE calcolato per la paziente RE era significativamente inferiore all’RTE del suo gruppo di controllo.

TABLE 1. Effetto bersaglio ridondante per i pazienti RE (in alto) e ML (in basso), e RTE media per i loro rispettivi gruppi di controllo con intervalli di confidenza al 95% (CI), Z-scores e Crawford t-test confrontando ogni paziente con il suo rispettivo gruppo di controllo.
Paziente ML
Partecipanti di controllo: La media dei RT mediani non differiva per le risposte ai target di sinistra e di destra (t = 0,86. La Figura 7 mostra che gli RT erano più brevi (l’RTE) per i target bilaterali che per i target unilaterali di sinistra (t = 4,7, p = 0,001, o di destra (t1,11) = 7,8, p < 0,001).

FIGURA 7. RT mediani per il paziente ML e media dei RT mediani per i partecipanti del gruppo di controllo per gli obiettivi che appaiono nel campo visivo sinistro, nel campo visivo destro e contemporaneamente in entrambi i campi visivi. Le barre di errore per i partecipanti al controllo indicano gli errori standard.
La RT mediana per le prove bilaterali del target è stata sottratta dalla media della RT mediana per i target unilaterali sinistro e destro per calcolare un RTE per ogni partecipante al controllo.
L’RTE medio del gruppo era di 33 ms (SEM = 6,65).
I RT mediani del paziente ML erano più lunghi dei controlli (Figura 7), ed erano superiori al limite superiore del 95% dell’IC medio del gruppo di controllo per tutte e tre le condizioni (sinistra = 322 ms; destra = 307 ms; entrambi = 277 ms). I RT agli obiettivi unilaterali nel campo destro (contralesional) erano più lunghi rispetto agli obiettivi unilaterali nel campo sinistro (ipsilesional) (t = 4.9, p = 0.001). Non c’era nessun RTE. I RT per gli obiettivi bilaterali (361 ms) non erano più brevi di quelli unilaterali nel campo visivo ipsilesionale (sinistro) (363 ms). La tabella 1 (in basso) mostra che l’RTE calcolato per la paziente ML era significativamente inferiore all’RTE per il suo gruppo di controllo.
Discussione
Sono stati misurati RT semplici per rilevare obiettivi singoli in entrambi i campi controlesionale o ipsilesionale, e obiettivi bilaterali, in due pazienti in cui il brachium della SC era danneggiato in un emisfero. In uno dei pazienti (una giovane donna) il danno era nell’emisfero sinistro ed era dovuto a una lesione cerebrale traumatica; e, mentre la lesione coinvolgeva il collicolo inferiore e si estendeva nel tegmento del mesencefalo, il danno alla SC di per sé non era evidente con neuroimaging ad alta risoluzione. Nell’altro paziente (una donna anziana) il danno era nell’emisfero destro ed è stato causato da un’emorragia ipertensiva che ha anche causato danni estesi al pulvinar mediale e talamo laterale e si estendeva nel mesencefalo dorsale tra cui la SC rostrale. In entrambi i pazienti semplice RT per rilevare obiettivi visivi nel campo contralesionale è stato rallentato rispetto al campo ipsilesional. Nessuno dei due pazienti ha mostrato un effetto di somma spaziale (RTE) per il rilevamento del bersaglio quando gli stimoli sono stati presentati in entrambi i campi visivi.
Queste osservazioni hanno fatto luce sul ruolo della SC nel rilevamento del bersaglio e, più specificamente, il ruolo delle afferenze visive alla SC. Posner et al. (1980) hanno definito operativamente il rilevamento come evidenziato dalla capacità di effettuare una risposta arbitraria a un segnale visivo (ad esempio, una semplice pressione di un tasto con un dito, come nel presente esperimento). Hanno ipotizzato che il rilevamento richieda un’allocazione dell’attenzione per selezionare il bersaglio per l’elaborazione in un sistema a capacità limitata che gli dà la priorità per essere agito.
Song et al. (2011) hanno dimostrato che l’inattivazione della SC delle scimmie causa deficit impressionanti di selezione del bersaglio che non possono essere facilmente spiegati come una semplice compromissione della percezione visiva o dell’esecuzione motoria, e hanno suggerito che contribuisce a una mappa di priorità di scopo più generale. In quell’esperimento alle scimmie venivano presentati due stimoli in campi visivi opposti e dovevano indicare, con una risposta di raggiungimento, quale fosse apparso per primo. Una scimmia è stata addestrata a raggiungere lo stimolo che è apparso per primo; e una scimmia è stata addestrata a raggiungere l’obiettivo che è apparso per secondo. In entrambi i casi, c’era un forte pregiudizio contro la selezione del bersaglio che si trovava nel campo visivo controlaterale alla lesione. Poiché la stessa distorsione è stata osservata nella scimmia che ha raggiunto il secondo bersaglio apparso, la distorsione non poteva essere attribuita a un ritardo nella percezione del bersaglio controlaterale. L’inattivazione collicolare non ha causato un’alterazione nel giudizio percettivo di quale stimolo è apparso per primo. Piuttosto, gli stimoli nel campo visivo controlaterale al collicolo inattivato erano svantaggiati nell’essere prioritari per l’azione.
Zhaoping (2016) ha recentemente evidenziato una distinzione tra mappe di salienza neurali e mappe di priorità, e ha sostenuto una migrazione evolutiva di una mappa di salienza percettiva dal tectum ottico/SC alla corteccia visiva primaria. Ha proposto che i segnali di salienza possono essere trasmessi a una mappa di priorità nella SC senza proiettare la proprietà di sintonizzazione delle caratteristiche.
Il brachio della SC trasmette segnali visivi afferenti agli strati superficiali del collicolo dalla retina attraverso il tratto retino-tettale; ma la maggior parte delle fibre afferenti visive trasmesse attraverso il brachio sono proiezioni dalla corteccia visiva primaria. Se il brachio è interrotto, i segnali di salienza dalla corteccia visiva primaria possono essere trasmessi al collicolo attraverso i campi oculari frontali. Ma in assenza di proiezioni dirette agli strati superficiali del collicolo dalla retina o dalla corteccia visiva, come presumiamo essere il caso nei pazienti con lesioni del brachio, ci vuole più tempo perché la mappa di priorità collicolare sia attivata, con il risultato di risposte più lente ai segnali visivi controlaterali.
Come notato nell’introduzione, il contributo all’RTE che si basa su un modello probabilistico di cavallo da corsa dipende dal rilevamento di entrambi gli obiettivi; e da una corsa in cui l’efficienza dei canali indipendenti in cui vengono trasmessi i due obiettivi sono equivalenti, in modo che il risultato della corsa per raggiungere la soglia di rilevamento sia casuale da un processo all’altro. Poiché la soglia di rilevazione per i segnali controlesionali è più alta nei pazienti qui riportati, i target ridondanti non potrebbero beneficiare sulla base di una corsa stocastica di cavalli; cioè, l’esito della gara tra i segnali ipsilesionali e controlesionali non è casuale – i segnali controlesionali hanno più probabilità di perdere la gara che di vincerla.
Nonostante, la ricerca nei pazienti emianopici ha dimostrato che esiste anche una componente di somma neurale che contribuisce al RTE che non dipende dalla rilevazione di entrambi i target (Marzi et al, 1986; Tomaiuolo, 1997; de Gelder et al., 2001). Dal momento che i pazienti commissurotomizzati hanno dimostrato di avere un RTE (Marzi et al., 1986; Reuter-Lorenz et al., 1995), è stato sostenuto che l’integrazione interemisferica dei segnali attraverso il meridiano verticale deve avvenire a livello sottocorticale.
Savazzi e Marzi (2004) hanno dimostrato che la somma neurale non si è verificata con stimoli cromatici di breve lunghezza d’onda sia in persone neurologicamente intatte che in pazienti con split brain. Leh et al. (2006b) hanno riferito che, mentre un RTE si è verificato con stimoli acromatici in alcuni pazienti emisferectomizzati emianopici, non c’era RTE in questi pazienti quando stimoli cromatici di lunghezza d’onda corta sono stati utilizzati come target. Gli stimoli di lunghezza d’onda corta (cioè viola) attivano solo i coni S nella retina. Le cellule gangliari retiniche che ricevono input dai coni S non proiettano direttamente alla SC o agli strati magnocellulari del nucleo genicolato laterale (De Monasterio, 1978). Dal momento che le proiezioni dalla corteccia visiva primaria alla SC attraverso il brachium della SC relè visivo solo segnali visivi da afferenze magnocellulari geniculostriate (Schiller et al., 1979), il fallimento degli stimoli del cono S per generare un RTE suggerisce che la sommatoria neurale si verifica nella SC e dipende da afferenze visive trasmesse attraverso il suo brachio.
C’è, quindi, la prova convergente in pazienti split brain, pazienti emianopici con vista cieca, e da esperimenti che utilizzano stimoli a onde corte, che la sommatoria neurale si verifica nella SC. Tuttavia, mentre gli stimoli di lunghezza d’onda corta non attivano le cellule gangliari retiniche che proiettano alla SC attraverso il brachium, non si può concludere che il collicolo sia interamente cieco a tali stimoli. Le registrazioni di singole unità nella SC delle scimmie hanno dimostrato che gli stimoli a onde corte attivano le risposte negli strati superficiali del collicolo. Inoltre, la trattografia ha dimostrato, in quei pazienti emisferectomizzati con un RTE (cioè, vista cieca), ma non in quei pazienti che non hanno mostrato evidenza di vista cieca, che il SC aveva connessione con l’emisfero intatto (Leh et al., 2006a).
I risultati della presente indagine, quindi, forniscono la prima prova diretta che la sommatoria spaziale si verifica nel SC che dipende dalla trasmissione di segnali visivi attraverso il suo brachium.
Dichiarazione etica
Questo studio è stato condotto in conformità con le linee guida e con l’approvazione del protocollo del Comitato Etico NHS, Bangor, UK, e la Scuola di Psicologia Comitato Etico della Bangor University, UK. Il consenso informato orale e scritto è stato ottenuto da tutti i partecipanti in conformità con la Dichiarazione di Helsinki.
Contributi degli autori
MvK: Ha concepito la ricerca, progettato e programmato l’esperimento, raccolto e analizzato i dati dei pazienti e contribuito a scrivere il manoscritto. KK: ha raccolto i dati di controllo, ha esaminato la letteratura pertinente, ha analizzato i dati di controllo e ha contribuito alla stesura del manoscritto. RR: Reclutato i pazienti e analizzato gli studi di neuroimaging tra cui la dissezione virtuale con DTI tractography, preparato la casistica dei pazienti e contribuito alla scrittura del manoscritto.
Conflict of Interest Statement
Gli autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi relazione commerciale o finanziaria che potrebbe essere interpretata come un potenziale conflitto di interessi.
Behrens, T., Woolrich, M. W., Jenkinson, M., Johansen-Berg, H., Nunes, R. G., Clare, S., et al. (2003). Caratterizzazione e propagazione dell’incertezza nell’imaging MR pesato in diffusione. Magn. Reson. Med. 50, 1077-1088. doi: 10.1002/mrm.10609
PubMed Abstract | CrossRef Full Text | Google Scholar
Behrens, T. E., Berg, H. J., Jbabdi, S., Rushworth, M. F., and Woolrich, M. W. (2007). Trattografia di diffusione probabilistica con orientamenti multipli delle fibre: cosa possiamo guadagnare? Neuroimage 34, 144–155.
Google Scholar
de Gelder, B., Pourtois, G., van Raamsdonk, M., Vroomen, J., and Weiskrantz, L. (2001). Unseen stimuli modulate conscious visual experience: evidence from interhemispheric summation. Neuroreport 12, 385–391. doi: 10.1097/00001756-200102120-00040
CrossRef Full Text | Google Scholar
De Monasterio, F. M. (1978). Properties of ganglion cells with atypical receptive-field organization in retina of macaques. J. Neurophysiol. 41, 1435–1449.
PubMed Abstract | Google Scholar
Fries, W. (1984). Cortical projections to the superior colliculus in the macaque monkey: a retrograde study using horseradish peroxidase. J. Comp. Neurol. 230, 55–76. doi: 10.1002/cne.902300106
PubMed Abstract | CrossRef Full Text | Google Scholar
Georgy, L., Celeghin, A., Marzi, C. A., Tamietto, M., and Ptito, A. (2016). Il collicolo superiore è sensibile alla configurazione dello stimolo gestalt-like in pazienti emisferectomizzati. Cortex 81, 151-161. doi: 10.1016/j.cortex.2016.04.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Hershenson, M. (1962). Tempo di reazione come misura della facilitazione intersensoriale. J. Exp. Psychol. 63, 289-293. doi: 10.1037/h0039516
CrossRef Full Text | Google Scholar
Hikosaka, O., and Wurtz, R. (1983). Funzioni visive e oculomotorie della scimmia substantia nigra pars reticulata. III. memoria contingente risposte visive e saccade. J. Neurophysiol. 49, 1268-1284.
PubMed Abstract | Google Scholar
Leh, S. E., Johansen-Berg, H., e Ptito, A. (2006a). Visione inconscia: nuove intuizioni nel correlato neuronale di blindsight utilizzando la trattografia di diffusione. Brain 129(Pt 7), 1822–1832.
PubMed Abstract | Google Scholar
Leh, S. E., Mullen, K. T., and Ptito, A. (2006b). Absence of S-cone input in human blindsight following hemispherectomy. Eur. J. Neurosci. 24, 2954–2960.
PubMed Abstract | Google Scholar
Marzi, C., Tassinari, G., Aglioti, S., and Lutzemberger, L. (1986). Spatial summation across the vertical meridian in hemianopics: a test of blindsight. Neuropsychologia 24, 749–758. doi: 10.1016/0028-3932(86)90074-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Miller, J. (1982). Divided attention: evidence for coactivation with redundant signals. Cogn. Psychol. 14, 247–279. doi: 10.1016/0010-0285(82)90010-X
CrossRef Full Text | Google Scholar
Miniussi, C., Girelli, M., and Marzi, C. A. (1998). Neural site of the redundant target effect electrophysiological evidence. J. Cogn. Neurosci. 10, 216–230. doi: 10.1162/089892998562663
CrossRef Full Text | Google Scholar
Pare, M., and Wurtz, R. (1997). Monkey posterior parietal cortex neurons antidromically activated from superior colliculus. J. Neurophysiol. 78, 3493–3497.
PubMed Abstract | Google Scholar
Poliva, O., Bestelmeyer, P. E., Hall, M., Bultitude, J. H., Koller, K., and Rafal, R. D. (2015). Mappatura funzionale della corteccia uditiva umana: indagine fMRI di un paziente con agnosia uditiva da trauma al collicolo inferiore. Cogn. Behav. Neurol. 28, 160-180. doi: 10.1097/WNN.0000000000000072
PubMed Abstract | CrossRef Full Text | Google Scholar
Posner, M., Snyder, C., e Davidson, B. (1980). L’attenzione e il rilevamento dei segnali. J. Exp. Psychol. Gen. 109, 160-174. doi: 10.1037/0096-3445.109.2.160
CrossRef Full Text | Google Scholar
Raab, D. H. (1962). Facilitazione statistica dei tempi di reazione semplici. Trans. N. Y. Acad. Sci. 24, 574-590. doi: 10.1111/j.2164-0947.1962.tb01433.x
CrossRef Full Text | Google Scholar
Reuter-Lorenz, P., Nozawa, G., Gazzaniga, M. S., and Hughes, H. C. (1995). Destino dei bersagli trascurati: un’analisi cronometrica degli effetti dei bersagli ridondanti nel cervello bisecato. J. Exp. Psychol. Hum. Percept. Perform. 21, 211-230. doi: 10.1037/0096-1523.21.2.211
PubMed Abstract | CrossRef Full Text | Google Scholar
Savazzi, S., and Marzi, C. A. (2004). Il collicolo superiore sussiste nella sommatoria neurale interemisferica sia nei normali che nei pazienti con sezione totale o agenesia del corpo calloso. Neuropsychologia 42, 1608-1618. doi: 10.1016/j.neuropsychologia.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiller, P. H., Malpeli, J. G., and Schein, S. J. (1979). Composizione di input genicolostriate ot collicolo superiore della scimmia rhesus. J. Neurophysiol. 42, 1124-1133.
PubMed Abstract | Google Scholar
Sommer, M., e Wurtz, R. (2000). Composizione e organizzazione topografica dei segnali inviati dal campo oculare frontale al collicolo superiore. J. Neurophysiol. 83, 1979–2001.
PubMed Abstract | Google Scholar
Song, J. H., Rafal, R. D., and McPeek, R. M. (2011). PNAS Plus: deficits in reach target selection during inactivation of the midbrain superior colliculus. Proc. Natl. Acad. Sci. U.S.A. 108, E1433–E1440. doi: 10.1073/pnas.1109656108
PubMed Abstract | CrossRef Full Text
Tomaiuolo, F. (1997). Blindsight in hemispherectomized patients as revealed by spatial summation across the vertical meridian. Brain 120, 795–803. doi: 10.1093/brain/120.5.795
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhaoping, L. (2016). From the optic tectum to the primary visual cortex: migration through evolution of the saliency map for exogenous attentional guidance. Curr. Opin. Neurobiol. 40, 94–102. doi: 10.1016/j.conb.2016.06.017
PubMed Abstract | CrossRef Full Text | Google Scholar