La fuga della natura dalla prigionia genetica
Modifiche post traslazionali: Una breve panoramica
Come funziona la modifica post-traslazionale?
Modifiche post-traslazionali più comuni
L’impatto della modifica post-traslazionale su salute e malattia
Una breve panoramica
Cosa significa PTM?
Le cellule devono rilevare e reagire ai cambiamenti delle condizioni interne ed esterne. Un metodo usato per adattarsi a questi cambiamenti è la modifica chimica delle proteine. I cambiamenti chimici condizionali sono trasmessi dai sensori agli effettori attraverso modifiche post-traslazionali reversibili (PTM) delle proteine. Le PTM giocano un ruolo importante nel modificare il prodotto finale dell’espressione, contribuiscono ai processi biologici e alle condizioni di malattia, giocando un ruolo chiave in molti processi cellulari come la differenziazione cellulare (1), la degradazione delle proteine, i processi di segnalazione e regolazione, la regolazione dell’espressione genica e le interazioni proteina-proteina (2,3).
Come funziona la modifica post traslazionale?
Le PTM possono avvenire in qualsiasi fase della vita della proteina. Molte proteine sono modificate poco dopo il completamento della traduzione per mediare il corretto ripiegamento o per dirigere la proteina nascente verso luoghi cellulari distinti (come il nucleo o la membrana). Altre modifiche avvengono dopo che il ripiegamento e la localizzazione sono stati completati per attivare o inattivare l’attività catalitica. Le proteine sono anche legate covalentemente a tag che mirano alla degradazione della proteina. Sono modificate attraverso una combinazione di scissione post-traslazionale e l’aggiunta di gruppi funzionali attraverso un meccanismo graduale di maturazione o attivazione delle proteine.
Dove avviene la modifica post-traslazionale? Le PTM si verificano su catene laterali di aminoacidi o legami peptidici distinti e sono più spesso mediate dall’attività enzimatica. Infatti, il 5% del proteoma comprende enzimi che eseguono più di 200 tipi di PTM (4). Questi enzimi includono chinasi, fosfatasi, transferasi e ligasi, che aggiungono o rimuovono gruppi funzionali, proteine, lipidi o zuccheri da o verso le catene laterali degli aminoacidi, e le proteasi, che scindono i legami peptidici per rimuovere specifiche sequenze o subunità di regolazione. Molte proteine possono anche modificare se stesse usando domini autocatalitici, come l’autochinasi e i domini autoprotolitici. I PTM possono anche essere reversibili in base alla natura della modifica. Per esempio, le fosfatasi idrolizzano il gruppo fosfato per rimuoverlo dalla proteina e invertire la sua attività biologica (Figura 1).
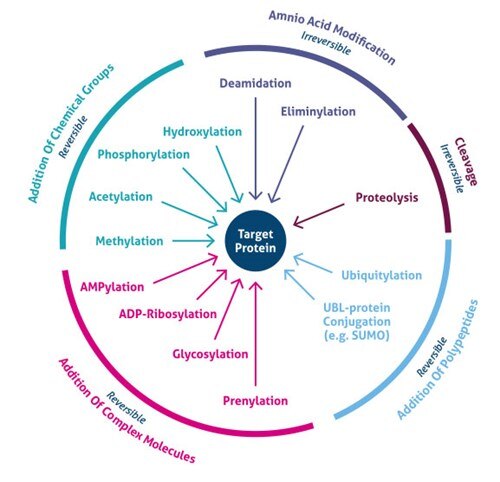
Figura 1. Tipi di modifiche post-traslazionali (PTM).
Modifiche post-traslazionali più comuni
I recenti sviluppi nei metodi di spettrometria di massa (MS) hanno permesso di identificare migliaia di siti PTM. Di conseguenza, nuove strategie di arricchimento hanno scoperto l’importanza cellulare globale di diversi tipi di modifiche (ad esempio, acetilazione, ubiquitylation, O-GlNac, glicosilazione N-linked). Attualmente sono noti più di 200 diversi tipi di PTM (5,6), che vanno dalle piccole modifiche chimiche (per esempio, fosforilazione e acetilazione) all’aggiunta di proteine complete (per esempio, ubiquitilazione, Figura 3).
Fosforilazione
La fosforilazione delle proteine (Figura 2) è la modifica post-traslazionale più comunemente studiata. È stato stimato che un terzo delle proteine dei mammiferi può essere fosforilato, e questa modifica gioca spesso un ruolo chiave nel modulare la funzione delle proteine. La fosforilazione avviene su residui di serina, treonina e tirosina, agendo per regolare la funzione proteica, l’attività enzimatica, le interazioni proteina-proteina e la localizzazione delle proteine. La fosforilazione è catalizzata dalle fosfatasi e può essere reversibile – le proteine fosforilate possono essere defosforilate dalle difosfatasi proteiche.
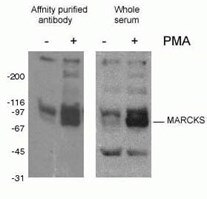
Figura 2. Risultato WB dell’anticorpo fosfo-Marcks (10018-3-AP, 1:1500) con cellule macrofagiche di topo J774 trattate con PMA.
Glicosilazione e Glicanazione
La maggior parte delle proteine che sono sintetizzate sui ribosomi associati al reticolo endoplasmatico subiscono la glicosilazione. Ciò significa che alla catena polipeptidica viene aggiunto un attacco covalente di società di zucchero. I due tipi più comuni di glicosilazione negli eucarioti sono la glicosilazione N-linked – all’asparagina, e la glicosilazione O-linked – alla serina e alla treonina.
Ubiquitinazione
L’ubiquitinazione delle proteine significa che un’ubiquitina covalente viene aggiunta alla lisina, cisteina, serina, treonina o direttamente all’N-terminale della proteina. L’ubiquitina è una piccola proteina (+/-8,6 kDa) espressa in quasi tutti i tipi di tessuto (Figura 3). L’ubiquitinazione è una reazione enzimatica catalizzata da una cascata di tre enzimi (E1, E2 ed E3). Questo fornisce la specificità del substrato e le fasi di attivazione, coniugazione e legatura. Le proteine possono essere monoubiquitinate (con una molecola di ubiquitina) o poliubiquitinate. La poliubiquitinazione avviene quando alla molecola di ubiquitina iniziale vengono aggiunte ulteriori molecole di ubiquitina. L’ubiquitinazione attraverso il proteoma può marcare le proteine per la degradazione. È anche importante per la segnalazione cellulare, l’internalizzazione delle proteine di membrana e lo sviluppo e la regolazione della trascrizione.

Figura 3. Le cellule MDA-MB-453s sono state sottoposte a SDS PAGE seguita da western blot con 10201-2-AP (anticorpo dell’ubiquitina) ad una diluizione di 1:600.
L’impatto dei PTM su salute e malattia
L’analisi delle proteine e dei loro PTM è particolarmente importante per lo studio delle malattie cardiache, del cancro, delle malattie neurodegenerative e del diabete (7). Le principali sfide nello studio delle proteine post-traslazionalmente modificate sono lo sviluppo di metodi di rilevamento e purificazione specifici. Fortunatamente, questi ostacoli tecnici vengono superati con una varietà di nuove e raffinate tecnologie di proteomica.
- Biologia chimica: proteine vestite.
- Concetti di sumoilazione: un decennio dopo.
- Analisi proteomica nelle neuroscienze.
- Il ruolo delle modifiche post-traslazionali nel contesto delle reti di interazione delle proteine
- Decifrare una rete globale di modifiche post-traslazionali funzionalmente associate.
- PTMcode: a database of known and predicted functional associations between post-translational modifications in proteins.
- Citrullination: a posttranslational modification in health and disease.
