THE ACID-BASE BEHAVIOUR OF AMINO ACIDS
This page looks at what happens to amino acids as you change the pH by adding either acids or alkalis to their solutions.
For simplicity, the page only looks at amino acids which contain a single -NH2 group and a single -COOH group.
Amino acids as zwitterions
Zwitterions in simple amino acid solutions
An amino acid has both a basic amine group and an acidic carboxylic acid group.
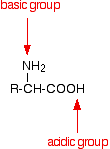
There is an internal transfer of a hydrogen ion from the -COOH group to the -NH2 group to leave an ion with both a negative charge and a positive charge.
This is called a zwitterion.

This is the form that amino acids exist in even in the solid state. Se si scioglie l’amminoacido in acqua, una soluzione semplice contiene anche questo ione.
Uno zwitterione è un composto senza carica elettrica complessiva, ma che contiene parti separate con carica positiva e negativa.
Aggiungere un alcali a una soluzione di amminoacido
Se si aumenta il pH di una soluzione di un amminoacido aggiungendo ioni idrossido, lo ione idrogeno viene rimosso dal gruppo -NH3+.
![]()

Si potrebbe dimostrare che l’amminoacido ora esiste come ione negativo usando l’elettroforesi.
Nella sua forma più semplice, l’elettroforesi può consistere semplicemente in un pezzo di carta da filtro inumidita su un vetrino da microscopio con una pinza a coccodrillo ad ogni estremità collegata ad una batteria. Una goccia di soluzione di aminoacido viene posta al centro della carta.
Anche se la soluzione di aminoacido è incolore, la sua posizione dopo un certo tempo può essere trovata spruzzandola con una soluzione di ninidrina. Se la carta viene lasciata asciugare e poi riscaldata delicatamente, l’aminoacido appare come una macchia colorata.
L’aminoacido si troverebbe a viaggiare verso l’anodo (l’elettrodo positivo).
Aggiungere un acido a una soluzione di aminoacido
Se si diminuisce il pH aggiungendo un acido a una soluzione di aminoacido, la parte -COO- dello zwitterione raccoglie uno ione idrogeno.
![]()
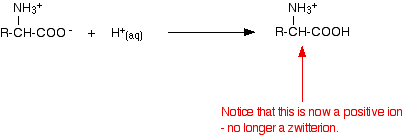
Questa volta, durante l’elettroforesi, l’aminoacido si sposterebbe verso il catodo (l’elettrodo negativo).
Spostamento del pH da un estremo all’altro
Supponiamo di iniziare con lo ione che abbiamo appena prodotto in condizioni acide e di aggiungervi lentamente degli alcali.
Questo ione contiene due idrogeni acidi – quello del gruppo -COOH e quello del gruppo -NH3+.
Il più acido di questi è quello nel gruppo -COOH, e quindi viene rimosso per primo – e si ritorna allo zwitterione.
![]()
![]()
Quindi, dopo aver aggiunto la giusta quantità di alcali, l’aminoacido non ha più una carica netta positiva o negativa. Ciò significa che non si muove verso il catodo o l’anodo durante l’elettroforesi.
Il pH al quale avviene questa mancanza di movimento durante l’elettroforesi è conosciuto come il punto isoelettrico dell’amminoacido. Questo pH varia da aminoacido ad aminoacido.
Se si continua ad aggiungere ioni idrossido, si ottiene la reazione che abbiamo già visto, in cui uno ione idrogeno viene rimosso dal gruppo -NH3+.
![]()
![]()