はじめに
間質性肺疾患は、肺実質の炎症性成分の存在を共通点とする極めて異質な疾患群を形成しており、最終的には線維化に発展し、機能面では、最終的に呼吸不全につながる制限的変化を引き起こします。
これらの疾患は、診断と管理が肺の専門領域で行われるものの、基本的には外来で治療が進められ、また、さまざまな合併症によって中断されることが多いことから、呼吸器合併症やその他の合併症によってこの種の問題を抱える患者から相談を受けることが多いため、主治医はこれらの疾患の治療のための現在のガイドラインを知っておくことが重要であると言えます。
このレビューの目的は、今日これらの患者さんに提供できる治療法を更新することです。
間質性疾患の中で、その頻度と重症度から最も関連性が高いのは特発性肺線維症(IPF)です。 一方、その治療法は、原因物質がわかっているものを除いて、ほとんどすべての疾患の治療の基礎となるモデルであり、その原因物質を除去することが治療の基本であるからだ。 そこで、IPFの管理に関する現行のガイドラインの見直しに焦点を当てます。
臨床的特徴
IPFはおそらく、びまん性間質性肺疾患の中で最も攻撃的なプロトタイプである。 その有病率は、著者によっては人口10万人あたり5例と推定されているが1、実際には不明である。 その病因は、免疫系の複雑な経路の変化と関連しています2,3。
最も多い臨床症状は乾性咳嗽を伴う遅発性呼吸困難であり、発作性で息苦しいため患者にとって最も煩わしい症状であると考えられます。 一般に、呼吸困難は初期には目立たず、早期診断のためには高い疑い指数が必要である。 時には、HammanとRichによる最初の記述のように、発症から数ヶ月で不可逆的な呼吸不全に至る急速な経過をたどることもある。
身体診察では、細かい乾いたクラック音(ベルクロ・ラーレ)が非常に特徴的で、80%以上の症例で聞くことができます。 進行すると、軽い労作時の呼吸困難や、唇のチアノーゼが見られることもあります。 30~50%程度でアクロパキアが見られる場合があります。 胸部X線検査やCT検査で網目模様、地中ガラス浸潤領域、肺活量減少などの徴候が現れると、IPFの疑いが強まる。 最後に、機能検査で拘束性パターンの存在を確認し、動脈血ガス分析で低酸素血症の存在を確認します。 疑わしい症例では、労作時の低酸素血症の証明が大きな価値を持つ。
診断の確定は、肺生検によってのみ行うことができる。 しかし、現実には、発表された多くのシリーズでも、組織学的診断のつかない症例が圧倒的に多い。 最近、米国胸部疾患学会(ATS)は、これらすべての基準が存在することは、薬剤、環境要素または結合組織疾患への曝露がない場合、肺生検が受け入れがたいリスクとなるケースにおいて、IPFの診断が最も可能性が高いことを意味すると提案しています4。
通常の間質性肺炎(UIP)は、これらの患者を特定する病理組織学パターンです4。 落屑性間質性肺炎、呼吸器細気管支炎に伴う間質性疾患、非特異的間質性肺炎、リンパ性間質性肺炎、急性間質性肺炎、組織化肺炎を伴う閉塞性気管支炎のパターンを持つものは、異なる疾患と考えられています
診断と重症度が確立すると、自然治癒がない致死性の疾患なのでほとんどの患者は治療が必要になります。 治療に対する反応が悪い。 5年生存率は50%5,2,6-8です。 治療には効果が出るまで3〜6ヶ月程度を要します。 これらの疾患の治療に関する報告は少なく、ほとんどが少数の患者を対象とした非対照の治療試験です9。
疾患の進行が不可避の陰湿で不可逆的であるにもかかわらず、治療のニヒリズムは正当化されません。 未治療のまま進行が遅く、治療に反応しない不可逆的な線維化に至る例や、急速な進行相を示す例もある。 いずれも発症時に治療が必要だと思われます。 しかし、治療が禁忌である患者さんや、機能障害が認められない患者さんは、3~6ヶ月間隔でフォローアッププログラムを行うことができます。 また、線維化優位の組織構造を持ち、重度の肺機能障害を有する高齢者の管理も困難である。 これらの患者さんには、可逆性を判断するために3〜6ヶ月の短期間の治療が行われます。
治療が望ましい効果を生むかどうかを判断するのは、しばしば困難です。 主観的な改善が見られることが多い(最大70%の患者さん)。 客観的な改善は20-30%に見られる。 機能的(客観的)な改善を定義するために最もよく使われるパラメータは、全肺活量(TLC)または生命維持能力(VC)の増加、拡散能力の増加、運動中のSaO2減少の減少または正常化です4、10-12。
治療
副腎皮質ホルモン
副腎皮質ホルモンはIPFの治療の柱ですが、その効果はかなり低く、良好な反応は患者の3分の1にしか起こりません。 その使用根拠は、慢性肺胞炎の抑制です。 免疫複合体の濃度を下げ、肺胞マクロファージの機能や内皮表面への好中球の接着を変化させることにより、肺における好中球やリンパ球の移動を抑制することで作用すると考えられています
なぜ反応のある患者とない患者がいるのかは明らかではありません。 肺実質細胞上の表面受容体の存在と関係があるのかもしれない。
しかし、最も広く使われている治療法であるにもかかわらず、その長期的な効果は、前向きな単盲検プラセボ対照試験で確認されていないのです。
Izumiらは222人の患者の生存率を分析し、10年後の生存率は、ステロイドを投与された患者と未投与の患者で差がないことを明らかにした13。 それでも、IPF患者が肺機能の低下や通常の生活を妨げる症状を示した場合、副腎皮質ステロイド治療の試みを開始することは合理的である。
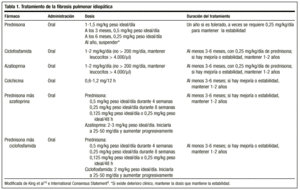
古典的な治療では、まずプレドニゾン1.5~2mg/kg理想体重/日を午前中に単回投与し、100mgを超えないようにします。 2-3ヶ月後、X線写真と機能検査で再評価される。 患者が反応した場合、プレドニゾンは0.5mg/kg理想体重/日の維持量まで漸減(1~2mg/週)し、その後は漸減することができる。 反応がない場合は、免疫抑制剤を追加します。 一般に、治療を中止することは考えにくく、通常、0.25mg/kg理想体重/日の投与量を維持することになります。
近年、アメリカおよびヨーロッパの胸部疾患学会では、この薬剤の副作用を避け、より良い生存率を得るために、プレドニゾンまたは同量の他のコルチコステロイドと免疫抑制剤(アザチオプリンまたはシクロホスファミド)の組み合わせで治療を開始することで合意に達しました4。 プレドニゾン 0.5mg/kg理想体重/日を4週間、0.25mg/kg理想体重/日を8週間、その後0.125mg/kg理想体重/日または0.25mg/kg理想体重/48時間へ漸減する。
治療期間についてのガイドラインはなく、最短でも1年です。 数ヶ月あるいは数年後に病気が再活性化する可能性があり、その場合は同じ薬剤による治療を開始する必要があります。 いずれにせよ、治療に対する反応は常に客観的な改善度で評価すべきであり、安定性を保証する用量で慢性的に患者を維持する可能性は、コルチコステロイドによる改善、漸減による悪化、再増量による新たな改善を認める場合に限っておくべきでしょう。 個々の患者さんに必要な投与量は、投与量の変化に対する反応によって、個別に判断するしかありません。 多くの著者は、生涯にわたる治療が必要であると考えています。14
初期に重症である場合、高用量のコルチコステロイドが提案されています。 Keoghらは、重症患者に対して間欠的な高用量非経口コルチコステロイドを使用している:メチルプレドニゾロン2gを週1回静脈内投与、プレドニゾン0.25mg/kg/dayを経口投与する。 その根拠は、低用量ステロイドよりも好中球性肺胞炎(予後不良と関連)に顕著な効果があるためです15。 しかし、この研究は、追跡期間が6ヶ月と短いこと、患者数が少ないこと、プレドニゾンの投与量が標準より少ないことなど、いくつかの欠点がある9。 初期治療として、副腎皮質ホルモンの大量静注療法(メチルプレドニゾロン250mg/6時間)が行われ、急速に進行する疾患を早期にコントロールする努力がなされています。
CITOTOXIC AGENTS
古典的に、コルチコステロイドが無効な場合、また、その副作用でそれ以上の投与が不可能な場合に、コルチコステロイドの代替物として使用されてきました。 副腎皮質ステロイドの場合と同様に,IPFの治療におけるその正確な役割を知ることができる長期前向き無作為化試験がないにもかかわらず,この記事の極めて実用的な精神に則り,臨床で有用であることが証明されている薬剤について検討することにする。
アザチオプリン
その作用機序は、デオキシリボ核酸合成におけるプリンの置換に基づき、アデニンデアミナーゼを阻害し、リンパ球を不活性化するものです。 その他、ナチュラルキラー細胞の活性抑制、抗体産生抑制、抗体依存性細胞傷害性などがあります。
推奨用量は2mg/kg/日、200mg/日を超えない範囲で、3~6ヶ月間投与します。
主な副作用は、白血球減少、貧血、血小板減少、赤血球無形成、汎血球減少などの血液学的なものです。 白血球数の推移を観察し、4,000/μlを下回ったら、再び上昇するまでアザチオプリンを中止する必要があります。 また、悪心・嘔吐、消化性潰瘍、下痢等の胃腸障害や軽度の肝酵素上昇があらわれることがあります。
Raghuらは、高用量のグルココルチコイドと低用量のグルココルチコイドと併用したアザチオプリンの効果を比較しました。
シクロホスファミド
アルキル化剤であり、呼吸機能パラメータのわずかな改善と生存期間の延長を伴う。 その作用機序は、リンパ球の枯渇であり、その結果、リンパ球の機能を抑制する。 推奨用量は2mg/kg/日単回経口投与で、通常は0.25mg/kg/日経口プレドニゾンと併用し、200mg/日を超えない範囲で少なくとも3ヶ月間、最大9~12ヶ月間考慮する。
最も重要な副作用は白血球減少である。 総白血球数が3,000/μl以上、または好中球数が1,500/μl以上を維持する必要があります。 その他の合併症には、血小板減少症、出血性膀胱炎による二次的な血尿、食欲不振、吐き気、嘔吐、骨髄抑制、無精子症、無月経、感染症、血液学的悪性腫瘍があります
Kolbらは、IPF患者18人を対象にパルスサイクロホスファミド療法の有効性と安全性について検討しました。 シクロホスファミドはプレドニゾロンの経口投与とともに間欠的に(1-1.3g/月)1年間投与されました。 この期間の後、シクロフォスファミドは中止され、達成された量のコルチコステロイドが継続された8 。 この患者を最低14ヶ月間追跡し、QoL、TLC、FEV1、CO移動量(DLCO)、SaO2、さらに症状をモニタリングした。 1 名は肺炎の再発により中止となった。 11名の患者が反応し(5名が改善、6名が安定)、6名が悪化したとされた。 シクロホスファミドの長期毒性は、累積投与量に依存する。 間欠投与は、連日投与と同様に有効であり、忍容性も優れている。 反応者はBAL中のリンパ球の割合が高かった。
BaughmanとLowerは33人のIPF患者に対し、1,000-1,800mgのシクロホスファミド/2週間を18ヶ月間投与した。 18ヶ月間生存した人は、VCFが有意に改善され、翌年も維持されました。
ペニシラミン
抗線維化剤です。 コラーゲン線維の分子内および分子間の共有結合の形成を阻害することにより、肺線維化の進展を抑制することが示唆されています。 肺線維症を伴う結合組織病の症例では、一定の効果があったとする報告もあるが、大規模な患者シリーズでの対照試験はなく、現状では有効な代替治療法とは言えない。
コルヒチン
コラーゲンの分泌を減少させ、コラーゲン分解活性を増加させる。 また、抗炎症作用もあります。 本疾患の治療におけるより正確な役割については研究が必要ですが、副腎皮質ホルモン剤と同様の効果があるとする研究もあり、その副作用も深刻ではありません。 副腎皮質ホルモン剤に抵抗性の患者には、1日1回または2回、0.6mgの投与が推奨されます(単独投与または免疫抑制剤との併用)。
PULMONARY TRANSPLANT
治療に反応せず進行し呼吸不全に至るケースは残念ながら本疾患の中でも最も多くなっています。 これらの患者さんには、現在、緩和以外の医学的治療の見込みはありません。 このような暗い背景の中、1980年代に肺移植の可能性が浮上し、現在では実験分野にとどまらず、臨床でも考慮すべき治療法の選択肢となるまでに発展してきたのです。 最も適した適応症は、65歳未満で、他の臓器に進行性かつ不可逆的な疾患がなく、未解決の活動性感染症や多耐性細菌による感染症がある人です。 また、個人の素質や栄養状態も十分であることが必要です。 CPTが期待値の60%未満、または肺拡散能が40%未満の患者さんの生存期間は2年未満です。 この程度の機能障害では、酸素療法を必要とし、最小限の運動で容易に脱飽和する。 このようなケースでは、酸素療法が必要になり、病気の進行が止まらないことが確認された時点で、肺移植を検討する必要があります。 移植の種類は片肺移植が選択され、両肺移植は残存肺の挙動に疑問がある場合に留保される。 50歳未満で右心不全の場合、心肺移植が検討されることがあります。 しかし、このような場合、病状はかなり進行しており、待機に耐えられるとは思えません18,19。 移植後の生存率は、最初の1年で80%、5年で50~60%と予想されており、呼吸不全に至ったIPF患者の予後を大幅に改善します。
治療に対する反応の評価
合併症がない場合、治療に対する反応が得られるまで最大6ヶ月かかることがあります。 この後、患者が改善または安定している場合は、同じ用量を維持する。 悪化している場合は、代替療法(別の免疫抑制剤、あるいは移植)に切り替える必要があります。 12ヶ月後には同様に再評価し、18ヶ月後には反応に応じて個別に評価する必要があります。 Se recomienda continuar indefinidamente sólo en aquellos pacientes con mejoría continua o estabilización (tabla 2).

Una respuesta favorable se define por dos o más de los siguientes criterios en dos visitas consecutivas:
1. Mejoría de los síntomas, sobre todo en el grado de esfuerzo requerido para que el paciente deba parar cuando hace un esfuerzo o un descenso en la frecuencia o gravedad de la tos.
2. Reducción de las alteraciones radiológicas.
3. Mejoría funcional definida por dos o más de los siguientes parámetros:
Aumento >= 10% en la TLC o CV (o >= 200 ml).
Aumento >= 15% en DLCO o >= 3 ml/min/mmHg.
Mejoría o normalización de la SaO2 o pO2 (aumento >= 4% o >= 4 mmHg) durante un prueba de esfuerzo cardiorrespiratoria.
Una respuesta estable (también considerada favorable) se define por dos o más de los siguientes criterios en dos visitas consecutivas:
1. Cambio de
2. Cambio de
3. Sin cambios en la SaO2 o pO2 (aumento
Un fracaso del tratamiento se define por dos o más de los siguientes criterios en dos visitas consecutivas:
1. Aumento de los síntomas, sobre todo disnea o tos.
2. Aumento de las alteraciones radiológicas, especialmente imágenes en panal o signos de hipertensión pulmonar.
3. Deterioro funcional definido por dos o más de los siguientes parámetros:
Descenso >= 10% en la TLC o CV (o >= 200 ml).
Descenso >= 15% en DLCO o >= 3 ml/min/mmHg.
安静時または心肺負荷試験時のSaO2の悪化(>= 4%)または肺胞-動脈間濃度(AapO2)の上昇(>= 4 mmHg)です。
結論
特発性肺線維症は、自然寛解がなく、治療への反応が悪い致死的な疾患である。 後者に関する研究は少なく、患者数も少ない。 副腎皮質ステロイドを様々な用量で最低1年間維持することが、単独または他の免疫抑制剤との併用で最も受け入れられているレジメンである。 最近では、米国胸部疾患学会や欧州呼吸器学会で併用療法が提唱されています4 。 抗線維化剤は、多くの患者さんが末期に診断されることから、線維化過程の定着、つまり不可逆的な状態を防ぐことを意図して研究されています。 生存率や経過を考えると、治療がうまくいかず酸素療法が必要な患者さんには、すぐに肺移植を検討すべきです。 これらのことから、投与された治療法の有効性を評価するとともに、本疾患の自然史や実際の発症率および有病率を明らかにするために、十分な数の患者を募集する多施設共同研究を確立する必要性が示唆されます4,20。 一方、より高い生存率を得るためには、早期に発見し、治療を開始することが推奨されます。