遺伝子の監禁からの自然の脱出
翻訳後修飾。 A brief overview
翻訳後修飾はどのように行われるのか
最も一般的な翻訳後修飾
健康と病気に対する翻訳後修飾の影響
A brief overview
PTMとは何か?
細胞は内部および外部の条件の変化を検出し、それに反応する必要がある。 これらの変化に適応するために用いられる方法の1つが、タンパク質を化学的に修飾することです。 条件付きの化学変化は、タンパク質の可逆的な翻訳後修飾(PTM)を介して、センサーからエフェクターに中継されます。 PTMは、細胞分化(1)、タンパク質分解、シグナル伝達および調節プロセス、遺伝子発現の調節、タンパク質間相互作用(2,3)など、多くの細胞プロセスで重要な役割を果たし、発現の最終産物を変更する上で重要な役割を担っており、生体プロセスや病的状態に貢献しています。
PTMはタンパク質の寿命のどの段階でも起こり得ます。 多くのタンパク質は、翻訳が完了した直後に、適切なフォールディングを仲介したり、新生タンパク質を細胞内の明確な場所(核や膜など)に誘導したりするために修飾される。 その他の修飾は、フォールディングと局在化が完了した後に、触媒活性を活性化または不活性化するために行われる。 タンパク質はまた、分解を目的としたタグと共有結合する。
翻訳後修飾はどこで起こるのですか? 翻訳後修飾は、異なるアミノ酸側鎖またはペプチド結合で起こり、ほとんどの場合、酵素活性によって媒介されます。 実際、プロテオームの5%は、200種類以上の修飾を行う酵素で構成されています(4)。 これらの酵素には、アミノ酸側鎖に官能基、タンパク質、脂質、糖を付加・除去するキナーゼ、ホスファターゼ、トランスフェラーゼ、リガーゼや、ペプチド結合を切断して特定の配列や制御サブユニットを除去するプロテアーゼが含まれる。 また、多くのタンパク質は、オートキナーゼやオートプロトリティックドメインなどの自己触媒ドメインを用いて自身を修飾することもできる。 修飾の性質により、PTMは可逆的であることもある。 例として、ホスファターゼはリン酸基を加水分解してタンパク質から取り除き、生物活性を逆転させる(図1)。
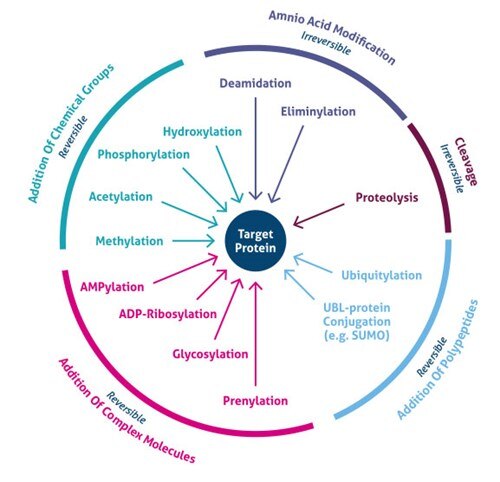
図1. 翻訳後修飾(PTM)の種類
最も一般的な翻訳後修飾
質量分析(MS)法の最近の発展により、何千ものPTM部位の同定が可能になりました。 その結果、新しい濃縮戦略によって、いくつかのタイプの修飾 (たとえば、アセチル化、ユビキチン化、O-GlNac、N-結合型グリコシル化) のグローバルな細胞での重要性が明らかにされました。 現在、200以上の多様なタイプのPTMが知られており(5,6)、小さな化学修飾(例えば、リン酸化やアセチル化)から完全なタンパク質の付加(例えば、ユビキチン化、図3)まである。
タンパク質のリン酸化(図2)は最もよく研究されている翻訳後修飾である。 哺乳類タンパク質の3分の1はリン酸化されていると推定され、この修飾はしばしばタンパク質の機能を調節する上で重要な役割を担っている。 リン酸化はセリン、スレオニン、チロシン残基上で起こり、タンパク質の機能、酵素活性、タンパク質間相互作用、タンパク質の局在を制御するように作用している。 リン酸化はホスファターゼによって触媒され、リン酸化されたタンパク質はタンパク質脱リン酸化酵素によって脱リン酸化されるという可逆性がある。
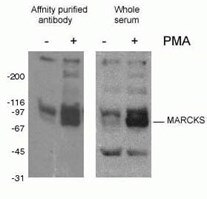
図2. phospho-Marcks 抗体 (10018-3-AP, 1:1500) の WB 結果。PMA で処理したマウス J774 マクロファージ細胞。
グリコシレーションと糖鎖付加
小胞体に付随するリボソーム上で合成されたタンパク質の大部分は、グリコシル化を受ける。 つまり、ポリペプチド鎖に糖の部位が共有結合で付加されるのである。 真核生物において最も一般的なグリコシレーションは、N-結合型グリコシレーション(アスパラギンへの結合)とO-結合型グリコシレーション(セリンとスレオニンへの結合)の2種類である。
ユビキチン化
タンパク質のユビキチン化とは、リジン、システイン、セリン、スレオニン、または直接タンパク質のN末端に共有結合でユビキチンが付加されることを指します。 ユビキチンは小さな(+/-8.6 kDa)タンパク質で、ほとんど全ての組織型に発現しています(図3)。 ユビキチン化は、3つの酵素カスケード(E1、E2、E3)により触媒される酵素反応である。 そのため、基質特異性と活性化、コンジュゲーション、ライゲーションの段階が提供される。 タンパク質は、モノユビキチン化(ユビキチン分子1個で)されることもあれば、ポリユビキチン化されることもある。 ポリユビキチン化は、最初のユビキチン分子にさらにユビキチン分子が付加されることで行われる。 プロテオームを介したユビキチン化は、タンパク質を分解のためにマークすることができる。 また、細胞内シグナル伝達、膜タンパク質の内在化、そして転写の発達と制御にも重要です。

図3. MDA-MB-453s細胞をSDS PAGEにかけた後、1:600の希釈度で10201-2-AP(ユビキチン抗体)を用いてウェスタンブロットを行いました。
PTMs impact on health and disease
タンパク質とそのPTMの分析は、心臓病、癌、神経変性疾患、糖尿病の研究において特に重要です (7). 翻訳後修飾タンパク質の研究における主な課題は、特異的な検出法と精製法の開発である。 幸い、こうした技術的な障害は、新しく洗練されたさまざまなプロテオミクス技術によって克服されつつある。
- ケミカルバイオロジー:ドレスアップしたタンパク質
- スモイル化の概念:10年の歩み
- Proteomic analysis in the neurosciences.
- タンパク質相互作用ネットワークの文脈における翻訳後修飾の役割
- 機能的に関連する翻訳後修飾のグローバルネットワークを読み解く
- 翻訳後修飾は、タンパク質と相互作用する。
- PTMcode: a database of known and predicted functional associations between post-translational modifications in proteins.
- Citrullination: a posttranslational modification in health and disease.
