Un electrolit este un compus chimic care se disociază în ioni și, prin urmare, este capabil să transporte sarcină electrică – adică un electrolit este un conductor electric; spre deosebire de metale, fluxul de sarcină nu este un flux de electroni, ci o mișcare de ioni.
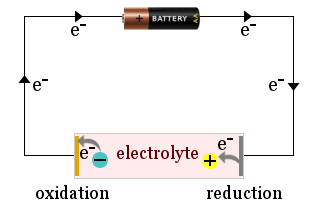
De exemplu, diagrama arată cum o baterie domestică este folosită pentru a atrage ionii electrolitului către electrozii unei celule electrochimice, unde ionii câștigă electroni (sunt reduși) sau pierd electroni (sunt oxidați).
Câteodată electrozii înșiși reacționează, de exemplu un electrod metalic ar putea fi oxidat și ar putea elibera ioni în electrolit.
Electroliții pot fi solizi, lichizi sau soluții.
Exemple de electroliți
1. Clorura de sodiu topită acționează ca un electrolit în producția de sodiu metalic. Se produce, de asemenea, clor gazos.
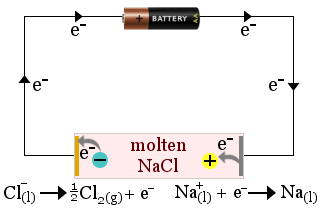 În acest caz, electrolitul este consumat de reacțiile redox ale celulei.
În acest caz, electrolitul este consumat de reacțiile redox ale celulei.
2. Hidroxidul de potasiu dizolvat în apă produce un electrolit foarte conductiv în celula Edison, o primă celulă reîncărcabilă.
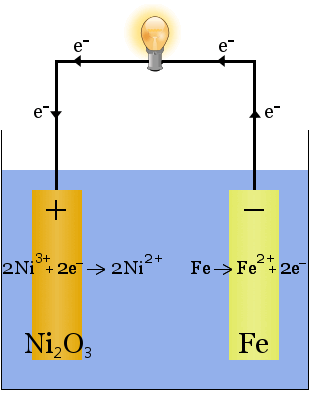
Spre deosebire de cazul producerii de sodiu de mai sus, în această reacție nu se consumă niciun electrolit. în acest caz, rolul hidroxidului de potasiu este de a crește disponibilitatea ionilor pentru a crește conductivitatea electrolitului și a completa circuitul electric.
Ecuațiile chimice pentru reacțiile de la electrozi sunt:
Pentru descărcare ecuațiile se citesc de la stânga la dreapta; pentru încărcare de la dreapta la stânga.
3. În mod tradițional, electroliții erau lichide pentru a permite mișcarea ionilor. cu toate acestea, acum sunt disponibile materiale solide care permit ionilor să se deplaseze cu ușurință prin structurile lor. electroliții solizi sunt de dorit în multe produse de consum, deoarece nu prezintă scurgeri.
Sulfura de fosfor de staniu și litiu, Li10SnP2S12, este un electrolit solid pentru utilizarea în bateriile cu ioni de litiu.Structura cristalină a electrolitului solid combinată cu interacțiunea slabă cu ionii de litiu oferă un mediu prin care ionii de litiu pot sări cu ușurință.
4. Electroliții sunt extrem de importanți pentru procesele electrochimice din organismele vii.Principalii ioni din acești electroliți sunt calciul (Ca2+), magneziul (Mg2+), sodiul (Na+), potasiul (K+), clorura (Cl-), carbonatul de hidrogen (HCO3-) și fosfatul de hidrogen (HPO42-).
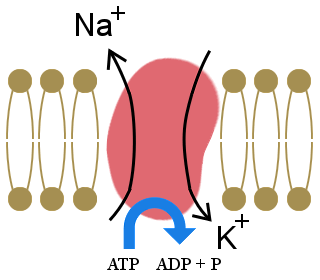
The importance of the sodium-potassium pump, shown in the diagram, to our lives is illustrated by the fact that it uses one-third of our resting energy.The pump maintains our cells’ electrolyte balance, with excess potassium ions inside cells and excess sodium ions outside cells.
This concentration gradient creates a voltage across the cell wall, which allows electrical signals to be transmitted in neurons and in muscles.It also provides the energy for processes in cell-membranes.
