THE ACID-BASE BEHAVIOUR OF AMINO ACIDS
This page looks at what happens to amino acids as you change the pH by adding either acids or alkalis to their solutions.
For simplicity, the page only looks at amino acids which contain a single -NH2 group and a single -COOH group.
Amino acids as zwitterions
Zwitterions in simple amino acid solutions
An amino acid has both a basic amine group and an acidic carboxylic acid group.
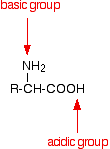
There is an internal transfer of a hydrogen ion from the -COOH group to the -NH2 group to leave an ion with both a negative charge and a positive charge.
This is called a zwitterion.

This is the form that amino acids exist in even in the solid state. Dacă dizolvați aminoacidul în apă, o soluție simplă conține și acest ion.
Un zwitterion este un compus fără sarcină electrică globală, dar care conține părți separate care sunt încărcate pozitiv și negativ.
Adăugarea unui alcalin la o soluție de aminoacid
Dacă măriți pH-ul unei soluții de aminoacid prin adăugarea de ioni de hidroxid, ionul de hidrogen este eliminat din gruparea -NH3+.
![]()

Ați putea arăta că aminoacidul exista acum sub formă de ion negativ folosind electroforeza.
În forma sa cea mai simplă, electroforeza poate consta doar dintr-o bucată de hârtie de filtru umezită pe o lamelă de microscop cu o clemă de crocodil la fiecare capăt atașată la o baterie. O picătură de soluție de aminoacizi este plasată în centrul hârtiei.
Deși soluția de aminoacizi este incoloră, poziția acesteia după un timp poate fi găsită prin pulverizarea ei cu o soluție de ninhidrină. Dacă hârtia este lăsată să se usuce și apoi încălzită ușor, aminoacidul apare ca o pată colorată.
Se va constata că aminoacidul se deplasează spre anod (electrodul pozitiv).
Adăugarea unui acid la o soluție de aminoacid
Dacă scădeți pH-ul prin adăugarea unui acid la o soluție de aminoacid, partea -COO- a zwitterionului captează un ion de hidrogen.
![]()
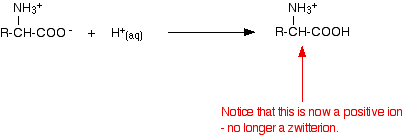
De data aceasta, în timpul electroforezei, aminoacidul s-ar deplasa spre catod (electrodul negativ).
Schimbarea pH-ului de la o extremă la alta
Să presupunem că începeți cu ionul pe care tocmai l-am produs în condiții acide și că îi adăugați încet un alcalin.
Acest ion conține doi hidrogeni acizi – cel din grupa -COOH și cel din grupa -NH3+.
Cel mai acid dintre aceștia este cel din grupa -COOH, așa că acesta este eliminat primul – și se ajunge din nou la zwitterion.
![]()
![]()
Atunci când ați adăugat cantitatea potrivită de alcalin, aminoacidul nu mai are o sarcină netă pozitivă sau negativă. Asta înseamnă că nu s-ar mai deplasa nici spre catod, nici spre anod în timpul electroforezei.
Ph-ul la care se produce această lipsă de mișcare în timpul electroforezei este cunoscut sub numele de punctul izoelectric al aminoacidului. Acest pH variază de la un aminoacid la altul.
Dacă veți continua să adăugați ioni de hidroxid, veți obține reacția pe care am văzut-o deja, în care un ion de hidrogen este eliminat din gruparea -NH3+.
![]()
![]()