INTRODUCERE
Bolile pulmonare interstițiale formează un grup extrem de eterogen de afecțiuni care au în comun existența unei componente inflamatorii a parenchimului pulmonar care poate evolua în cele din urmă spre fibroză și care determină, din punct de vedere funcțional, o alterare restrictivă care poate duce în cele din urmă la insuficiență respiratorie.
Chiar dacă acestea sunt boli al căror diagnostic și management se realizează în domeniul specializat al pneumologiei, tratamentul este urmat în mod fundamental în regim ambulatoriu, iar având în vedere că acesta poate fi și de multe ori este punctat de diverse complicații, este important ca medicul de familie să cunoască ghidurile actuale de tratament al acestor boli, deoarece de multe ori va fi consultat de pacienți cu acest tip de problemă, fie că este vorba de complicații respiratorii, fie de alte tipuri de complicații.
Scopul acestei analize este de a actualiza modalitățile terapeutice care pot fi oferite astăzi acestor pacienți. Considerăm că este extrem de important nu numai ca medicul de familie să aibă cunoștințe actualizate despre acest subiect, ci și să colaboreze cu medicul pneumolog pentru a obține o bună complianță la tratamentul pacientului, precum și pentru depistarea și tratarea precoce a oricăror complicații care pot apărea.
Printre bolile interstițiale, cea mai relevantă, datorită frecvenței și gravității sale, este fibroza pulmonară idiopatică (FPI). Pe de altă parte, tratamentul său este modelul pe care se bazează tratamentul aproape tuturor acestor boli, cu excepția celor în care se poate găsi un agent etiologic cunoscut, deoarece în acestea eliminarea acestui agent va fi baza fundamentală a terapiei. Prin urmare, ne vom concentra asupra unei revizuiri a ghidurilor actuale pentru managementul FPI. Vom trece mai întâi în revistă pe scurt caracteristicile sale clinice și apoi vom dezvolta în detaliu managementul actual al FPI.
DESCRIERE CLINICĂ
FPI reprezintă probabil cel mai agresiv prototip al pneumopatiilor interstițiale difuze. Prevalența sa a fost estimată de unii autori la 5 cazuri la 100.000 de locuitori1, deși în realitate este necunoscută. Patogenia sa este legată de alterări ale căilor complexe ale sistemului imunitar2,3. 2,3 Din acest motiv, majoritatea medicamentelor utilizate sunt agenți imunosupresori.
Cea mai frecventă prezentare clinică este dispneea cu debut insidios, însoțită de tuse uscată, care poate fi cel mai deranjant simptom pentru pacient datorită naturii sale paroxistice și fără respirație. În general, dispneea este inițial nesemnificativă și este necesar un indice ridicat de suspiciune pentru un diagnostic precoce. Ocazional, evoluția este rapidă de la debut și duce în câteva luni la insuficiență respiratorie ireversibilă, așa cum a fost caracteristic în descrierile inițiale ale lui Hamman și Rich. Cu toate acestea, cel mai frecvent, afecțiunea este prezentă de luni de zile în momentul în care pacientul face prima vizită.
La examenul fizic, crepitațiile fine și uscate (raluri velcro) sunt foarte caracteristice și pot fi auzite în peste 80% din cazuri. În cazurile avansate, se poate observa dispnee la efort ușor sau chiar cianoză labială. Acropaziile pot fi observate în aproximativ 30-50% din cazuri. Suspiciunea de FPI este întărită atunci când pe radiografia toracică și pe tomografia computerizată apar semne cum ar fi modelul reticular, zone de infiltrație de sticlă măcinată și scăderea volumului pulmonar. În cele din urmă, examenul funcțional va confirma existența unui model restrictiv, iar analiza gazelor din sângele arterial va confirma existența hipoxemiei. În cazurile îndoielnice, demonstrarea hipoxemiei la efort este de mare valoare.
Confirmarea definitivă a diagnosticului poate fi făcută doar prin biopsie pulmonară. Cu toate acestea, realitatea este că, chiar și în multe dintre seriile publicate, predomină cazurile fără diagnostic histologic. Recent, American Thoracic Society (ATS) a propus ca existența tuturor acestor criterii să însemne că, în absența expunerii la medicamente, elemente de mediu sau boli ale țesutului conjunctiv, diagnosticul de FPI poate fi cel mai probabil pus în absența biopsiei pulmonare4 în cazurile în care biopsia pulmonară ar reprezenta un risc inacceptabil.
Pneumonia interstițială obișnuită (PUI) este tiparul histopatologic care identifică acești pacienți4. Cele cu patternuri de pneumonie interstițială descuamativă, boală interstițială asociată cu bronșiolită respiratorie, pneumonie interstițială nespecifică, pneumonie interstițială limfoidă, pneumonie interstițială acută și bronșiolită obliterantă cu pneumonie organizatoare sunt considerate entități diferite.
După ce diagnosticul și gravitatea clinică sunt stabilite, majoritatea pacienților necesită tratament, deoarece este o boală fatală fără remisiune spontană. Răspunsul la tratament este slab. Supraviețuirea la cinci ani este de 50%5,2,6-8. Tratamentul necesită aproximativ 3-6 luni înainte de a se stabili eficiența. Rapoartele privind tratamentul acestor boli sunt rare: studii terapeutice necontrolate care implică, în cea mai mare parte, un număr mic de pacienți9.
În ciuda progresiei inevitabile insidioase și ireversibile a bolii, nihilismul terapeutic nu este justificat. Există exemple de fibroză netratată cu progresie lentă care duce la o fibroză ireversibilă care nu răspunde la tratament sau care dezvoltă o fază rapid progresivă. Toate necesită probabil tratament în momentul prezentării. Cu toate acestea, acei pacienți cu contraindicații la tratament sau cei care nu prezintă dovezi de afectare funcțională pot urma un program de urmărire la intervale de 3-6 luni. Gestionarea pacienților vârstnici cu histologie predominantă de fibroză și afectare severă a funcției pulmonare este, de asemenea, dificilă. Acești pacienți primesc un tratament scurt de 3-6 luni pentru a determina reversibilitatea. Puțini dintre ei vor avea un răspuns pozitiv.
Este adesea dificil de determinat dacă tratamentul produce efectul dorit. Adesea apare o ameliorare subiectivă (la până la 70% dintre pacienți). Îmbunătățirea obiectivă apare în 20-30%. Parametrii cel mai frecvent utilizați pentru a defini îmbunătățirea funcțională (obiectivă) sunt o creștere a capacității pulmonare totale (TLC) sau a capacității vitale (VC), o creștere a capacității de difuzie și o reducere sau o normalizare a scăderii SaO2 în timpul efortului4,10-12.
TRATAMENT
Corticosteroizii
Corticosteroizii sunt pilonul principal al tratamentului pentru FPI, deși succesul lor este destul de slab: un răspuns favorabil apare la o treime dintre pacienți. Motivația pentru utilizarea lor este de a suprima alveolita cronică. Se crede că acestea acționează prin suprimarea migrației neutrofilelor și limfocitelor în plămâni, prin scăderea concentrației de imunocomplecși, prin modificarea funcției macrofagelor alveolare și a adeziunii neutrofilelor la suprafețele endoteliale.
Nu este clar de ce unii pacienți răspund și alții nu. Aceasta poate fi legată de prezența unor receptori de suprafață pe celulele parenchimatoase pulmonare. O evoluție scurtă a simptomelor, o afectare funcțională și radiologică ușoară, sexul feminin și vârsta mai tânără a pacienților par să fie asociate cu un rezultat mai bun.
Cu toate acestea, în ciuda faptului că este cel mai utilizat tratament pe scară largă, performanța sa pe termen lung nu a fost confirmată de niciun studiu prospectiv, simplu-orb, controlat cu placebo.
Izumi et al. au analizat supraviețuirea a 222 de pacienți și au constatat că la 10 ani nu a existat nicio diferență de supraviețuire între cei care au primit steroizi în comparație cu pacienții netratați13. Cu toate acestea, atunci când un pacient cu FPI prezintă o afectare a funcției pulmonare sau simptome care interferează cu viața normală, este rezonabil să se inițieze o încercare de terapie cu corticosteroizi. De fapt, ameliorarea spontană a bolii este foarte rară, iar dacă se decide întârzierea inițierii tratamentului trebuie să se facă în detrimentul unei monitorizări atente a pacientului, astfel încât tratamentul să poată fi inițiat de îndată ce deteriorarea este evidentă.
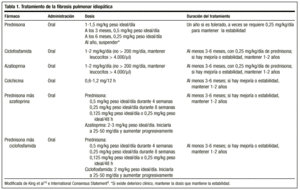
Tratamentul clasic începe cu prednison 1,5-2 mg/kg greutate ideală/zi în doză unică dimineața, fără a se depăși o doză de 100 mg. După 2-3 luni, pacientul este reevaluat cu radiografie și studiu funcțional. Dacă pacientul răspunde, prednisonul este diminuat (1-2 mg/săptămână) până la o doză de întreținere de 0,5 mg/kg greutate ideală/zi, care poate fi redusă ulterior. Dacă nu există un răspuns, se adaugă un medicament imunosupresor. În general, este puțin probabil ca tratamentul să poată fi oprit, iar dozele de 0,25 mg/kg greutate ideală/zi sunt de obicei menținute.
Recent, Societățile toracice americană și europeană, pentru a evita efectele secundare ale acestui medicament și pentru a obține rate de supraviețuire mai bune, au ajuns la un consens pentru a începe tratamentul cu o combinație de prednison sau un alt corticosteroid în doze echivalente și un imunosupresor (azatioprină sau ciclofosfamidă)4: prednison 0,5 mg/kg de greutate ideală/zi timp de 4 săptămâni; 0,25 mg/kg de greutate ideală/zi timp de 8 săptămâni, iar apoi reducerea treptată la 0,125 mg/kg de greutate ideală/zi sau 0,25 mg/kg de greutate ideală/48 h.
Nu există orientări privind durata tratamentului; perioada minimă este de un an. Este posibil ca, după luni sau ani, boala să se reactiveze, caz în care trebuie inițiat un tratament cu aceiași agenți. În orice caz, răspunsul la tratament trebuie să fie întotdeauna evaluat în termeni de ameliorare obiectivă, iar posibilitatea de a menține pacientul în mod cronic cu o doză care garantează stabilitatea trebuie rezervată acelor cazuri în care există o ameliorare cu corticosteroizi, o deteriorare la reducerea treptată și o nouă ameliorare la o nouă creștere a dozei. Doza necesară pentru fiecare pacient poate fi determinată doar de la caz la caz, în funcție de răspunsul la modificarea dozei. Mulți autori consideră că este necesar un tratament pe toată durata vieții.14
Când boala este inițial severă, au fost propuse doze mari de corticosteroizi. Keogh și colab. au utilizat corticosteroizi parenterali intermitenți în doze mari la pacienții cu boală severă: metilprednisolon intravenos, 2 g o dată pe săptămână, plus prednison oral, 0,25 mg/kg/zi. Raționamentul este că acestea au un efect mai pronunțat asupra alveolitei neutrofilice (asociată cu un prognostic nefavorabil) decât steroizii în doze mici15. Cu toate acestea, această lucrare suferă de unele deficiențe, cum ar fi urmărirea scurtă de 6 luni, numărul mic de pacienți și dozele de prednison mai mici decât cele standard9. Tratamentul inițial cu doze mari de corticosteroizi intravenoși (metilprednisolon 250 mg/6 h) a fost utilizat în efortul de a controla boala cât mai devreme posibil atunci când aceasta este rapid progresivă. Nu există studii controlate care să stabilească dacă aceste metode sunt eficiente; cu toate acestea, dozele mai mari par să aibă o eficacitate mai mare, deși efectele secundare sunt, de asemenea, mai mari.14.
AGENȚI CITOTOXICI
Au fost utilizați în mod clasic ca o alternativă la corticosteroizi atunci când aceștia erau ineficienți și, de asemenea, atunci când efectele secundare ale acestora exclud administrarea lor în continuare. În conformitate cu spiritul eminamente practic al acestui articol, vom trece în revistă acei agenți care s-au dovedit a fi utili în practica clinică, deși, ca și în cazul corticosteroizilor, nu dispunem de serii lungi, prospective și randomizate care să ne permită să știm cu exactitate care este rolul lor exact în tratamentul FPI.
Azathioprină
Mecanismul său de acțiune se bazează pe substituirea purinelor în sinteza acidului dezoxiribonucleic, inhibând astfel adenina deaminaza și inactivând limfocitele. Alte efecte includ suprimarea activității celulelor natural killer, a producției de anticorpi și a citotoxicității celulare dependente de anticorpi.
Doza recomandată este de 2 mg/kg/zi, fără a depăși 200 mg/zi, pentru o perioadă de 3-6 luni. Administrarea se inițiază la o doză de 50 mg/zi și, dacă este bine tolerată, doza este crescută la intervale de 1 până la 2 săptămâni până la atingerea dozei planificate.
Principalele reacții adverse sunt hematologice: leucopenie, anemie, trombocitopenie, aplasie de globule roșii și pancitopenie. Este necesar să se monitorizeze numărul de leucocite, iar dacă acesta scade sub 4.000/μl, azatioprina trebuie întreruptă până când această cifră crește din nou. În plus, pot apărea disconfort gastrointestinal, cum ar fi greață și vărsături, ulcer peptic, diaree și o ușoară creștere a enzimelor hepatice. În general, în până la 20-30% din cazuri, efectele secundare necesită retragerea azatioprinei.
Raghu et al au comparat eficacitatea glucocorticoizilor în doze mari față de azatioprină în combinație cu glucocorticoizi în doze mici. Utilizarea acestui medicament a fost însoțită de o îmbunătățire modestă a parametrilor funcției respiratorii și de creșterea supraviețuirii17.
Ciclofosfamida
Este un agent alchilant. Modul său de acțiune este depleția limfocitelor și, prin urmare, suprimă funcția limfocitelor. Doza recomandată este de 2 mg/kg/zi, unică, pe cale orală, de obicei luată în considerare cu 0,25 mg/kg/zi de prednison pe cale orală, fără a se depăși 200 mg/zi timp de cel puțin 3 luni și până la 9-12 luni.
Cel mai important efect secundar este leucopenia. Trebuie să se mențină un număr total de leucocite mai mare de 3.000/μl sau un număr de neutrofile mai mare de 1.500/μl. Alte complicații includ trombocitopenie, hematurie secundară cistitei hemoragice, anorexie, greață și vărsături, suprimarea măduvei osoase, azoospermie și amenoree, infecție și malignitate hematologică.
Kolb și colab. au studiat 18 pacienți cu FPI pentru a determina eficacitatea și siguranța tratamentului cu ciclofosfamidă pulsată. Ciclofosfamida a fost administrată intermitent (1-1,3 g/lună) împreună cu prednisolon oral timp de un an. După această perioadă, ciclofosfamida a fost întreruptă și au fost continuate dozele obținute de corticosteroizi8 . Aceștia au fost urmăriți timp de cel puțin 14 luni, monitorizându-se QoL, TLC, FEV1, capacitatea de transfer de CO (DLCO), SaO2, precum și simptomele. Un pacient a trebuit să fie întrerupt din cauza pneumoniilor recurente; 11 pacienți au fost considerați respondenți (5 s-au ameliorat și 6 s-au stabilizat) și 6 s-au deteriorat. Toxicitatea pe termen lung a ciclofosfamidei depinde de dozele cumulate. Dozele intermitente sunt la fel de eficiente și mai bine tolerate decât cele zilnice. Respondenții au avut un procent mai mare de limfocite în BAL. O altă constatare demnă de luat în seamă este că QOL inițială a respondenților a fost semnificativ mai bună datorită unui timp mai scurt până la progresie, sugerând că acest tratament ar trebui început devreme.
Baughman și Lower au tratat 33 de pacienți cu FPI cu 1.000-1.800 mg de ciclofosfamidă/2 săptămâni timp de 18 luni. Cei care au supraviețuit 18 luni au avut o îmbunătățire semnificativă a VCF care s-a menținut în anul următor. Reducerea prednisolonei a fost posibilă de la 32 la 4 mg/zi16.
Penicilamina
Agent antifibrosant. S-a sugerat că, prin interferența cu formarea legăturilor covalente intra- și intermoleculare ale fibrelor de colagen, inhibă dezvoltarea fibrozei pulmonare. Au fost descrise unele cazuri de boli ale țesutului conjunctiv cu fibroză pulmonară asociată în care a avut o anumită eficacitate, dar nu există studii controlate pe serii mari de pacienți, astfel încât nu poate fi considerat în prezent ca un tratament alternativ valabil. Sunt necesare studii suplimentare înainte de a se putea face o recomandare.
Colchicina
Diminuează secreția de colagen și crește activitatea colagenolitică. De asemenea, are un efect antiinflamator. Sunt necesare studii pentru a determina mai precis rolul său în tratamentul acestei boli, dar există studii în care i s-a atribuit o eficacitate similară cu cea a corticosteroizilor, iar efectele sale secundare nu sunt grave. Se recomandă în doză de 0,6 mg, o dată sau de două ori pe zi, la pacienții refractari la corticosteroizi, singuri sau în asociere cu agenți imunosupresori. Deși există autori care o plasează în prima linie de tratament, în prezent ne lipsesc date care să o stabilească ca atare (tabelul 1).
TRANSPLANTULPULMONAR
Cazurile în care boala evoluează fără răspuns la tratament și ajunge să provoace insuficiență respiratorie sunt, din păcate, cele mai numeroase în această boală. În prezent, nu există nicio perspectivă de tratament medical pentru acești pacienți, cu excepția paliației. În acest context sumbru, posibilitatea transplantului de plămâni a apărut în anii 1980 și a evoluat până în punctul în care este acum o opțiune terapeutică care ar trebui să fie considerată ca un instrument de utilizare clinică și nu mai este limitată la domeniul experimental. Cea mai potrivită indicație a acestuia este la persoanele cu vârsta sub 65 de ani, în absența unei boli progresive și ireversibile în alte organe, precum și a unei infecții active nerezolvate sau a unei infecții cu germeni multirezistenți. Sunt necesare, de asemenea, o predispoziție personală și o stare nutrițională adecvată. Pacienții cu un CPT mai mic de 60% din cel așteptat sau cu o capacitate de difuzie pulmonară mai mică de 40% au o supraviețuire mai mică de 2 ani. În acest grad de disfuncție, au nevoie de oxigenoterapie și se desaturează cu ușurință la exerciții minime. Transplantul pulmonar trebuie luat în considerare în aceste cazuri, de îndată ce terapia cu oxigen devine necesară și se verifică progresia de neoprit a bolii. Tipul de transplant de alegere este transplantul cu un singur plămân, rezervând transplantul cu doi plămâni pentru cazurile în care există îndoieli cu privire la comportamentul plămânului rezidual. Atunci când pacientul are mai puțin de 50 de ani și are insuficiență cardiacă dreaptă, poate fi luat în considerare transplantul cardiopulmonar. Cu toate acestea, în această situație, boala este foarte avansată și este puțin probabil să reziste la așteptare18,19. Supraviețuirea post-transplant se așteaptă să fie de 80% în primul an și de 50-60% la 5 ani, ceea ce îmbunătățește semnificativ prognosticul pentru un pacient cu FPI care a ajuns la insuficiență respiratorie.
EVALUAREA RĂSPUNSULUI LA TRATAMENT
În absența complicațiilor, poate dura până la 6 luni înainte de a se obține un răspuns la tratament. După această perioadă, dacă pacientul s-a ameliorat sau este stabil, trebuie menținute aceleași doze. Dacă acestea s-au agravat, ar trebui să se treacă la o terapie alternativă (un alt agent imunosupresor sau chiar un transplant). La 12 luni, trebuie reevaluat în același mod, iar după 18 luni, individualizat în funcție de răspuns. Se recomienda continuar indefinidamente sólo en aquellos pacientes con mejoría continua o estabilización (tabla 2).

Una respuesta favorable se define por dos o más de los siguientes criterios en dos visitas consecutivas:
1. Mejoría de los síntomas, sobre todo en el grado de esfuerzo requerido para que el paciente deba parar cuando hace un esfuerzo o un descenso en la frecuencia o gravedad de la tos.
2. Reducción de las alteraciones radiológicas.
3. Mejoría funcional definida por dos o más de los siguientes parámetros:
Aumento >= 10% en la TLC o CV (o >= 200 ml).
Aumento >= 15% en DLCO o >= 3 ml/min/mmHg.
Mejoría o normalización de la SaO2 o pO2 (aumento >= 4% o >= 4 mmHg) durante un prueba de esfuerzo cardiorrespiratoria.
Una respuesta estable (también considerada favorable) se define por dos o más de los siguientes criterios en dos visitas consecutivas:
1. Cambio de
2. Cambio de
3. Sin cambios en la SaO2 o pO2 (aumento
Un fracaso del tratamiento se define por dos o más de los siguientes criterios en dos visitas consecutivas:
1. Aumento de los síntomas, sobre todo disnea o tos.
2. Aumento de las alteraciones radiológicas, especialmente imágenes en panal o signos de hipertensión pulmonar.
3. Deterioro funcional definido por dos o más de los siguientes parámetros:
Descenso >= 10% en la TLC o CV (o >= 200 ml).
Descenso >= 15% en DLCO o >= 3 ml/min/mmHg.
Înrăutățirea SaO2 (= 4%) sau creșterea gradientului alveolo-arterial (AapO2) (= 4 mmHg) în repaus sau în timpul unui test de efort cardiorespirator.
CONCLUZII
Fibroza pulmonară idiopatică este o boală fatală, fără remisiune spontană și cu răspuns slab la tratament. Studiile cu privire la aceasta din urmă sunt puține și implică un număr mic de pacienți. Corticosteroizii menținuți timp de cel puțin un an, în doze diferite, reprezintă cea mai acceptată schemă, singuri sau în combinație cu alți agenți imunosupresori. Recent, terapia combinată a fost recomandată de Societățile americană de pneumologie toracică și europeană4 . Agenții antifibroză sunt în curs de investigare cu intenția de a împiedica procesul fibrotic să se instaleze și, prin urmare, să devină ireversibil, deoarece mulți pacienți sunt diagnosticați în stadii tardive. Având în vedere ratele de supraviețuire și evoluția, transplantul pulmonar ar trebui luat în considerare de îndată ce pacienții nu reușesc tratamentul și necesită oxigenoterapie. Toate acestea sugerează necesitatea de a stabili studii multicentrice în ideea de a recruta un număr suficient de pacienți pentru a evalua eficacitatea tratamentelor administrate, precum și pentru a identifica istoria naturală a bolii și incidența și prevalența reală4,20. Pe de altă parte, se recomandă identificarea și inițierea tratamentului în stadiile incipiente ale bolii pentru a obține rate de supraviețuire mai mari.