Identificar os blocos de construção da matéria
No seu nível mais fundamental, a vida é feita de matéria. A matéria é qualquer substância que ocupa espaço e tem massa. Os elementos são formas únicas de matéria com propriedades químicas e físicas específicas que não podem ser decompostas em substâncias menores por reacções químicas comuns. Existem 118 elementos, mas apenas 92 ocorrem naturalmente. Os restantes elementos são sintetizados em laboratórios e são instáveis.
Cada elemento é designado pelo seu símbolo químico, que é uma única letra maiúscula ou, quando a primeira letra já é “tomada” por outro elemento, uma combinação de duas letras. Alguns elementos seguem o termo inglês para o elemento, tais como C para carbono e Ca para cálcio. Os símbolos químicos de outros elementos derivam de seus nomes latinos; por exemplo, o símbolo para sódio é Na, referindo-se ao natrium, a palavra latina para sódio.
Os quatro elementos comuns a todos os organismos vivos são oxigênio (O), carbono (C), hidrogênio (H), e nitrogênio (N). No mundo não vivo, os elementos são encontrados em diferentes proporções, e alguns elementos comuns aos organismos vivos são relativamente raros na Terra como um todo, como mostrado na Tabela 1. Por exemplo, a atmosfera é rica em nitrogênio e oxigênio, mas contém pouco carbono e hidrogênio, enquanto a crosta terrestre, embora contenha oxigênio e uma pequena quantidade de hidrogênio, tem pouco nitrogênio e carbono. Apesar de suas diferenças em abundância, todos os elementos e as reações químicas entre eles obedecem às mesmas leis químicas e físicas, independentemente de fazerem parte do mundo vivo ou não.
| Element | Life (Humans) | Atmosphere | Earth’s Crust |
|---|---|---|---|
| Oxygen (O) | 65% | 21% | 46% |
| Carbon (C) | 18% | trace | trace |
| Hydrogen (H) | 10% | trace | 0.1% |
| Nitrogen (N) | 3% | 78% | trace |
Learning Objectives
- Draw a diagram of an atom, according to current scientific understanding
- Understand the periodic table of elements and how to use it to understand elements
- Describe the behavior and location of electrons, e como estes factores influenciam a formação de ligações entre os átomos
Átomos
A Estrutura do Átomo
Para compreender como os elementos se juntam, devemos primeiro discutir o menor componente ou bloco de construção de um elemento, o átomo. Um átomo é a menor unidade de matéria que retém todas as propriedades químicas de um elemento. Por exemplo, um átomo de ouro tem todas as propriedades do ouro, na medida em que é um metal sólido à temperatura ambiente. Uma moeda de ouro é simplesmente um número muito grande de átomos de ouro moldados na forma de uma moeda e contendo pequenas quantidades de outros elementos conhecidos como impurezas. Os átomos de ouro não podem ser decompostos em nada menor, mantendo as propriedades do ouro.
Um átomo é composto de duas regiões: o núcleo, que está no centro do átomo e contém prótons e nêutrons, e a região mais externa do átomo, que mantém seus elétrons em órbita ao redor do núcleo, como ilustrado na Figura 1. Os átomos contêm prótons, elétrons e nêutrons, entre outras partículas subatômicas. A única exceção é o hidrogênio (H), que é feito de um próton e um elétron sem nêutrons.

Figure 1. Elementos, como o hélio, aqui representados, são compostos por átomos. Os átomos são compostos de prótons e nêutrons localizados dentro do núcleo, com elétrons em orbitais ao redor do núcleo.
Protões e nêutrons têm aproximadamente a mesma massa, cerca de 1,67 × 10-24 gramas. Os cientistas definem arbitrariamente esta quantidade de massa como uma unidade de massa atômica (amu) ou um Dalton, como mostrado na Tabela 1. Embora semelhantes em massa, os prótons e os nêutrons diferem em sua carga elétrica. Um próton é carregado positivamente enquanto um nêutron é descarregado. Portanto, o número de nêutrons em um átomo contribui significativamente para sua massa, mas não para sua carga. Os elétrons são muito menores em massa do que os prótons, pesando apenas 9,11 × 10-28 gramas, ou cerca de 1/1800 de uma unidade de massa atômica. Portanto, eles não contribuem muito para a massa atômica geral de um elemento. Portanto, ao considerar a massa atômica, é costume ignorar a massa de quaisquer elétrons e calcular a massa do átomo com base apenas no número de prótons e nêutrons. Embora não contribuam significativamente para a massa, os elétrons contribuem muito para a carga do átomo, já que cada elétron tem uma carga negativa igual à carga positiva de um próton. Nos átomos neutros não carregados, o número de elétrons orbitando o núcleo é igual ao número de prótons dentro do núcleo. In these atoms, the positive and negative charges cancel each other out, leading to an atom with no net charge.
Accounting for the sizes of protons, neutrons, and electrons, most of the volume of an atom—greater than 99 percent—is, in fact, empty space. With all this empty space, one might ask why so-called solid objects do not just pass through one another. The reason they do not is that the electrons that surround all atoms are negatively charged and negative charges repel each other.
| Table 1. Protons, Neutrons, and Electrons | |||
|---|---|---|---|
| Charge | Mass (amu) | Location | |
| Proton | +1 | 1 | nucleus |
| Neutron | 0 | 1 | nucleus |
| Electron | -1 | 0 | orbitals |
Número e massa atómica
Atomos de cada elemento contêm um número característico de prótons e electrões. O número de prótons determina o número atômico de um elemento e é usado para distinguir um elemento de outro. O número de nêutrons é variável, resultando em isótopos, que são diferentes formas do mesmo átomo que variam apenas no número de nêutrons que possuem. Juntos, o número de prótons e o número de nêutrons determinam o número de massa de um elemento, como ilustrado na Figura 2. Note que a pequena contribuição de massa dos elétrons é desconsiderada no cálculo do número de massa. Esta aproximação de massa pode ser usada para calcular facilmente quantos nêutrons um elemento possui, simplesmente subtraindo o número de prótons do número de massa. Como os isótopos de um elemento terão números de massa ligeiramente diferentes, os cientistas também determinam a massa atómica, que é a média calculada do número de massa para os seus isótopos naturais. Muitas vezes, o número resultante contém uma fração. Por exemplo, a massa atômica do cloro (Cl) é 35,45 porque o cloro é composto de vários isótopos, alguns (a maioria) com massa atômica 35 (17 prótons e 18 nêutrons) e alguns com massa atômica 37 (17 prótons e 20 nêutrons).
Pratica Pergunta
Carbon tem um número atômico de seis, e dois isótopos estáveis com números de massa de doze e treze, respectivamente. Sua massa atômica é 12.11.

Figure 2. Carbon-12 e carbon-13
Quantos neutrões o carbon-12 e o carbon-13 têm, respectivamente?
A Tabela Periódica de Elementos
Os diferentes elementos são organizados e exibidos na tabela periódica. Elaborada pelo químico russo Dmitri Mendeleev (1834-1907) em 1869, a tabela agrupa elementos que, embora únicos, compartilham certas propriedades químicas com outros elementos. As propriedades dos elementos são responsáveis pelo seu estado físico à temperatura ambiente: eles podem ser gases, sólidos ou líquidos. Os elementos também têm uma reatividade química específica, a capacidade de combinar e unir quimicamente entre si.
Na tabela periódica, mostrada na Figura 3, os elementos são organizados e exibidos de acordo com seu número atômico e estão dispostos em uma série de linhas e colunas com base em propriedades químicas e físicas compartilhadas. Além de fornecer o número atômico de cada elemento, a tabela periódica também exibe a massa atômica do elemento. Olhando para o carbono, por exemplo, seu símbolo (C) e nome aparecem, assim como seu número atômico de seis (no canto superior esquerdo) e sua massa atômica de 12.11.

Figure 3. A tabela periódica mostra a massa atómica e o número atómico de cada elemento. O número atômico aparece acima do símbolo do elemento e a massa atômica aproximada aparece abaixo dele.
A tabela periódica agrupa os elementos de acordo com as propriedades químicas. As diferenças na reatividade química entre os elementos são baseadas no número e distribuição espacial dos elétrons de um átomo. Os átomos que reagem quimicamente e se ligam uns aos outros formam moléculas. As moléculas são simplesmente dois ou mais átomos ligados quimicamente entre si. Logicamente, quando dois átomos se ligam quimicamente para formar uma molécula, seus elétrons, que formam a região mais externa de cada átomo, se unem primeiro como os átomos formam uma ligação química.
Veja este vídeo para uma introdução mais profunda à tabela periódica:
Electrões
Conchas de electrões e o Modelo Bohr

Figure 4. O modelo de Bohr.
Deve-se salientar que existe uma conexão entre o número de prótons de um elemento, o número atômico que distingue um elemento de outro, e o número de elétrons que ele possui. Em todos os átomos eletricamente neutros, o número de elétrons é o mesmo que o número de prótons. Assim, cada elemento, pelo menos quando eletricamente neutro, tem um número característico de elétrons igual ao seu número atômico.
Um modelo inicial do átomo foi desenvolvido em 1913 pelo cientista dinamarquês Niels Bohr (1885-1962). Neste modelo, os elétrons existem dentro das conchas principais. Um elétron normalmente existe na concha de energia mais baixa disponível, que é a mais próxima do núcleo. A energia de um fóton de luz pode elevá-lo a uma concha energética superior, mas esta situação é instável, e o electrão rapidamente se decompõe de volta ao estado de terra. No processo, um fóton de luz é liberado.
O modelo Bohr mostra o átomo como um núcleo central contendo prótons e nêutrons, com os elétrons em orbitais circulares a distâncias específicas do núcleo, como ilustrado na Figura 4. Estas órbitas formam conchas de elétrons ou níveis de energia, que são uma forma de visualizar o número de elétrons nas conchas mais externas. Estes níveis de energia são designados por um número e o símbolo “n.”. Por exemplo, 1n representa o primeiro nível de energia localizado mais próximo do núcleo.
Elétrons preenchem orbitais numa ordem consistente: primeiro preenchem os orbitais mais próximos do núcleo, depois continuam a preencher orbitais de energia crescente mais distantes do núcleo. Se houver múltiplas orbitais de igual energia, elas serão preenchidas com um elétron em cada nível de energia, antes que um segundo elétron seja adicionado. Os elétrons do nível energético mais externo determinam a estabilidade energética do átomo e sua tendência a formar ligações químicas com outros átomos para formar moléculas.
Em condições padrão, os átomos preenchem primeiro as conchas internas, resultando muitas vezes num número variável de elétrons na concha mais externa. A casca mais interna tem um máximo de dois elétrons, mas as duas cascas de elétrons seguintes podem ter um máximo de oito elétrons cada. Isto é conhecido como a regra do octeto, que declara, com excepção da concha interna, que os átomos são energeticamente mais estáveis quando têm oito electrões na sua concha de valência, a concha de electrões mais externa. Exemplos de alguns átomos neutros e suas configurações de elétrons são mostrados na Figura 5. Note que, nesta figura, o hélio tem um invólucro de electrões exterior completo, com dois electrões a preencherem o seu primeiro e único invólucro. Da mesma forma, o néon tem uma concha externa completa de 2n contendo oito elétrons. Em contraste, o cloro e o sódio têm sete e um em suas conchas externas, respectivamente, mas teoricamente seriam mais estáveis energeticamente se seguissem a regra do octeto e tivessem oito.
Pergunta prática
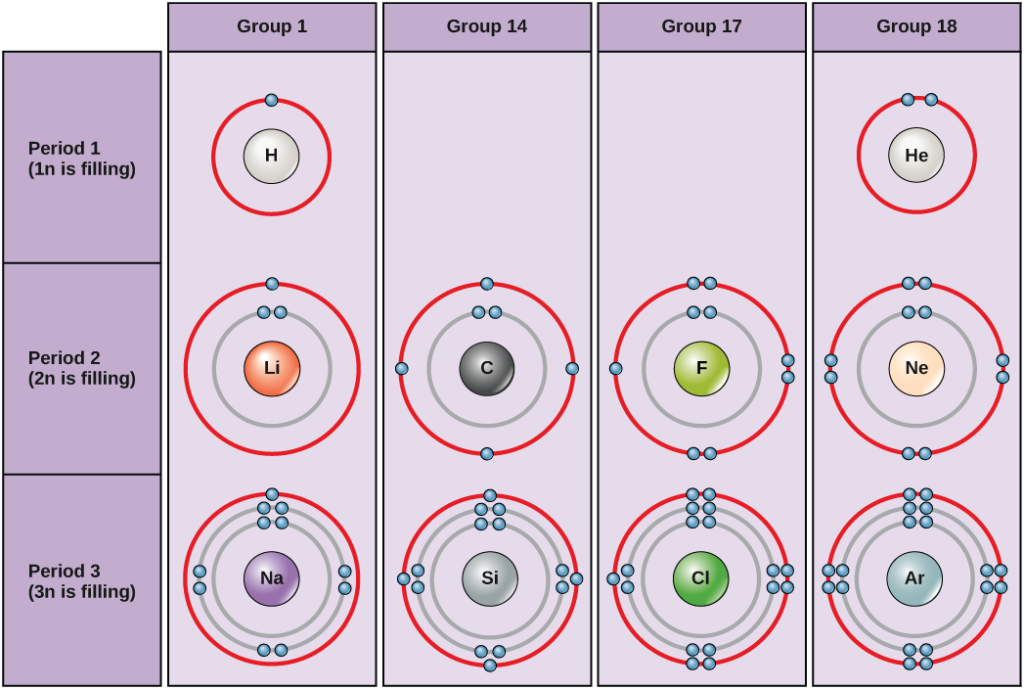
Figure 5. Os diagramas de Bohr para hidrogênio, hélio, lítio, carbono, flúor, neônio, sódio, silício, cloro e argônio.
Bohr indicam quantos elétrons enchem cada concha principal. Os elementos do grupo 18 (hélio, néon e argônio são mostrados na Figura 5) têm uma concha externa, ou valência, completa. Uma concha de valência completa é a configuração eletrônica mais estável. Elementos em outros grupos têm conchas de valência parcialmente preenchidas e ganham ou perdem elétrons para alcançar uma configuração eletrônica estável.
Um átomo pode dar, tomar ou compartilhar elétrons com outro átomo para alcançar uma concha de valência completa, a configuração eletrônica mais estável. Olhando para esta figura, quantos elétrons os elementos do grupo 1 precisam perder para se obter uma configuração eletrônica estável? Quantos elétrons os elementos dos grupos 14 e 17 precisam ganhar para conseguir uma configuração estável?
P>A compreensão de que a organização da tabela periódica é baseada no número total de prótons (e elétrons) nos ajuda a saber como os elétrons estão distribuídos entre a casca externa. A tabela periódica é organizada em colunas e linhas com base no número de elétrons e onde estes elétrons estão localizados. Veja mais de perto alguns dos elementos da tabela periódica na coluna extrema direita da Figura 3.
O grupo de 18 átomos hélio (He), néon (Ne) e árgon (Ar) têm todos conchas de elétrons externos preenchidos, tornando desnecessário que eles compartilhem elétrons com outros átomos para atingir a estabilidade; eles são altamente estáveis como átomos únicos. Sua não reatividade resultou em serem chamados de gases inertes (ou gases nobres). Compare isto com os elementos do grupo 1 na coluna da esquerda. Estes elementos, incluindo hidrogênio (H), lítio (Li) e sódio (Na), todos têm um elétron em suas conchas mais externas. Isso significa que eles podem alcançar uma configuração estável e uma concha externa preenchida doando ou compartilhando um elétron com outro átomo ou uma molécula como a água. O hidrogênio doará ou compartilhará seu elétron para alcançar esta configuração, enquanto o lítio e o sódio doarão seu elétron para se tornarem estáveis. Como resultado da perda de um elétron com carga negativa, eles se tornam íons com carga positiva. Os elementos do grupo 17, incluindo o flúor e o cloro, têm sete elétrons em suas conchas mais externas, portanto tendem a encher esta concha com um elétron de outros átomos ou moléculas, tornando-os íons com carga negativa. Os elementos do grupo 14, dos quais o carbono é o mais importante para os sistemas vivos, têm quatro elétrons em sua casca externa, permitindo-lhes fazer várias ligações covalentes (discutidas abaixo) com outros átomos. Assim, as colunas da tabela periódica representam o potencial estado compartilhado das conchas elétricas externas desses elementos que é responsável por suas características químicas semelhantes.
Electron Orbitals
P>Embora útil para explicar a reatividade e a ligação química de certos elementos, o modelo Bohr do átomo não reflete com precisão como os elétrons estão distribuídos espacialmente em torno do núcleo. Eles não circundam o núcleo como a Terra orbita o Sol, mas são encontrados nas orbitais dos elétrons. Estas formas relativamente complexas resultam do fato de que os elétrons se comportam não só como partículas, mas também como ondas. As equações matemáticas da mecânica quântica conhecidas como funções de onda podem prever dentro de um certo nível de probabilidade onde um elétron pode estar em um determinado momento. A área onde um elétron é mais provável de ser encontrado é chamada de orbital.

Figure 6. Clique para uma imagem maior. As subesferas de 2np têm a forma de esferas. Tanto as conchas 1n como 2n principais têm um s orbital, mas o tamanho da esfera é maior no 2n orbital. Cada esfera é uma única orbital. As subcascasas p são constituídas por três orbitais em forma de dumbbell-. O shell principal 2n tem uma subesfera p, mas o shell 1 não.
Recalhe que o modelo Bohr retrata a configuração do shell de elétrons de um átomo. Dentro de cada concha de electrões estão sub-conchas, e cada sub-concha tem um número especificado de orbitais contendo electrões. Embora seja impossível calcular exatamente onde um elétron está localizado, os cientistas sabem que ele provavelmente está localizado dentro do seu caminho orbital. As subcascasas são designadas pelas letras s, p, d e f. A subcasa s tem forma esférica e tem um orbital. A concha principal 1n tem apenas um único s orbital, que pode conter dois elétrons. A concha principal 2n tem uma concha s e uma concha p, e pode conter um total de oito elétrons. A subesfera p tem três orbitais em forma de haltere, como ilustrado na Figura 6. As subcascasas d e f têm formas mais complexas e contêm cinco e sete orbitais, respectivamente. Estas não são mostradas na ilustração. A concha principal 3n tem subconchas s, p, e d e pode conter 18 elétrons. A concha principal 4n tem s, p, d e f orbitais e pode conter 32 elétrons. Ao afastar-se do núcleo, o número de elétrons e orbitais encontrados nos níveis de energia aumenta. Passando de um átomo para o seguinte na tabela periódica, a estrutura dos elétrons pode ser trabalhada encaixando um elétron extra no próximo orbital disponível.
O orbital mais próximo do núcleo, chamado orbital 1s, pode conter até dois elétrons. Este orbital é equivalente à casca de electrões mais interna do modelo Bohr do átomo. É chamado o orbital 1s porque é esférico ao redor do núcleo. O orbital 1s é o orbital mais próximo do núcleo, e é sempre preenchido primeiro, antes de qualquer outro orbital poder ser preenchido. O hidrogênio tem um elétron; portanto, tem apenas um ponto dentro do orbital 1s ocupado. Este é designado como 1s1, em que o 1 sobrescrito se refere a um electrão dentro do orbital 1s. O hélio tem dois elétrons; portanto, pode preencher completamente o orbital 1s com os seus dois elétrons. Este é designado como 1s2, referindo-se aos dois elétrons de hélio no orbital do 1s. Na tabela periódica Figura 6, o hidrogênio e o hélio são os dois únicos elementos da primeira linha (período); isto porque só têm elétrons na sua primeira casca, o orbital 1s. O hidrogênio e o hélio são os únicos dois elementos que têm o 1s e nenhum outro orbital de elétrons no estado neutro eletricamente.
O segundo orbital de elétrons pode conter oito elétrons. Esta casca contém outro orbital esférico s e três orbitais p em forma de “haltere”, cada um dos quais pode conter dois elétrons, como mostrado na Figura 6. Após o orbital 1s ser preenchido, a segunda concha de elétrons é preenchida, primeiro preenchendo seu orbital 2s e depois seus três orbitais p. Ao encher as orbitais p, cada uma leva um único elétron; uma vez que cada orbital p tem um elétron, um segundo pode ser adicionado. O lítio (Li) contém três elétrons que ocupam a primeira e a segunda concha. Dois electrões preenchem o orbital 1s e o terceiro electrão preenche o orbital 2s. A sua configuração electrónica é 1s22s1. O néon (Neon), por outro lado, tem um total de dez elétrons: dois estão no seu interior orbital 1s e oito preenchem a sua segunda casca (dois nos 2s e três p orbitais); portanto, é um gás inerte e energeticamente estável como um único átomo que raramente formará uma ligação química com outros átomos. Os elementos maiores têm orbitais adicionais, formando a terceira casca de elétron. Enquanto os conceitos de conchas de elétrons e orbitais estão intimamente relacionados, os orbitais fornecem uma representação mais precisa da configuração eletrônica de um átomo porque o modelo orbital especifica as diferentes formas e orientações especiais de todos os lugares que os elétrons podem ocupar.
Veja esta animação visual para ver a disposição espacial dos orbitais p e s. Note that this video has no audio.
Video Review
This video gives another overview of the electron:
Check Your Understanding
Answer the question(s) below to see how well you understand the topics covered in the previous section. This short quiz does not count toward your grade in the class, and you can retake it an unlimited number of times.
Use this quiz to check your understanding and decide whether to (1) study the previous section further or (2) move on to the next section.