ÚVOD
Intersticiální plicní onemocnění tvoří extrémně heterogenní skupinu onemocnění, jejichž společným znakem je existence zánětlivé složky plicního parenchymu, která se nakonec může vyvinout ve fibrózu a která z funkčního hlediska způsobuje restriktivní změny, jež mohou nakonec vést k respiračnímu selhání.
Přestože se jedná o onemocnění, jejichž diagnostika a léčba se provádí ve specializovaném oboru pneumologie, léčba probíhá zásadně ambulantně, a vzhledem k tomu, že může být a často je provázena různými komplikacemi, je důležité, aby lékař primární péče znal aktuální pokyny pro léčbu těchto onemocnění, protože v mnoha případech se na něj budou obracet pacienti s tímto typem problému, ať už z důvodu respiračních komplikací nebo jiných typů komplikací.
Účelem tohoto přehledu je aktualizovat terapeutické modality, které lze dnes těmto pacientům nabídnout. Domníváme se, že je nesmírně důležité, aby nejen lékař primární péče měl o této problematice aktuální znalosti, ale aby také spolupracoval s pneumologem s cílem dosáhnout dobré compliance pacienta s léčbou a včasného odhalení a léčby případných komplikací.
Mezi intersticiálními onemocněními je vzhledem ke své četnosti a závažnosti nejvýznamnější idiopatická plicní fibróza (IPF). Na druhou stranu je jeho léčba modelem, na němž je založena léčba téměř všech těchto onemocnění, s výjimkou těch, u nichž lze nalézt známé etiologické agens, protože u nich bude eliminace tohoto agens základem terapie. Zaměříme se proto na přehled současných pokynů pro léčbu IPF. Nejprve stručně shrneme její klinickou charakteristiku a poté podrobně rozvedeme současnou léčbu IPF.
KLINICKÝ POPIS
IPF představuje pravděpodobně nejagresivnější prototyp difuzních intersticiálních pneumopatií. Její výskyt někteří autoři odhadují na 5 případů na 100 000 obyvatel1 , i když ve skutečnosti není znám. Její patogeneze souvisí se změnami v komplexních drahách imunitního systému2,3. Z tohoto důvodu se většinou používají imunosupresiva.
Nejčastějším klinickým projevem je dušnost se zákeřným začátkem doprovázená suchým kašlem, který může být pro pacienta nejvíce obtěžujícím příznakem vzhledem k jeho záchvatovitému a dušnému charakteru. Obecně je dušnost zpočátku nevýrazná a pro včasnou diagnózu je nutné vysoké podezření. Někdy je průběh od počátku rychlý a vede během několika měsíců k ireverzibilnímu respiračnímu selhání, jak bylo charakteristické pro původní popisy Hammana a Riche. Častěji se však stává, že stav v době první návštěvy pacienta již několik měsíců progreduje.
Při fyzikálním vyšetření jsou velmi charakteristické jemné, suché krakely (velcro rales), které lze auskultačně zjistit ve více než 80 % případů. V pokročilých případech se může objevit dušnost při mírné námaze nebo dokonce cyanóza rtů. Akropaquie se mohou vyskytovat přibližně ve 30-50 % případů. Podezření na IPF zesílí, když se na rentgenovém snímku hrudníku a CT vyšetření objeví příznaky, jako je retikulární vzor, oblasti infiltrace skelnou hmotou a zmenšený objem plic. Nakonec funkční vyšetření potvrdí existenci restrikčního vzorce a analýza arteriálních krevních plynů potvrdí existenci hypoxémie. V pochybných případech má velký význam průkaz hypoxémie při námaze.
Definitivní potvrzení diagnózy lze provést pouze biopsií plic. Skutečnost je však taková, že i v mnoha publikovaných sériích převažují případy bez histologické diagnózy. Americká hrudní společnost (ATS) nedávno navrhla, že existence všech těchto kritérií znamená, že při absenci expozice lékům, prvkům životního prostředí nebo onemocnění pojivové tkáně lze diagnózu IPF s největší pravděpodobností stanovit i bez plicní biopsie4 v případech, kdy by plicní biopsie představovala nepřijatelné riziko.
Přítomná intersticiální pneumonie (UIP) je histopatologický obraz, který tyto pacienty identifikuje4. Za různé jednotky jsou považovány ty, které mají charakter deskvamativní intersticiální pneumonie, intersticiálního onemocnění spojeného s respirační bronchiolitidou, nespecifické intersticiální pneumonie, lymfoidní intersticiální pneumonie, akutní intersticiální pneumonie a obliterující bronchiolitidy s organizující se pneumonií.
Po stanovení diagnózy a klinické závažnosti vyžaduje většina pacientů léčbu, protože se jedná o smrtelné onemocnění bez spontánní remise. Odpověď na léčbu je špatná. Pětileté přežití je 50 %5,2,6-8. Léčba trvá přibližně 3-6 měsíců, než se dostaví účinnost. Zpráv o léčbě těchto onemocnění je málo: nekontrolované terapeutické studie většinou zahrnují malý počet pacientů9.
Přes nevyhnutelnou zákeřnou a nezvratnou progresi onemocnění není terapeutický nihilismus oprávněný. Existují příklady neléčené fibrózy s pomalou progresí vedoucí k ireverzibilní fibróze nereagující na léčbu nebo k rozvoji rychle progredující fáze. Všechny pravděpodobně vyžadují léčbu v době prezentace. Pacienti s kontraindikacemi léčby nebo pacienti bez známek funkčního poškození však mohou sledovat program v intervalu 3-6 měsíců. Obtížná je také léčba starších pacientů s histologií s převahou fibrózy a závažným postižením plicních funkcí. Tito pacienti podstoupí krátkou léčbu v délce 3-6 měsíců, aby se zjistila reverzibilita. Jen u několika z nich se dostaví pozitivní odpověď.
Často je obtížné určit, zda léčba přináší požadovaný efekt. Často dochází k subjektivnímu zlepšení (až u 70 % pacientů). K objektivnímu zlepšení dochází u 20-30 % pacientů. Nejčastěji používanými parametry pro definici funkčního (objektivního) zlepšení jsou zvýšení celkové kapacity plic (TLC) nebo vitální kapacity (VC), zvýšení difuzní kapacity a snížení nebo normalizace poklesu SaO2 během zátěže4,10-12.
LÉČBA
Kortikosteroidy
Kortikosteroidy jsou základem léčby IPF, i když jejich úspěšnost je poměrně nízká, příznivá odpověď se objevuje u jedné třetiny pacientů. Důvodem jejich použití je potlačení chronické alveolitidy. Předpokládá se, že působí tak, že potlačují migraci neutrofilů a lymfocytů v plicích, snižují koncentraci imunokomplexů, mění funkci alveolárních makrofágů a adhezi neutrofilů na endoteliální povrchy.
Není jasné, proč někteří pacienti reagují a jiní ne. Může to souviset s přítomností povrchových receptorů na buňkách plicního parenchymu. Zdá se, že krátký časový průběh příznaků, mírné funkční a radiologické postižení, ženské pohlaví a mladší věk pacientů jsou spojeny s lepším výsledkem.
Přestože se však jedná o nejrozšířenější léčbu, její dlouhodobá účinnost nebyla potvrzena žádnou prospektivní, jednoslepou a placebem kontrolovanou studií.
Izumi a spol. analyzovali přežití 222 pacientů a zjistili, že po 10 letech nebyl rozdíl v přežití mezi těmi, kteří dostávali steroidy, a neléčenými pacienty13. Nicméně pokud se u pacienta s IPF objeví zhoršená funkce plic nebo příznaky, které narušují běžný život, je rozumné zahájit pokus o léčbu steroidy. Spontánní zlepšení onemocnění je totiž velmi vzácné, a pokud je rozhodnuto o odložení zahájení léčby, mělo by to být na úkor pečlivého sledování pacienta, aby mohla být léčba zahájena, jakmile se zhoršení projeví.
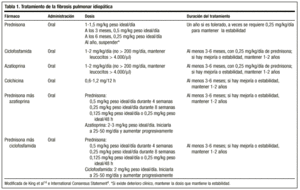
Klasická léčba se zahajuje prednisonem 1,5-2 mg/kg ideální hmotnosti/den v jednorázové dávce ráno, která nesmí překročit dávku 100 mg. Po 2-3 měsících je pacient znovu vyšetřen pomocí rentgenového snímku a funkční studie. Pokud pacient reaguje, prednison se snižuje (1-2 mg/týden) na udržovací dávku 0,5 mg/kg ideální hmotnosti/den, kterou lze následně snížit. Pokud nedojde k odpovědi, přidá se imunosupresivní lék. Obecně je nepravděpodobné, že by léčba mohla být ukončena, a obvykle se udržují dávky 0,25 mg/kg ideální hmotnosti/den.
Americká a Evropská hrudní společnost v poslední době dospěly ke konsenzu, aby se předešlo nežádoucím účinkům tohoto léku a dosáhlo se lepšího přežití, zahájit léčbu kombinací prednisonu nebo jiného kortikosteroidu v ekvivalentních dávkách a imunosupresiva (azathioprinu nebo cyklofosfamidu)4: prednison 0,5 mg/kg ideální hmotnosti/den po dobu 4 týdnů; 0,25 mg/kg ideální hmotnosti/den po dobu 8 týdnů a poté snižování na 0,125 mg/kg ideální hmotnosti/den nebo 0,25 mg/kg ideální hmotnosti/48 hod.
Neexistují žádné pokyny týkající se délky léčby; minimální doba je jeden rok. Je možné, že po několika měsících nebo letech může dojít k reaktivaci onemocnění, v takovém případě by měla být zahájena léčba stejnými přípravky. V každém případě by odpověď na léčbu měla být vždy hodnocena z hlediska objektivního zlepšení a možnost chronického udržování pacienta na dávce, která zaručuje stabilitu, by měla být vyhrazena pro ty případy, kdy dojde ke zlepšení při podávání kortikosteroidů, zhoršení při snižování dávky a novému zlepšení při opětovném zvýšení dávky. Dávku potřebnou pro každého pacienta lze stanovit pouze individuálně v závislosti na reakci na změny dávky. Mnozí autoři považují celoživotní léčbu za nezbytnou.14
Při počáteční závažnosti onemocnění se navrhují vysoké dávky kortikosteroidů. Keogh a spol. používali u pacientů s těžkým onemocněním intermitentní vysoké dávky parenterálních kortikosteroidů: intravenózní metylprednisolon 2 g jednou týdně a perorální prednison 0,25 mg/kg/den. Důvodem je, že mají výraznější účinek na neutrofilní alveolitidu (spojenou se špatnou prognózou) než nízké dávky steroidů15. Tato práce však trpí některými nedostatky, jako je krátké sledování 6 měsíců, malý počet pacientů a nižší než standardní dávky prednisonu9. Počáteční léčba vysokými dávkami intravenózních kortikosteroidů (metylprednisolon 250 mg/6 h) byla použita ve snaze zvládnout onemocnění co nejdříve, když rychle progreduje. Neexistují žádné kontrolované studie, které by určily, zda jsou tyto metody účinné; zdá se však, že vyšší dávky mají větší účinnost, i když vedlejší účinky jsou také větší.14.
CITOTOXICKÉ LÁTKY
Klasicky se používaly jako alternativa ke kortikosteroidům, pokud byly tyto neúčinné, a také pokud jejich vedlejší účinky bránily jejich dalšímu podávání. V souladu se zcela praktickým duchem tohoto článku se budeme zabývat těmi látkami, které se v klinické praxi ukázaly jako užitečné, ačkoli stejně jako v případě kortikosteroidů nám chybí dlouhé, prospektivní a randomizované série, které by nám umožnily přesně zjistit, jaká je jejich přesná role v léčbě IPF.
Azathioprin
Jeho mechanismus účinku je založen na substituci purinů při syntéze deoxyribonukleové kyseliny, čímž inhibuje adenin deaminázu a inaktivuje lymfocyty. Mezi další účinky patří potlačení aktivity přirozených zabíječů, produkce protilátek a buněčné cytotoxicity závislé na protilátkách.
Doporučená dávka je 2 mg/kg/den, nesmí překročit 200 mg/den, po dobu 3-6 měsíců. Podávání se zahajuje dávkou 50 mg/den a v případě dobré snášenlivosti se dávka zvyšuje v 1 až 2týdenních intervalech až do dosažení plánované dávky.
Hlavní nežádoucí účinky jsou hematologické: leukopenie, anémie, trombocytopenie, aplazie červených krvinek a pancytopenie. Je nutné sledovat počet leukocytů, a pokud klesne pod 4 000/μl, azathioprin se musí vysadit, dokud se tento počet opět nezvýší. Kromě toho se mohou objevit gastrointestinální potíže, jako je nevolnost a zvracení, peptický vřed, průjem a mírné zvýšení jaterních enzymů. Celkově až ve 20-30 % případů vedlejší účinky vyžadují vysazení azathioprinu.
Raghu et al porovnávali účinnost vysokých dávek glukokortikoidů oproti azathioprinu v kombinaci s nízkými dávkami glukokortikoidů. Použití tohoto léku bylo doprovázeno mírným zlepšením parametrů respiračních funkcí a prodloužením doby přežití17.
Cyklofosfamid
Je alkylační látka. Jeho účinek spočívá v depleci lymfocytů, a tak potlačuje jejich funkci. Doporučená dávka je 2 mg/kg/den jednorázově, perorálně, obvykle se zvažuje s 0,25 mg/kg/den perorálního prednisonu, nesmí překročit 200 mg/den po dobu nejméně 3 měsíců a až 9-12 měsíců.
Nejdůležitějším nežádoucím účinkem je leukopenie. Celkový počet leukocytů musí být vyšší než 3 000/μl nebo počet neutrofilů vyšší než 1 500/μl. Mezi další komplikace patří trombocytopenie, hematurie sekundárně způsobená hemoragickou cystitidou, anorexie, nevolnost a zvracení, útlum kostní dřeně, azoospermie a amenorea, infekce a hematologické malignity.
Kolb a spol. studovali 18 pacientů s IPF, aby zjistili účinnost a bezpečnost pulzní léčby cyklofosfamidem. Cyklofosfamid byl podáván intermitentně (1-1,3 g/měsíc) spolu s perorálním prednisolonem po dobu jednoho roku. Po tomto období byl cyklofosfamid vysazen a pokračovalo se v podávání dosažených dávek kortikosteroidů8 . Byli sledováni po dobu minimálně 14 měsíců a sledovali QoL, TLC, FEV1, kapacitu přenosu CO (DLCO), SaO2 a také symptomy. U jednoho pacienta musela být léčba přerušena kvůli opakovaným pneumoniím; 11 pacientů bylo považováno za respondéry (5 se zlepšilo a 6 stabilizovalo) a 6 se zhoršilo. Dlouhodobá toxicita cyklofosfamidu závisí na kumulativních dávkách. Přerušované dávky jsou stejně účinné a lépe snášené než denní dávky. Respondenti měli vyšší procento lymfocytů v BAL. Dalším pozoruhodným zjištěním je, že počáteční QOL respondérů byla výrazně lepší díky kratší době do progrese, což naznačuje, že tato léčba by měla být zahájena včas.
Baughman a Lower léčili 33 pacientů s IPF cyklofosfamidem v dávce 1 000-1 800 mg/2 týdny po dobu 18 měsíců. U těch, kteří přežili 18 měsíců, došlo k významnému zlepšení VCF, které se udrželo po celý následující rok. Snížení prednisolonu bylo možné z 32 na 4 mg/den16.
Penicilamin
Antifibrosant. Předpokládá se, že zasahováním do tvorby intra- a intermolekulárních kovalentních vazeb kolagenních vláken brání rozvoji plicní fibrózy. Byly popsány některé případy onemocnění pojivové tkáně s přidruženou plicní fibrózou, u kterých měla určitou účinnost, ale neexistují žádné kontrolované studie na velkých souborech pacientů, takže ji v současné době nelze považovat za platnou alternativní léčbu. Před vydáním doporučení je proto třeba provést další studie.
Kolchicin
Snižuje sekreci kolagenu a zvyšuje kolagenolytickou aktivitu. Má také protizánětlivý účinek. K přesnějšímu určení jeho role v léčbě tohoto onemocnění jsou zapotřebí studie, ale existují studie, ve kterých mu byla přisuzována podobná účinnost jako kortikosteroidům, a jeho vedlejší účinky nejsou závažné. Doporučuje se v dávce 0,6 mg jednou nebo dvakrát denně u pacientů refrakterních na kortikosteroidy, samostatně nebo v kombinaci s imunosupresivy. Přestože existují autoři, kteří ji řadí do první linie léčby, v současné době nám chybí údaje, které by ji takto stanovily (tabulka 1).
PULMONÁRNÍ TRANSPLANTACE
Případy, kdy onemocnění progreduje bez odpovědi na léčbu a končí respiračním selháním, jsou u tohoto onemocnění bohužel nejčetnější. V současné době neexistuje pro tyto pacienty jiná možnost léčby než paliativní. V této neutěšené situaci se v 80. letech 20. století objevila možnost transplantace plic, která se vyvinula do té míry, že nyní představuje terapeutickou možnost, o níž by se mělo uvažovat jako o nástroji pro klinické použití a která již není omezena na experimentální oblast. Jeho nejvhodnější indikace je u osob mladších 65 let, u nichž není přítomno progresivní a nezvratné onemocnění jiných orgánů, stejně jako nevyřešená aktivní infekce nebo infekce multirezistentními zárodky. Nutné jsou také odpovídající osobní předpoklady a stav výživy. Pacienti s CPT nižší než 60 % očekávané nebo s difuzní kapacitou plic nižší než 40 % mají přežití kratší než 2 roky. V tomto stupni dysfunkce vyžadují kyslíkovou terapii a snadno se desaturují při minimálním cvičení. V těchto případech je třeba zvážit transplantaci plic, jakmile je nutná léčba kyslíkem a je ověřena nezastavitelná progrese onemocnění. Typem transplantace volby je transplantace jedné plíce, přičemž transplantace dvou plic je vyhrazena pro případy, kdy existují pochybnosti o chování zbytkové plíce. Pokud je pacientovi méně než 50 let a má selhání pravého srdce, lze zvážit transplantaci srdce. V této situaci je však onemocnění velmi pokročilé a je nepravděpodobné, že by vydrželo čekání18,19. Očekává se, že přežití po transplantaci bude v prvním roce 80 % a po 5 letech 50-60 %, což výrazně zlepšuje prognózu pacienta s IPF, který dosáhl respiračního selhání.
VYHODNOCENÍ ODPOVĚDI NA LÉČBU
Při absenci komplikací může trvat až 6 měsíců, než se dostaví jakákoli odpověď na léčbu. Po uplynutí této doby, pokud se stav pacienta zlepšil nebo je stabilní, by se mělo pokračovat ve stejných dávkách. Pokud se zhoršily, měly by být převedeny na alternativní léčbu (jiný imunosupresivní přípravek nebo dokonce transplantace). Po 12 měsících by měl být znovu vyhodnocen stejným způsobem a po 18 měsících individuálně podle reakce. Se recomienda continuar indefinidamente sólo en aquellos pacientes con mejoría continua o estabilización (tabla 2).

Una respuesta favorable se define por dos o más de los siguientes criterios en dos visitas consecutivas:
1. Mejoría de los síntomas, sobre todo en el grado de esfuerzo requerido para que el paciente deba parar cuando hace un esfuerzo o un descenso en la frecuencia o gravedad de la tos.
2. Reducción de las alteraciones radiológicas.
3. Mejoría funcional definida por dos o más de los siguientes parámetros:
Aumento >= 10% en la TLC o CV (o >= 200 ml).
Aumento >= 15% en DLCO o >= 3 ml/min/mmHg.
Mejoría o normalización de la SaO2 o pO2 (aumento >= 4% o >= 4 mmHg) durante un prueba de esfuerzo cardiorrespiratoria.
Una respuesta estable (también considerada favorable) se define por dos o más de los siguientes criterios en dos visitas consecutivas:
1. Cambio de
2. Cambio de
3. Sin cambios en la SaO2 o pO2 (aumento
Un fracaso del tratamiento se define por dos o más de los siguientes criterios en dos visitas consecutivas:
1. Aumento de los síntomas, sobre todo disnea o tos.
2. Aumento de las alteraciones radiológicas, especialmente imágenes en panal o signos de hipertensión pulmonar.
3. Deterioro funcional definido por dos o más de los siguientes parámetros:
Descenso >= 10% en la TLC o CV (o >= 200 ml).
Descenso >= 15% en DLCO o >= 3 ml/min/mmHg.
Zhoršení SaO2 (= 4 %) nebo zvýšení alveolo-arteriálního gradientu (AapO2) (= 4 mmHg) v klidu nebo během kardiorespiračního zátěžového testu.
ZÁVĚRY
Idiopatická plicní fibróza je smrtelné onemocnění bez spontánní remise a se špatnou odpovědí na léčbu. Studie týkající se posledně jmenovaného onemocnění jsou vzácné a zahrnují malý počet pacientů. Kortikosteroidy podávané po dobu nejméně jednoho roku v různých dávkách jsou nejpřijatelnějším režimem, a to samostatně nebo v kombinaci s jinými imunosupresivy. Americká hrudní a Evropská respirační společnost4 v poslední době doporučují kombinovanou léčbu. Zkoumají se látky proti fibróze s cílem zabránit vzniku fibrotického procesu, který by byl nevratný, protože mnoho pacientů je diagnostikováno v pozdních stadiích. Vzhledem k míře přežití a vývoji by měla být transplantace plic zvážena, jakmile u pacientů selže léčba a vyžadují oxygenoterapii. To vše naznačuje, že je třeba provést multicentrické studie s cílem získat dostatečný počet pacientů, aby bylo možné posoudit účinnost podávané léčby a zjistit přirozený průběh onemocnění a skutečnou incidenci a prevalenci4,20. Na druhou stranu se doporučuje identifikovat a zahájit léčbu v časných stadiích onemocnění, aby se dosáhlo vyšší míry přežití.