Identifikujte stavební kameny hmoty
Život se na své nejzákladnější úrovni skládá z hmoty. Hmota je každá látka, která zaujímá prostor a má hmotnost. Prvky jsou jedinečné formy hmoty se specifickými chemickými a fyzikálními vlastnostmi, které nelze běžnými chemickými reakcemi rozložit na menší látky. Existuje 118 prvků, ale v přírodě se jich vyskytuje pouze 92. Zbývající prvky se syntetizují v laboratořích a jsou nestabilní.
Každý prvek se označuje chemickým symbolem, což je jedno velké písmeno nebo, pokud je první písmeno již „obsazeno“ jiným prvkem, kombinace dvou písmen. Některé prvky se řídí anglickým výrazem pro daný prvek, například C pro uhlík a Ca pro vápník. Chemické symboly jiných prvků jsou odvozeny od jejich latinských názvů, například symbol pro sodík je Na, což odkazuje na latinské slovo natrium.
Čtyři prvky společné všem živým organismům jsou kyslík (O), uhlík (C), vodík (H) a dusík (N). V neživé přírodě se prvky vyskytují v různém poměru a některé prvky společné pro živé organismy jsou na Zemi jako celku poměrně vzácné, jak ukazuje tabulka 1. Například atmosféra je bohatá na dusík a kyslík, ale obsahuje málo uhlíku a vodíku, zatímco zemská kůra, přestože obsahuje kyslík a malé množství vodíku, má málo dusíku a uhlíku. Navzdory rozdílům v jejich množství se všechny prvky a chemické reakce mezi nimi řídí stejnými chemickými a fyzikálními zákony bez ohledu na to, zda jsou součástí živého nebo neživého světa.
| Tabulka 1. Jaké jsou rozdíly v množství prvků? Approximate Percentage of Elements in Living Organisms (Humans) Compared to the Non-living World | |||
|---|---|---|---|
| Element | Life (Humans) | Atmosphere | Earth’s Crust |
| Oxygen (O) | 65% | 21% | 46% |
| Carbon (C) | 18% | trace | trace |
| Hydrogen (H) | 10% | trace | 0.1% |
| Nitrogen (N) | 3% | 78% | trace |
Learning Objectives
- Draw a diagram of an atom, according to current scientific understanding
- Understand the periodic table of elements and how to use it to understand elements
- Describe the behavior and location of electrons, a jak tyto faktory ovlivňují vznik vazeb mezi atomy
Atomy
Struktura atomu
Chceme-li pochopit, jak se prvky spojují, musíme nejprve probrat nejmenší součástku nebo stavební kámen prvku, atom. Atom je nejmenší jednotka hmoty, která si zachovává všechny chemické vlastnosti prvku. Například jeden atom zlata má všechny vlastnosti zlata v tom smyslu, že je při pokojové teplotě pevným kovem. Zlatá mince je jednoduše velmi velké množství atomů zlata vytvarovaných do tvaru mince a obsahujících malé množství dalších prvků známých jako příměsi. Atomy zlata nelze rozložit na nic menšího a přitom si zachovat vlastnosti zlata.
Atom se skládá ze dvou oblastí: jádra, které se nachází uprostřed atomu a obsahuje protony a neutrony, a nejvzdálenější oblasti atomu, v níž se na oběžné dráze kolem jádra nacházejí elektrony, jak je znázorněno na obrázku 1. Na obrázku 1 je znázorněno, že atom se skládá ze dvou částí. Atomy obsahují kromě jiných subatomárních částic také protony, elektrony a neutrony. Jedinou výjimkou je vodík (H), který se skládá z jednoho protonu a jednoho elektronu bez neutronů.

Obrázek 1. Prvky, jako je zde vyobrazené helium, se skládají z atomů. Atomy se skládají z protonů a neutronů umístěných v jádře a elektronů v orbitalech obklopujících jádro.
Protony a neutrony mají přibližně stejnou hmotnost, asi 1,67 × 10-24 gramů. Vědci toto množství hmotnosti libovolně definují jako jednu atomovou hmotnostní jednotku (amu) nebo jeden dalton, jak je uvedeno v tabulce 1. Ačkoli mají protony a neutrony podobnou hmotnost, liší se svým elektrickým nábojem. Proton je kladně nabitý, zatímco neutron je bez náboje. Proto se počet neutronů v atomu významně podílí na jeho hmotnosti, ale ne na jeho náboji. Elektrony mají mnohem menší hmotnost než protony, váží pouze 9,11 × 10-28 gramů, tedy asi 1/1800 atomové hmotnostní jednotky. Proto se na celkové atomové hmotnosti prvku příliš nepodílejí. Proto se při posuzování atomové hmotnosti obvykle ignoruje hmotnost všech elektronů a hmotnost atomu se vypočítá pouze na základě počtu protonů a neutronů. Přestože se elektrony na hmotnosti atomu významně nepodílejí, mají velký podíl na jeho náboji, protože každý elektron má záporný náboj rovnající se kladnému náboji protonu. V nenabitých, neutrálních atomech se počet elektronů obíhajících kolem jádra rovná počtu protonů uvnitř jádra. In these atoms, the positive and negative charges cancel each other out, leading to an atom with no net charge.
Accounting for the sizes of protons, neutrons, and electrons, most of the volume of an atom—greater than 99 percent—is, in fact, empty space. With all this empty space, one might ask why so-called solid objects do not just pass through one another. The reason they do not is that the electrons that surround all atoms are negatively charged and negative charges repel each other.
| Table 1. Protons, Neutrons, and Electrons | |||
|---|---|---|---|
| Charge | Mass (amu) | Location | |
| Proton | +1 | 1 | nucleus |
| Neutron | 0 | 1 | jádro |
| Elektron | -1 | 0 | orbitální |
Atomové číslo a hmotnost
Atomy každého prvku obsahují charakteristický počet protonů a elektronů. Počet protonů určuje atomové číslo prvku a slouží k rozlišení jednoho prvku od druhého. Počet neutronů je proměnlivý, což vede ke vzniku izotopů, což jsou různé formy téhož atomu, které se liší pouze počtem neutronů, které mají. Počet protonů a počet neutronů společně určují hmotnostní číslo prvku, jak je znázorněno na obrázku 2. Všimněte si, že malý příspěvek hmotnosti elektronů se při výpočtu hmotnostního čísla nebere v úvahu. Tuto aproximaci hmotnosti lze snadno použít k výpočtu počtu neutronů, které prvek má, a to prostým odečtením počtu protonů od hmotnostního čísla. Protože izotopy prvku budou mít mírně odlišná hmotnostní čísla, vědci také určují atomovou hmotnost, která je vypočteným průměrem hmotnostního čísla pro jeho přirozeně se vyskytující izotopy. Výsledné číslo často obsahuje zlomek. Například atomová hmotnost chloru (Cl) je 35,45, protože chlor se skládá z několika izotopů, z nichž některé (většina) mají atomovou hmotnost 35 (17 protonů a 18 neutronů) a některé atomovou hmotnost 37 (17 protonů a 20 neutronů).
Praktická otázka
Uhlík má atomové číslo šest a dva stabilní izotopy s hmotnostními čísly dvanáct a třináct. Jeho atomová hmotnost je 12,11.

Obrázek 2. Uhlík má atomové číslo šest a dva stabilní izotopy. Uhlík-12 a uhlík-13
Kolik neutronů má uhlík-12, respektive uhlík-13?
Periodická tabulka prvků
Různé prvky jsou uspořádány a zobrazeny v periodické tabulce. Tabulku vymyslel ruský chemik Dmitrij Mendělejev (1834-1907) v roce 1869 a seskupuje v ní prvky, které jsou sice jedinečné, ale sdílejí určité chemické vlastnosti s jinými prvky. Vlastnosti prvků jsou zodpovědné za jejich fyzikální stav při pokojové teplotě: mohou to být plyny, pevné látky nebo kapaliny. Prvky mají také specifickou chemickou reaktivitu, schopnost se vzájemně slučovat a chemicky se vázat.
V periodické tabulce, zobrazené na obrázku 3, jsou prvky uspořádány a zobrazeny podle svého atomového čísla a jsou uspořádány do řady řádků a sloupců na základě společných chemických a fyzikálních vlastností. Kromě uvedení atomového čísla každého prvku zobrazuje periodická tabulka také jeho atomovou hmotnost. Například u uhlíku se zobrazí jeho symbol (C) a název, atomové číslo šest (v levém horním rohu) a atomová hmotnost 12,11.

Obrázek 3. Periodická tabulka zobrazuje atomovou hmotnost a atomové číslo každého prvku. Atomové číslo je uvedeno nad symbolem prvku a přibližná atomová hmotnost je uvedena pod ním.
Periodická tabulka seskupuje prvky podle chemických vlastností. Rozdíly v chemické reaktivitě mezi prvky jsou založeny na počtu a prostorovém rozložení elektronů atomu. Atomy, které spolu chemicky reagují a vážou se, tvoří molekuly. Molekuly jsou jednoduše dva nebo více atomů chemicky spojených dohromady. Je logické, že když se dva atomy chemicky spojí a vytvoří molekulu, jejich elektrony, které tvoří nejvzdálenější oblast každého atomu, se při vytváření chemické vazby spojí jako první.
Podívejte se na toto video, které vás podrobněji seznámí s periodickou tabulkou:
Elektrony
Elektronové slupky a Bohrův model

Obrázek 4. Bohrův model.
Je třeba zdůraznit, že existuje souvislost mezi počtem protonů v prvku, atomovým číslem, které odlišuje jeden prvek od druhého, a počtem elektronů, které má. Ve všech elektricky neutrálních atomech je počet elektronů stejný jako počet protonů. Každý prvek, alespoň pokud je elektricky neutrální, má tedy charakteristický počet elektronů rovný svému atomovému číslu.
Raný model atomu vypracoval v roce 1913 dánský vědec Niels Bohr (1885-1962). V tomto modelu elektrony existují v hlavních slupkách. Elektron obvykle existuje v slupce s nejnižší dostupnou energií, která je nejblíže jádru. Energie z fotonu světla jej může posunout do vyšší energetické slupky, ale tato situace je nestabilní a elektron se rychle rozpadá zpět do základního stavu. Přitom se uvolní foton světla.
Bohrův model znázorňuje atom jako centrální jádro obsahující protony a neutrony, přičemž elektrony se nacházejí na kruhových orbitalech v určitých vzdálenostech od jádra, jak je znázorněno na obrázku 4. Tyto orbity tvoří elektronové slupky nebo energetické hladiny, které jsou způsobem vizualizace počtu elektronů ve vnějších slupkách. Tyto energetické hladiny se označují číslem a symbolem „n“. Například 1n představuje první energetickou hladinu nacházející se nejblíže jádru.
Elektrony zaplňují orbitaly v důsledném pořadí: nejprve zaplňují orbitaly nejblíže jádru, poté pokračují v zaplňování orbitalů s rostoucí energií dále od jádra. Pokud existuje více orbitalů se stejnou energií, vyplní je v každé energetické hladině jeden elektron, než se přidá druhý elektron. Elektrony nejvzdálenější energetické hladiny určují energetickou stabilitu atomu a jeho tendenci vytvářet chemické vazby s jinými atomy za vzniku molekul.
Za standardních podmínek atomy nejprve zaplní vnitřní slupky, což často vede k proměnlivému počtu elektronů ve vnější slupce. Nejvnitřnější slupka má maximálně dva elektrony, ale další dvě elektronové slupky mohou mít každá maximálně osm elektronů. To je známé jako pravidlo oktetu, které říká, že s výjimkou nejvnitřnější slupky jsou atomy energeticky stabilnější, když mají osm elektronů ve své valenční slupce, nejvzdálenější elektronové slupce. Příklady některých neutrálních atomů a jejich elektronových konfigurací jsou uvedeny na obrázku 5. Všimněte si, že na tomto obrázku má helium úplnou vnější elektronovou slupku, jejíž první a jedinou slupku vyplňují dva elektrony. Podobně má neon úplný vnější obal 2n obsahující osm elektronů. Naproti tomu chlor a sodík mají ve svých vnějších slupkách sedm, resp. jeden elektron, ale teoreticky by byly energeticky stabilnější, kdyby se řídily pravidlem oktetu a měly jich osm.
Praktická otázka
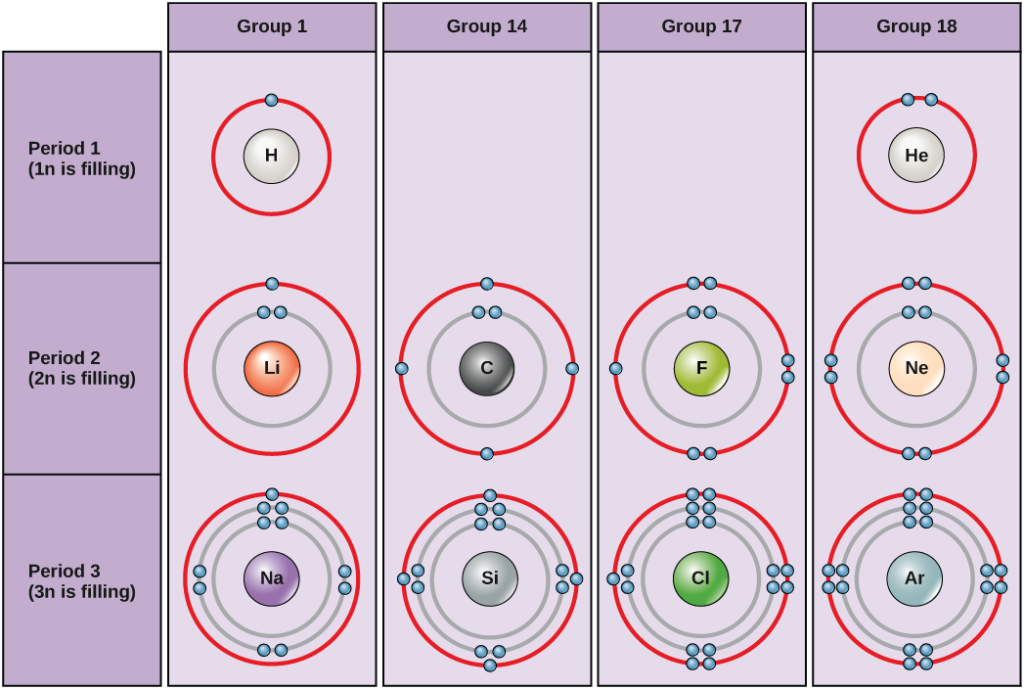
Obrázek 5. Bohrovy diagramy pro vodík, helium, lithium, uhlík, fluor, neon, sodík, křemík, chlor a argon.
Bohrovy diagramy udávají, kolik elektronů vyplňuje každou hlavní slupku. Prvky skupiny 18 (helium, neon a argon jsou zobrazeny na obrázku 5) mají plnou vnější neboli valenční slupku. Plná valenční slupka je nejstabilnější elektronová konfigurace. Prvky v ostatních skupinách mají částečně zaplněné valenční slupky a pro dosažení stabilní elektronové konfigurace elektrony získávají nebo ztrácejí.
Atom může elektrony odevzdat, přijmout nebo sdílet s jiným atomem, aby dosáhl plné valenční slupky, tedy nejstabilnější elektronové konfigurace. Když se podíváte na tento obrázek, kolik elektronů musí prvky skupiny 1 ztratit, aby dosáhly stabilní elektronové konfigurace? Kolik elektronů musí získat prvky ve skupinách 14 a 17, aby dosáhly stabilní konfigurace?
Poznat, že uspořádání periodické tabulky je založeno na celkovém počtu protonů (a elektronů), nám pomůže zjistit, jak jsou elektrony rozděleny mezi vnější obaly. Periodická tabulka je uspořádána do sloupců a řádků podle počtu elektronů a podle toho, kde se tyto elektrony nacházejí. Podívejte se blíže na některé prvky v pravém sloupci periodické tabulky na obrázku 3.
Atomy helia (He), neonu (Ne) a argonu (Ar) ze skupiny 18 mají zaplněné vnější elektronové obaly, takže pro dosažení stability není nutné, aby sdílely elektrony s jinými atomy; jako samostatné atomy jsou vysoce stabilní. Jejich nereaktivita vedla k jejich pojmenování inertní plyny (nebo vzácné plyny). Porovnejte je s prvky 1. skupiny v levém sloupci. Všechny tyto prvky, včetně vodíku (H), lithia (Li) a sodíku (Na), mají ve svých vnějších slupkách jeden elektron. To znamená, že mohou dosáhnout stabilní konfigurace a zaplněné vnější slupky tím, že darují nebo sdílejí jeden elektron s jiným atomem nebo molekulou, například s vodou. Vodík daruje nebo sdílí svůj elektron, aby dosáhl této konfigurace, zatímco lithium a sodík darují svůj elektron, aby se staly stabilními. V důsledku ztráty záporně nabitého elektronu se z nich stanou kladně nabité ionty. Prvky 17. skupiny, včetně fluoru a chloru, mají ve svých krajních slupkách sedm elektronů, takže mají tendenci zaplnit tuto slupku elektronem z jiných atomů nebo molekul, čímž se stávají záporně nabitými ionty. Prvky skupiny 14, z nichž je pro živé systémy nejdůležitější uhlík, mají ve své vnější slupce čtyři elektrony, což jim umožňuje vytvářet s jinými atomy několik kovalentních vazeb (o nichž pojednáváme níže). Sloupce periodické tabulky tedy představují potenciální společný stav vnějších elektronových obalů těchto prvků, který je zodpovědný za jejich podobné chemické vlastnosti.
Elektronové orbitaly
Ačkoli je Bohrův model atomu užitečný pro vysvětlení reaktivity a chemických vazeb některých prvků, neodráží přesně, jak jsou elektrony prostorově rozloženy kolem jádra. Neobíhají kolem jádra jako Země kolem Slunce, ale nacházejí se v elektronových orbitalech. Tyto poměrně složité tvary vyplývají ze skutečnosti, že elektrony se chovají nejen jako částice, ale také jako vlny. Matematické rovnice z kvantové mechaniky známé jako vlnové funkce mohou s určitou mírou pravděpodobnosti předpovědět, kde se elektron v daném okamžiku může nacházet. Oblast, kde se elektron s největší pravděpodobností nachází, se nazývá jeho orbital.

Obrázek 6. Podslupka 2np se skládá ze tří činek, které vyzařují ze středu atomu. Kliknutím získáte větší obrázek. Podslupky s mají tvar koule. Obě hlavní slupky 1n i 2n mají orbital s, ale velikost koule je u orbitalu 2n větší. Každá sféra je jeden orbital. p podpouzdra jsou tvořena třemi orbitaly ve tvaru činky. Hlavní slupka 2n má podslupku p, ale slupka 1 ji nemá.
Připomeňte si, že Bohrův model znázorňuje konfiguraci elektronových slupek atomu. Uvnitř každé elektronové slupky jsou podslupky a každá podslupka má určitý počet orbitalů obsahujících elektrony. I když není možné přesně vypočítat, kde se elektron nachází, vědci vědí, že se s největší pravděpodobností nachází v rámci své orbitální dráhy. Podpouzdra se označují písmeny s, p, d a f. Podpouzdro s má kulový tvar a jeden orbital. Hlavní slupka 1n má pouze jeden orbital s, který může obsahovat dva elektrony. Hlavní slupka 2n má jednu s a jednu p podslupku a může obsahovat celkem osm elektronů. Podpouzdro p má tři orbitaly ve tvaru činky, jak je znázorněno na obrázku 6. Podpouzdra d a f mají složitější tvary a obsahují pět, resp. sedm orbitalů. Ty nejsou na obrázku znázorněny. Hlavní slupka 3n má slupky s, p a d a může obsahovat 18 elektronů. Hlavní slupka 4n má orbitaly s, p, d a f a může obsahovat 32 elektronů. Směrem od jádra se počet elektronů a orbitalů nacházejících se v energetických hladinách zvyšuje. Postupujeme-li od jednoho atomu k dalšímu v periodické tabulce, můžeme elektronovou strukturu vypracovat tak, že do dalšího volného orbitalu umístíme další elektron.
Orbital nejblíže jádru, nazývaný 1s, může pojmout až dva elektrony. Tento orbital odpovídá nejvnitřnějšímu elektronovému obalu Bohrova modelu atomu. Nazývá se 1s orbital, protože je kulový kolem jádra. Orbital 1s je nejblíže jádru a je vždy zaplněn jako první, dříve než může být zaplněn jakýkoli jiný orbital. Vodík má jeden elektron, proto má v orbitalu 1s obsazeno pouze jedno místo. To se označuje jako 1s1, kde horní index 1 označuje jeden elektron v orbitalu 1s. Helium má dva elektrony, proto může orbital 1s zcela zaplnit svými dvěma elektrony. Označuje se jako 1s2, což znamená dva elektrony helia v orbitalu 1s. Na obrázku 6 periodické tabulky jsou vodík a helium jedinými dvěma prvky v prvním řádku (periodě); je to proto, že mají elektrony pouze ve své první slupce, orbitalu 1s. Vodík a helium jsou jediné dva prvky, které mají v elektricky neutrálním stavu orbital 1s a žádné další elektrony.
Druhý elektronový obal může obsahovat osm elektronů. Tato slupka obsahuje další sférický s orbital a tři p orbitaly ve tvaru „činky“, z nichž každý může obsahovat dva elektrony, jak je znázorněno na obrázku 6. Po zaplnění orbitalu 1s se zaplní druhá elektronová slupka, přičemž se nejprve zaplní její orbital 2s a poté její tři orbitaly p. Při zaplňování p orbitalů přijímá každý z nich jeden elektron; jakmile má každý p orbital elektron, může být přidán druhý. Lithium (Li) obsahuje tři elektrony, které obsazují první a druhou slupku. Dva elektrony vyplňují orbital 1s a třetí elektron pak vyplňuje orbital 2s. Jeho elektronová konfigurace je 1s22s1. Naproti tomu neon (Ne) má celkem deset elektronů: dva jsou v jeho nejvnitřnějším orbitalu 1s a osm vyplňuje jeho druhou slupku (po dvou v orbitalech 2s a třech p); je tedy inertním plynem a energeticky stabilní jako jediný atom, který jen zřídka vytvoří chemickou vazbu s jinými atomy. Větší prvky mají další orbitaly, které tvoří třetí elektronový obal. Ačkoli pojmy elektronový obal a orbitaly spolu úzce souvisejí, orbitaly poskytují přesnější zobrazení elektronové konfigurace atomu, protože orbitální model specifikuje různé tvary a speciální orientace všech míst, která mohou elektrony zaujímat.
Podívejte se na tuto vizuální animaci a prohlédněte si prostorové uspořádání p a s orbitalů. Note that this video has no audio.
Video Review
This video gives another overview of the electron:
Check Your Understanding
Answer the question(s) below to see how well you understand the topics covered in the previous section. This short quiz does not count toward your grade in the class, and you can retake it an unlimited number of times.
Use this quiz to check your understanding and decide whether to (1) study the previous section further or (2) move on to the next section.