Elektrolyt je chemická sloučenina, která disociuje na ionty, a je tedy schopna přenášet elektrický náboj – tj. elektrolyt je elektrický vodič; na rozdíl od kovů není tok náboje tokem elektronů, ale pohybem iontů.
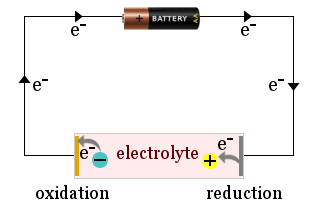
Na obrázku je například znázorněna domácí baterie, která slouží k přitahování iontů elektrolytu k elektrodám elektrochemického článku, kde ionty získávají elektrony (jsou redukovány) nebo ztrácejí elektrony (jsou oxidovány).
Někdy reagují i samotné elektrody, například kovová elektroda může být oxidována a uvolňovat ionty do elektrolytu.
Elektrolyty mohou být pevné látky, kapaliny nebo roztoky.
Příklady elektrolytů
1. Elektrolyt může být v pevném stavu, v kapalině nebo v roztoku. Roztavený chlorid sodný slouží jako elektrolyt při výrobě kovového sodíku. Vzniká také plynný chlor.
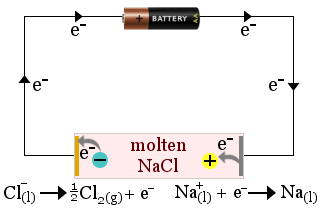 V tomto případě se elektrolyt spotřebovává při redoxních reakcích článku.
V tomto případě se elektrolyt spotřebovává při redoxních reakcích článku.
2. Hydroxid draselný rozpuštěný ve vodě vytváří vysoce vodivý elektrolyt v Edisonově článku, raném dobíjecím článku.
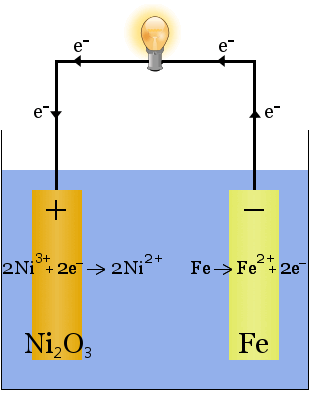
Na rozdíl od výše uvedeného případu výroby sodíku se při této reakci nespotřebovává žádný elektrolyt, úlohou hydroxidu draselného je v tomto případě zvýšit dostupnost iontů pro zvýšení vodivosti elektrolytu a dokončení elektrického obvodu.
Chemické rovnice pro reakce na elektrodách jsou následující:
Pro vybíjení se rovnice čtou zleva doprava; pro nabíjení zprava doleva.
3. Tradičně byly elektrolyty kapalné, aby umožňovaly pohyb iontů. nyní jsou však k dispozici pevné materiály, které umožňují snadný pohyb iontů svou strukturou. pevné elektrolyty jsou žádoucí v mnoha spotřebních výrobcích, protože netečou.
Sulfid cínato-cíničitý, Li10SnP2S12, je pevný elektrolyt pro použití v lithium-iontových bateriích. krystalická struktura pevného elektrolytu v kombinaci s jeho slabou interakcí s ionty lithia poskytuje prostředí, kterým mohou ionty lithia snadno proskakovat.
4. Elektrolyty jsou nesmírně důležité pro elektrochemické procesy v živých organismech.Hlavními ionty těchto elektrolytů jsou vápník (Ca2+), hořčík (Mg2+), sodík (Na+), draslík (K+), chlorid (Cl-), hydrogenuhličitan (HCO3-) a hydrogenfosforečnan (HPO42-).
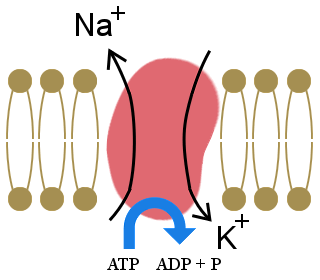
The importance of the sodium-potassium pump, shown in the diagram, to our lives is illustrated by the fact that it uses one-third of our resting energy.The pump maintains our cells‘ electrolyte balance, with excess potassium ions inside cells and excess sodium ions outside cells.
This concentration gradient creates a voltage across the cell wall, which allows electrical signals to be transmitted in neurons and in muscles.It also provides the energy for processes in cell-membranes.
