Přírodní únik z genetického vězení
Post translační modifikace:
Jak posttranslační modifikace funguje?
Nejčastější posttranslační modifikace
Vliv posttranslačních modifikací na zdraví a nemoci
Krátký přehled
Co znamená PTM?
Buňky musí detekovat změny vnitřních a vnějších podmínek a reagovat na ně. Jednou z metod používaných k přizpůsobení se těmto změnám je chemická modifikace proteinů. Podmíněné chemické změny jsou přenášeny od senzorů k efektorům prostřednictvím reverzibilních posttranslačních modifikací (PTM) proteinů. PTM hrají důležitou roli při úpravě konečného produktu exprese, přispívají k biologickým procesům a chorobným stavům a hrají klíčovou roli v mnoha buněčných procesech, jako je buněčná diferenciace (1), degradace proteinů, signalizační a regulační procesy, regulace genové exprese a interakce protein-protein (2,3).
Jak funguje posttranslační modifikace?
PTM může probíhat v kterémkoli kroku životnosti proteinu. Mnoho proteinů je modifikováno krátce po dokončení translace, aby se zprostředkovalo správné skládání nebo aby se vznikající protein nasměroval do odlišných buněčných míst (například do jádra nebo membrány). K dalším modifikacím dochází po dokončení skládání a lokalizace za účelem aktivace nebo inaktivace katalytické aktivity. Proteiny jsou také kovalentně spojeny se značkami, které cílí protein k degradaci. Jsou modifikovány kombinací posttranslačního štěpení a přidávání funkčních skupin prostřednictvím postupného mechanismu zrání nebo aktivace proteinu.
Kde dochází k posttranslační modifikaci? PTM se vyskytují na odlišných postranních řetězcích aminokyselin nebo peptidových vazbách a jsou nejčastěji zprostředkovány enzymatickou aktivitou. Ve skutečnosti 5 % proteomu tvoří enzymy, které provádějí více než 200 typů PTM (4). Mezi tyto enzymy patří kinázy, fosfatázy, transferázy a ligázy, které přidávají nebo odstraňují funkční skupiny, proteiny, lipidy nebo cukry k postranním řetězcům aminokyselin nebo z nich, a proteázy, které štěpí peptidové vazby za účelem odstranění specifických sekvencí nebo regulačních podjednotek. Mnoho proteinů se také může modifikovat pomocí autokatalytických domén, jako jsou autokinázy a autoprotolytické domény. PTM mohou být také reverzibilní na základě povahy modifikace. Jako příklad lze uvést fosfatázy, které hydrolyzují fosfátovou skupinu, čímž ji odstraní z proteinu a zvrátí jeho biologickou aktivitu (obrázek 1).
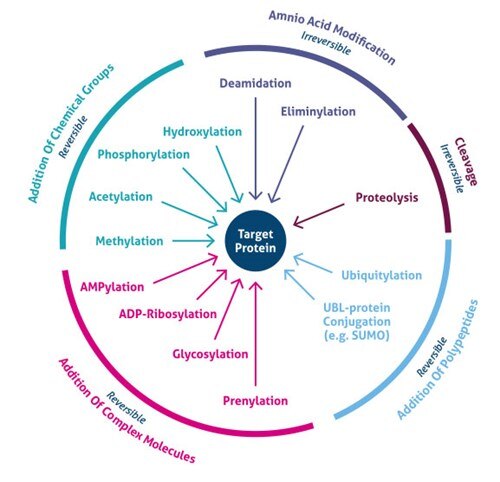
Obr. 1. Typy posttranslačních modifikací (PTM).
Nejčastější posttranslační modifikace
Nedávný vývoj metod hmotnostní spektrometrie (MS) umožnil identifikovat tisíce míst PTM. Následně nové strategie obohacování odhalily globální buněčný význam několika typů modifikací (např. acetylace, ubikvitace, O-GlNac, N-vázaná glykosylace). V současné době je známo více než 200 různých typů PTM (5,6), od malých chemických modifikací (např. fosforylace a acetylace) až po přidání celých proteinů (např. ubikvitalizace, obr. 3).
Fosforylace
Fosforylace proteinů (obr. 2) je nejčastěji studovanou posttranslační modifikací. Odhaduje se, že jedna třetina savčích proteinů může být fosforylována, a tato modifikace často hraje klíčovou roli při modulaci funkce proteinů. Fosforylace probíhá na serinových, threoninových a tyrosinových zbytcích a působí na regulaci funkce proteinů, enzymatické aktivity, interakcí protein-protein a lokalizace proteinů. Fosforylace je katalyzována fosfatázami a může být reverzibilní – fosforylované proteiny mohou být defosforylovány proteindefosfatázami.
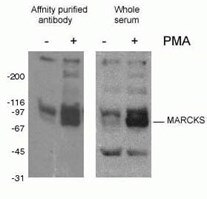
Obrázek 2. Výsledek WB s protilátkou fosfo-Marcks (10018-3-AP, 1:1500) s buňkami myších makrofágů J774 ošetřenými PMA.
Glykosylace a glykanizace
Většina proteinů, které jsou syntetizovány na ribozomech spojených s endoplazmatickým retikulem, podléhá glykosylaci. To znamená, že k polypeptidovému řetězci je přidána kovalentní vazba cukerných částí. Dva nejběžnější typy glykosylace u eukaryot jsou N-vázaná glykosylace – na asparagin a O-vázaná glykosylace – na serin a treonin.
Ubikvitinace
Ubikvitinace proteinů znamená, že se kovalentní ubikvitin přidává na lysin, cystein, serin, threonin nebo přímo na N-konec proteinu. Ubikvitin je malý (+/-8,6 kDa) protein exprimovaný téměř ve všech typech tkání (obrázek 3). Ubikvitinace je enzymatická reakce katalyzovaná kaskádou tří enzymů (E1, E2 a E3). Ta zajišťuje substrátovou specifitu a aktivační, konjugační a ligační kroky. Proteiny mohou být monoubikvitinované (s jednou molekulou ubikvitinu) nebo polyubikvitinované. Polyubikvitinace probíhá, když se k původní molekule ubikvitinu přidají další molekuly ubikvitinu. Ubikvitinace prostřednictvím proteomu může označit proteiny určené k degradaci. Je také důležitá pro buněčnou signalizaci, internalizaci membránových proteinů , vývoj a regulaci transkripce.

Obrázek 3. Buňky MDA-MB-453s byly podrobeny SDS PAGE s následným western blotem s 10201-2-AP (protilátka proti ubikvitinu) v ředění 1:600.
Vliv PTM na zdraví a nemoci
Analýza proteinů a jejich PTM je důležitá zejména pro studium srdečních onemocnění, rakoviny, neurodegenerativních onemocnění a diabetu (7). Hlavním problémem při studiu posttranslačně modifikovaných proteinů je vývoj specifických metod detekce a purifikace. Tyto technické překážky se naštěstí daří překonávat pomocí řady nových a zdokonalených proteomických technologií.
- Chemická biologie: převlečené proteiny.
- Koncepty v sumoylaci: o deset let dál.
- Proteomická analýza v neurovědách.
- Role posttranslačních modifikací v kontextu interakčních sítí proteinů
- Dešifrování globální sítě funkčně souvisejících posttranslačních modifikací.
- PTMcode: a database of known and predicted functional associations between post-translational modifications in proteins.
- Citrullination: a posttranslational modification in health and disease.
