Daratumumab (DARA) ist ein Medikament, das vor kurzem von der FDA zugelassen und von Janssen für die Behandlung des multiplen Myeloms patentiert wurde. Bei diesem Medikament handelt es sich um einen lgG1k-CD38-gerichteten monoklonalen Antikörper (MoAb), der in Myelomzellen exprimiert wird; er ist hochgradig zytotoxisch für die Tumorzellen dieser Patienten.1-4 Das Vorhandensein des CD38-Antigens auf der Oberfläche der Erythrozyten gesunder Personen wurde ebenfalls durchflusszytometrisch nachgewiesen.5 Darüber hinaus wurde im Plasma von Patienten, die mit DARA behandelt wurden, bei routinemäßigen Kompatibilitätstests eine Panreaktivität festgestellt.6 Dies ist ein neues Problem in der Transfusionsmedizin, das die rechtzeitige Bereitstellung von Blutkomponenten verzögert und somit eine potenzielle Gefahr für das Leben des Patienten darstellt. Da es sich um ein neues Thema handelt, sehen die technischen Verfahrenshandbücher (z.B. der AABB) keine spezifische Methodik für die Lösung dieser Art von Problemen vor.
Seit über 20 Jahren werden rote Blutkörperchen, die mit dem Redoxmittel Dithiothreitol (DDT) behandelt wurden, üblicherweise verwendet, um das Kell-Antigen sowie andere, klinisch weniger bedeutsame Antigengruppen als Folge einer hämolytischen Transfusionsreaktion zu denaturieren. Dies ist in den Fällen von Landsteiner-Wiener, Cartwright, Dombrock, Indian, Jhon Milton Hagen, Lutheran und Raph zu beobachten. Diese Eigenschaft ist bei der Erforschung von Autoantikörpern nützlich (technisches Handbuch der AABB).7,8
In jüngster Zeit wurde nachgewiesen, dass das CD38-Antigen auch empfindlich auf die Denaturierung durch das Redoxmittel Dithiothreitol (DDT) reagiert,9 ohne dass die übrigen klinisch bedeutsamen Erythrozytenantigene davon betroffen sind. Unter den Möglichkeiten zur Beseitigung der Störung wenden wir die DTT-Technik an, mit der wir das Vorhandensein von klinisch bedeutsamen Antikörpern nachweisen und so Blutkomponenten mit einem geringeren Transfusionsrisiko für den Patienten bereitstellen können.
Material und Methoden
Die Blutbank des Zambrano-Hellion-Krankenhauses erhielt eine Transfusionsanforderung von 2 Einheiten Globuli und 4 Thrombozytenkonzentraten. Der Patient, ein 64-jähriger Mann ohne Transfusionen in seiner Vorgeschichte, hatte die Diagnose Multiples Myelom mit einer vierjährigen Entwicklung und war resistent gegen konventionelle medizinische Behandlung. Venöses Blut wurde mit EDTA abgenommen. Die Proben wurden mit den in der Blutbank üblichen Methoden und Techniken (z. B. Mikroagglutinationstechniken in Gel) auf Routineuntersuchungen vor einer Transfusion untersucht. ABO-Blutgruppenstudien und Rhesus wurden mit Grifols-Karten durchgeführt.
Für die irreguläre Antikörperverfolgung und -identifizierung verwendeten wir ein komplettes Grifols Erythrozyten-Panel sowie Grifols DG Gel Coombs-Säulen. Zusätzlich wurden Kreuzprobe-Tests vor der Transfusion gemäß der in der DG Coombs-Beilage beschriebenen Technik (Antihumanglobulin poly-spezifisch) für die Behandlung von Erythrozyten mit Dithiothreitol (DTT) bei 0,2 M, pH 8, unter Verwendung der 4.6 des technischen Handbuchs der ABB (12. Ausgabe der allgemeinen Labormethoden)8 (siehe Abb. 1).
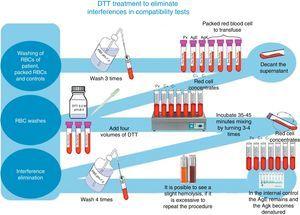
DTT-Behandlung zur Eliminierung von Interferenzen in Kompatibilitätstests.
Ergebnisse
Das Plasma des Patienten zeigte eine Pan-Reaktivität mit den Panel-Erythrozyten und bekannten Antigenen, die ein Reaktionsmuster mit einer 3+ Intensität (Grad 0-4) homogen zeigten (siehe Abb. 2).
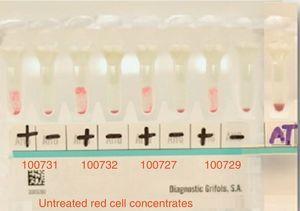
Main cross matching test with 4 donors resulted in incompatibility. Positive=main crossmatching (+), negative=minor crossmatching (−), AT=auto-control crossmatch.
The main cross-matching test resulted in incompatibility with all studied donors (15 in total).
The patient’s erythrocytes presented a negative direct anti-human globulin test (IgG and C3b), as well as a negative control. The presence of hemolysis in the patient’s sample was not detected (see Fig. 3).

Results direct anti-human globulin test (IgG and C3b) presenting negative results.
Bei der Durchführung der Tests mit dem Plasma des Patienten und den zuvor mit DTT behandelten Erythrozyten der verschiedenen Spender sowie denjenigen, die im Antikörper-Screening-Panel verwendet wurden, haben wir in keiner der untersuchten Proben eine Reaktivität festgestellt. K+- und E+-Kontroll-Erythrozyten wurden verwendet, um zu überprüfen, dass DTT nur das K-Antigen denaturiert und das E-Antigen erhalten bleibt; dies war Teil der Qualitätskontrolle unserer Studie, um festzustellen, dass andere Antigene, die mit klinisch bedeutsamen Antikörpern in Verbindung stehen, inaktiv sind (siehe Abb. 4).

Antikörper-Screening-Panel Erythrozyten DTT bedroht, zeigt negative Ergebnisse bei 4 Blutspendern. C1 (Kontrolle positiv) C2 (Kontrolle negativ).
Diskussion
Der Einsatz von Anti-CD38 ist eine vielversprechende Behandlung für Patienten mit multiplem Myelom und wird derzeit auch für andere Arten von bösartigen Neubildungen untersucht. Das Problem besteht darin, dass dieses Medikament die Kompatibilitätstests stört und damit die rechtzeitige und sichere Lieferung von Blutkomponenten erschwert.
Es gibt Hinweise darauf, dass das Anti-CD38 im Serum von mit DARA behandelten Patienten an das CD38-Antigen bindet, das in den Erythrozyten exprimiert wird, die im Antikörper-Tracking-Panel verwendet werden, sowie in den Spendern des Kreuzprobe-Tests vor der Transfusion, wodurch eine Pan-Reaktivität entsteht. Dies kann das Vorhandensein klinisch signifikanter Antikörper verdecken, insbesondere bei Mehrgebärenden oder mehrfach transfundierten Patienten. Diese Pan-Reaktivität kann durch die Verwendung von Neutralisierungsmitteln aufgehoben werden, die eine unregelmäßige Antikörperidentifizierung und Tracking-Tests wiederherstellen. Anti-Idiotyp-Antikörper sowie lösliches rekombinantes CD38 wurden in früheren Artikeln mit positiven Ergebnissen bewertet.
Von den verfügbaren Möglichkeiten, diese Störung in der Blutbank zu beseitigen, haben wir die DDT-Technik verwendet. Ihre beste Eigenschaft ist die Tatsache, dass es sich um ein Redoxmittel handelt, das die Tertiärstruktur des Proteins unterbricht, indem es Disulfidbindungen irreversibel zu freiem Sulfhydryl reduziert. Ohne Tertiärstruktur können die proteinhaltigen Antigene keine Antikörper mehr binden, wodurch die serologische Reaktivität gehemmt wird. Ein potenzielles Problem bei dieser Technik ist, dass sie auch andere Blutgruppenantigene beeinträchtigt. In der täglichen Praxis ist jedoch nur das K-Antigen von klinischer Bedeutung. Daher wird empfohlen, dass Patienten, die mit DARA behandelt werden, nur mit K-Erythrozytenkonzentraten transfundiert werden. Die Möglichkeit, die Reaktivität auf andere Erreger wie K und Yta zu verlieren, ist ebenfalls gegeben. Dies ist jedoch ein äußerst seltenes Ereignis. DDT deaktiviert nicht die serologische Aktivität der meisten klinisch bedeutsamen und häufigen Antigene wie Rh-, Duffy-, Kidd- und MNS-Systeme. Es ist ratsam, vor Beginn der Behandlung mit DARA den Phänotyp oder Genotyp des Patienten zu bestimmen.
In der Immunhämatologie besteht Besorgnis über die mögliche Zunahme dieser Art von Störungen bei Routinetests für Bluttransfusionen, die als Folge neuer monoklonaler Antikörpertherapien bei Krebspatienten auftreten können.
Zusammenfassend hat unsere Studie gezeigt, dass die Behandlung von Erythrozyten mit DTT das CD38-Antigen inaktiviert und die Reaktivität mit dem Serum des mit DARA behandelten Patienten beseitigt. Diese einfache und praktische Methode ermöglicht die Durchführung von Studien ohne die Störungen, die das Vorhandensein von Alloantikörpern bei Transfusionsreaktionen bei Patienten verursachen kann, die eine Therapie auf der Grundlage dieses monoklonalen Antikörpers erhalten.
Das Problem der Panreaktivität, das Störungen bei den Kompatibilitätstests der mit DARA behandelten Patienten verursacht, kann technisch durch die Behandlung der Erythrozyten potenzieller Blutspender mit DTT gelöst werden. Dieses Mittel deaktiviert das in diesen Zellen vorhandene CD38-Antigen. Diese Panreaktivität sollte die Lieferung von Blutprodukten nicht verzögern, die in Notfallsituationen mit identischen ABO-Globularpaketen und Rh-kompatiblen roten Blutkörperchen gemäß den Praktiken der Blutbank erfolgen wird. Dies zwingt zur Ausarbeitung von Empfehlungen und/oder Leitfäden für die behandelnden Ärzte und das Personal der Blutbanken, die diese Art von Patienten betreuen. Es ist wichtig zu wissen, dass bisher bei den etwa 2000 Patienten, die mit DARA behandelt wurden, keine hämolytischen Transfusionsreaktionen beobachtet wurden.8 Jüngste Untersuchungen zur Transfusionssicherheit bei mit DARA behandelten Patienten, die etwa 76.000 Zyklen der Medikamentenanwendung umfassten, ergaben keine einzige unerwünschte Reaktion auf Transfusionshämolyse.10-12
Die gemeinsame Arbeit des Onkohämatologen und der Blutbank muss ab dem Zeitpunkt der Aufnahme der Patienten in das Krankenhaus vorhanden sein. Die Transfusionsverfahren, die bei diesen Patienten angewandt werden, sollten die Identifizierung des vollständigen Erythrozytenphänotyps aus der Box mit seiner Blutgruppe beinhalten, und Kompatibilitätstests sollten so gut wie möglich vor der Anwendung dieses Medikaments durchgeführt werden.
Die oben beschriebene DTT-Deaktivierungstechnik stellt in allen Fällen eine alternative Maßnahme zur Transfusionssicherheit dar. Unsere Blutbank ist in unserem Land ein Vorreiter bei der Anwendung dieser kürzlich beschriebenen und international validierten Technik.13 In kritischen Transfusionsnotfällen, in denen das Leben des Patienten in Gefahr ist, sollte jedoch nur Blut mit ABO- und RhD-Kompatibilität transfundiert werden, ohne die Kompatibilitätstests gemäß den zuvor beschriebenen Richtlinien und Verfahren für Notfalltransfusionen durchzuführen.
Interessenkonflikt
Die Autoren haben keine Interessenkonflikte zu erklären.