1) Einleitung
Der kardiale Ausflusstrakt (OFT) ist eine vorübergehende Struktur am arteriellen Pol des Herzens, die die embryonalen Ventrikel mit dem Aortensack verbindet. Der OFT bildet sich während der Herzschlinge aus kardialen Vorläuferzellen im pharyngealen Mesoderm. In seiner maximalen Ausdehnung ist der OFT ein mit Endokardzellen ausgekleideter, verdrehter Myokardzylinder mit orthogonalen, aber zusammenhängenden proximalen (konalen) und distalen (trunkalen) Bereichen. Der OFT wird anschließend umgebaut, was mit der Ventrikelseptation einhergeht. Während dieses Prozesses rotiert die OFT-Wand und teilt sich, um die Basis der aufsteigenden Aorta und des Pulmonalstamms zu bilden. Der Umbau der OFT ist mit der Bildung eines Auslassseptums, der Morphogenese der semilunaren Klappe, der Koronararteriogenese und der Reifung der Myokard- und glatten Muskelkomponenten der Basis der großen Arterien verbunden. Genetische oder umweltbedingte Störungen der Dehnung und des Umbaus der OFT führen zu konotrunkalen angeborenen Herzfehlern, die 30 % aller angeborenen Herzfehler ausmachen (etwa 0,3 % der Lebendgeburten) (Bruneau, 2008; Srivastava und Olson, 2000). Umfassende anatomische, experimentelle und genetische Untersuchungen der Morphogenese des OFT haben gezeigt, dass mehrere Zelltypen und Signalwege an der Entwicklung des OFT beteiligt sind, was darauf hindeutet, dass die erhöhte Inzidenz von OFT-Anomalien beim Menschen auf die Komplexität der Entwicklung zurückzuführen ist.
2) OFT-Bildung
Während der Dehnung des Herzschlauchs wird dem arteriellen Pol des Herzens nach und nach Myokard aus einer Vorläuferzellpopulation im pharyngealen Mesoderm hinzugefügt, die als zweites Herzfeld (SHF; Abbildung 1A) bezeichnet wird (Buckingham et al., 2005; Kelly und Buckingham, 2002), (Cai et al., 2003). Das SHF befindet sich im Mesoderm medial, aber angrenzend an Zellen, die das frühe Herzrohr bilden; später liegen SHF-Zellen unter dem ventralen Vorderdarmendoderm und bilden die dorsale Wand der Herzbeutelhöhle. Das SHF trägt neben dem venösen Pol und den AV-Regionen des Herzens auch zum rechten Ventrikel bei; die Population von Vorläuferzellen, die ausschließlich zum arteriellen Pol beiträgt, wird als anteriores oder sekundäres Herzfeld bezeichnet. Die Transkriptionsfaktoren Isl1, Foxh1, Tbx1, Pitx2 und Mef2c, die für die Entwicklung des SHF von entscheidender Bedeutung sind, wurden identifiziert (Übersicht in (Buckingham et al., 2005)). Zu den Schlüsseleigenschaften der SHF gehören ihre mediale Position, die Verzögerung der Differenzierung und die erhöhte Proliferation im Vergleich zu den Zellen, aus denen sich das frühe Herzrohr entwickelt. Diese Eigenschaften werden sowohl intrinsisch als auch durch die umgebenden CNC-Zellen und das Ektoderm und Endoderm des Pharynx durch die Aktivität von Signalmolekülen des Fibroblasten-Wachstumsfaktors, des morphogenetischen Knochenproteins, des Hedgehog- und des Wnt-Wegs reguliert (Cohen et al., 2008; Goddeeris et al., 2007; Park et al., 2008; Prall et al., 2007). Zusammen definieren diese Signale die Nische, die die SHF-Vorläuferzellen erhält und ihre fortschreitende Entfaltung während der OFT-Erweiterung reguliert (Rochais et al., 2009). Der OFT wird von Endokardzellen ausgekleidet, von denen man annimmt, dass sie ebenfalls aus dem pharyngealen Mesoderm stammen (Laugwitz et al., 2008).
Während der Ausdehnung des Herzschlauchs wird dem arteriellen Pol des Herzens nach und nach Myokard aus einer Vorläuferzellpopulation im pharyngealen Mesoderm hinzugefügt, die als zweites Herzfeld (SHF; Abbildung 1A) bezeichnet wird (Buckingham et al., 2005; Kelly und Buckingham, 2002), (Cai et al., 2003). Das SHF befindet sich im Mesoderm medial, aber angrenzend an Zellen, die das frühe Herzrohr bilden; später liegen SHF-Zellen unter dem ventralen Vorderdarmendoderm und bilden die dorsale Wand der Herzbeutelhöhle. Das SHF trägt neben dem venösen Pol und den AV-Regionen des Herzens auch zum rechten Ventrikel bei; die Population von Vorläuferzellen, die ausschließlich zum arteriellen Pol beiträgt, wird als anteriores oder sekundäres Herzfeld bezeichnet. Die Transkriptionsfaktoren Isl1, Foxh1, Tbx1, Pitx2 und Mef2c, die für die Entwicklung des SHF von entscheidender Bedeutung sind, wurden identifiziert (Übersicht in (Buckingham et al., 2005)). Zu den Schlüsseleigenschaften der SHF gehören ihre mediale Position, die Verzögerung der Differenzierung und die erhöhte Proliferation im Vergleich zu den Zellen, aus denen sich das frühe Herzrohr entwickelt. Diese Eigenschaften werden sowohl intrinsisch als auch durch die umgebenden CNC-Zellen und das Ektoderm und Endoderm des Pharynx durch die Aktivität von Signalmolekülen des Fibroblasten-Wachstumsfaktors, des morphogenetischen Knochenproteins, des Hedgehog- und des Wnt-Wegs reguliert (Cohen et al., 2008; Goddeeris et al., 2007; Park et al., 2008; Prall et al., 2007). Zusammen definieren diese Signale die Nische, die die SHF-Vorläuferzellen erhält und ihre fortschreitende Entfaltung während der OFT-Erweiterung reguliert (Rochais et al., 2009). Der OFT wird von Endokardzellen ausgekleidet, von denen man annimmt, dass sie ebenfalls aus dem pharyngealen Mesoderm stammen (Laugwitz et al., 2008).
Während der OFT-Bildung wird der arterielle Pol des Herzens im Zuge der Morphogenese des Pharynxbogens und der Bildung der bilateralen Aortenbogenarterien nach kaudal in die Pharynxregion verschoben (Waldo et al., 2005b). CNC-Zellen, die aus dem dorsalen Neuralrohr stammen, wandern durch die kaudalen Pharynxbögen in den OFT des Herzens während der Bildung der distalen Region des OFT (Abbildung 1B) (Hutson und Kirby, 2003). Zusätzlich zu ihrer entscheidenden Rolle bei der Umgestaltung des OFT spielen CNC-Zellen eine frühe Rolle bei der Einschränkung der Proliferation und der Kontrolle der Entfaltung des SHF (Waldo et al., 2005a). Wenn die CNC-Zellen in den distalen OFT eindringen, durchlaufen die Endothelzellen im proximalen Bereich des OFT als Reaktion auf vom Herzmuskel stammende Signale einen Prozess des Übergangs von Epithel zu Mesenchym, um zusammen mit eindringenden Neuralleistenzellen OFT-Kissen zwischen den Herzmuskel- und Endothelschichten zu bilden (Sugishita et al., 2004b). Die Konvergenz der OFT-Kissen in einer spiralförmigen Struktur trennt den laminaren Fluss von den embryonalen linken und rechten Ventrikeln. Die Entwicklung der Kissen hängt von mehreren interzellulären Signalwegen ab, darunter der transformierende Wachstumsfaktor b, der Fibroblastenwachstumsfaktor, das Knochenmorphogeneseprotein, VEGF, Notch und die nichtkanonische Wnt-Signalgebung (Wagner und Siddiqui, 2007). Der OFT erreicht seine maximale Länge in der Mitte der Trächtigkeit bei der Maus (E10,5) oder in der 4. Entwicklungswoche beim Menschen.
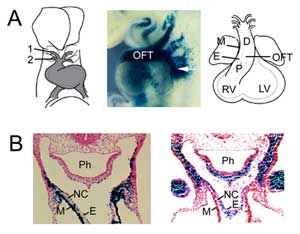
Abbildung 1
OFT-Bildung. (A) Die OFT ist am 8,5. Embryonaltag der Maus mit der ersten (1) und zweiten (2) Aortenbogenarterie (links) verbunden und erweitert sich durch die Hinzufügung von Vorläuferzellen des zweiten Herzfeldes aus dem Pharynxmesoderm (Mitte, Pfeil), sichtbar gemacht mit einem Fgf10 Enhancer Trap Transgen bei E9,5. Das OFT erreicht seine maximale Länge am 10,5. Embryonaltag der Maus und besteht aus proximalen (P) und distalen (D) Regionen. (B) Vergleich der Expression von Fgf10-Transgenen im OFT und im zweiten Herzfeld (links) mit Zellen aus der Neuralleiste (rechts) im distalen OFT bei E9,5. Rechte Tafel reproduziert aus Jiang et al., 2001, Development 127:1607-16, mit Genehmigung. M, Myokard; E, Endokard; RV, rechter Ventrikel; LV, linker Ventrikel; Ph, Pharynx; NC, Zellen aus der Neuralleiste.
3) Umbau des OFT
Während des OFT-Umbaus erhält der linke Ventrikel einen unabhängigen Auslass, die aufsteigende Aorta, die bei der Geburt eine wichtige systemische Leitung für sauerstoffreiches Blut darstellt. Der zylindrische OFT wird in die Basis der aufsteigenden Aorta und des Pulmonaltrunks (Auslass des rechten Ventrikels) umgewandelt, was mit der atrioventrikulären Septierung und dem Umbau des Aortenbogens zwischen dem 10,5. und 14,5. Die Umgestaltung des OFT ist ein komplexer Prozess, zu dem sowohl die Genetik als auch die Hämodynamik beitragen (Yashiro et al., 2007). Die entscheidende Rolle der OFT-Kissenentwicklung und der CNC-Zellen in diesem Prozess ist bekannt (Sugishita et al., 2004b). Das proximale OFT-Myokard wird in den ventrikulären Auslass integriert und ein Prozess der invasiven Myokardialisierung führt zur Muskularisierung des proximalen Auslassseptums (Rana et al., 2007; van den Hoff et al., 2001). Das Einwachsen des aortopulmonalen Septums zwischen der 4. und 6. Aortenbogenarterie trennt das distale OFT in die aufsteigende Aorta und den Truncus pulmonalis (Abbildung 2A). Glatte Muskelwände entwickeln sich an der Basis der großen Arterien aus dem letzten Beitrag des zweiten Herzfeldes und weiter distal aus den CNCs (Sugishita et al., 2004b; Waldo et al., 2005b).
Die Septierung der OFT geht mit einer Rotation der OFT-Wand gegen den Uhrzeigersinn einher, was zu einer Ausrichtung der Aorta mit dem linken Ventrikel und des Pulmonalstammes mit dem rechten Ventrikel führt (Bajolle et al., 2006). Dieser Septierungsprozess wird durch die Konvergenz der OFT, der atrioventrikulären und der ventrikulären Septen abgeschlossen (Abbildung 2A). Die ursprüngliche distale OFT-Myokardwand trägt zum Teil zum rechtsventrikulären subpulmonalen Myokard bei und unterliegt zum Teil dem durch Hypoxie ausgelösten programmierten Zelltod während der ventrikulo-arteriellen Ausrichtung (Rana et al., 2007; Sugishita et al., 2004a). Während des Umbauprozesses bilden sich semilunare Klappen an der winkligen Verbindung der proximalen und distalen Regionen des OFT aus dem ursprünglichen und zwei interkalierten OFT-Kissen (Anderson et al., 2003). Die koronare Arteriogenese ist der Prozess, bei dem der epikardiale Koronarplexus selektiv in die Basis der Aorta oberhalb der beiden Klappenblättchen, die dem Pulmonalstamm zugewandt sind, eindringt und Ostien bildet, die das Koronarsystem mit der aufsteigenden Aorta verbinden (Abbildung 2B) (Tomanek, 2005).
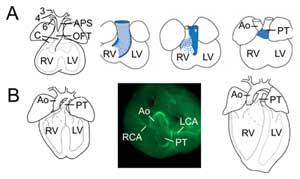
Abbildung 2.
Umbau des Ausflusskanals. (A) Am Embryotag 11,5 ist der OFT mit der dritten (3), vierten (4) und sechsten (6) Aortenbogenarterie (links) verbunden. Das aortopulmonale Septum (APS) trennt den distalen OFT in die aufsteigende Aorta (Ao) und den Pulmonaltrunk (PT), die mit den OFT-Kissen konvergieren (C). Die drei rechten Bilder zeigen die fortschreitende Rotation der Myokardwand während der OFT-Septierung: Die dorsale Wand am Embryotag 10,5 (blau) bildet das ventrale subpulmonale Myokard. (B) Am Embryonaltag 14,5 ist die OFT-Septation abgeschlossen und die Aorta ist mit dem linken Ventrikel und der Pulmonaltrunk mit dem rechten Ventrikel verbunden. In der oberen Ansicht (Mitte) zeigt die Immunochemie des glatten Muskel-Aktins die Verbindungen der linken (LCA) und rechten (RCA) Koronararterien mit der Basis der Aorta. Struktur des endgültigen Herzens (rechts). RV, rechter Ventrikel; LV, linker Ventrikel.
4) Konotrunkale angeborene Herzfehler
Die zugrundeliegende Entwicklungskomplexität der OFT-Entwicklung spiegelt sich in der hohen Inzidenz von konotrunkalen Anomalien beim Menschen wider (Bruneau, 2008; Srivastava und Olson, 2000). Ein Versagen der SHF- oder CNC-Entfaltung oder des OFT-Umbaus trägt zu dem Spektrum der konotrunkalen Defekte bei, die in der Humanpathologie und in Tiermodellen beobachtet werden (Abbildung 3) (Moon, 2008).
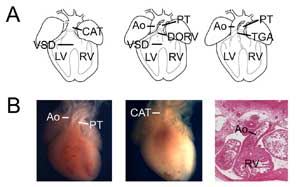
Abbildung 3.
Angeborene Herzfehler. (A) Cartoons, die den gemeinsamen arteriellen Truncus (oder persistierenden Truncus arteriosus, CAT, links), den rechten Doppelauslassventrikel (DORV, Mitte) und die Transposition der großen Arterien (TGA, rechts) zeigen. VSD, Ventrikelseptumdefekt; RV, rechter Ventrikel; LV, linker Ventrikel; Ao, Aorta; PT, Pulmonalstamm. (B) Beispiele von Mausmodellen für angeborene Herzfehler. Kontrollherz mit Aorta und Truncus pulmonalis (links) im Vergleich zu einem Tbx1-Null-Herz (Mitte) mit einem einzigen Ventrikelausgang (CAT). Beispiel eines transponierten rechten Ventrikels mit doppeltem Auslass, bei dem die Aorta mit dem rechten Ventrikel in einem Tbx3-Nullherz verbunden ist (rechts).
Während eine schwere Beeinträchtigung der SHF-Entwicklung zu einem Versagen der Herzschlauchverlängerung führt, führen mildere Defekte zu Anomalien in der ventrikuloarteriellen Ausrichtung und zum Versagen der Aorta, eine unabhängige Verbindung mit dem linken Ventrikel herzustellen (Abu-Issa und Kirby, 2007). Diese Defekte können der SHF innewohnen oder umliegende Zelltypen (CNC oder Rachenepithelien) betreffen, die die Nische der SHF-Vorläuferzellen kontrollieren. Solche Defekte können zu einem doppelten rechten Ventrikel, einer überschießenden Aorta, einer pulmonalen Hypoplasie, einer pulmonalen Atresie und einer Fallot-Tetralogie führen. Der Verlust oder die Verminderung des CNC führt zu einem Versagen oder einer Verzögerung der OFT-Septation, was zu einem persistierenden Truncus arteriosus oder einem rechten Doppelauslassventrikel führt; der CNC-Mangel wirkt sich auch indirekt auf die SHF-Entwicklung aus, was zu einem zusammengesetzten Phänotyp der Ausrichtung und Septation führt (Hutson und Kirby, 2003). Eine fehlende Rotation der OFT-Wand während des OFT-Umbaus führt ebenfalls zu Ausrichtungsdefekten, einschließlich Transposition der großen Arterien, doppeltem Auslass des rechten Ventrikels und überschießender Aorta, häufig als Folge von Defekten der embryonalen Lateralität (Bajolle et al., 2006; Bamforth et al., 2001). Defekte bei der Bildung des OFT-Septums können auch auf eine spätere fehlende Differenzierung der Herzmuskelwand und Anomalien bei Prozessen zurückzuführen sein, die für den Umbau wichtig sind, wie der programmierte Zelltod oder die Myokardialisierung (Park et al., 2008). Intrinsische Defekte in den OFT-Endokardzellen sowie hämodynamische Veränderungen führen nachweislich zu OFT-Anomalien 16, (Zhang et al., 2009), (Bartman und Hove, 2005; Yashiro et al., 2007). Schließlich ist eine abnorme proximale Koronararterienstrukturierung häufig mit konotrunkalen Defekten verbunden und stellt für sich genommen eine bedeutende Ursache für den plötzlichen Herztod dar (Angelini et al., 2002). Zu den aktuellen Forschungszielen gehören ein besseres Verständnis der Ätiologie von Konotrunkaldefekten durch die Identifizierung von ursächlichen genetischen Mutationen und Modifikatoren durch genomweite Screens und die Untersuchung des relativen Beitrags genetischer und epigenetischer Akteure bei der Bildung und Umgestaltung der OFT anhand von Tiermodellen. Diese Studien werden Einblicke in die Signalwege und zellulären Prozesse liefern, die die Morphogenese des OFT vorantreiben und die Ziele der Krankheitsmechanismen sind.