1) はじめに
心臓流出路(OFT)は、胚心室と大動脈嚢をつなぐ心臓の動脈極の一過性の構造である。 心臓流出路は、咽頭中胚葉の心筋前駆細胞から心臓のループ形成の過程で形成される。 最大伸展時には、OFTは心内膜細胞で覆われたねじれた心筋円柱であり、近位(円錐)領域と遠位(切断)領域は直交しているが連続した領域である。 OFTはその後、心室中隔形成と同時に再形成され、その過程でOFTの壁が回転・分裂して上行大動脈と肺幹の基部が形成される。 OFTのリモデリングは、出口中隔の形成、半月弁の形態形成、冠動脈形成、大動脈基部の心筋および平滑筋成分の成熟と関連している。 OFTの伸長とリモデリングに遺伝的または環境的障害が生じると、先天性心疾患全体の30%(出生児の約0.3%)を占める円錐角膜先天性心疾患を引き起こす(Brunau、2008;Srivastava and Olson、2000)。 OFTの形態形成に関する広範な解剖学的、実験的、遺伝学的研究により、OFTの発生には複数の細胞型とシグナル伝達経路が関与していることが明らかになっており、OFT異常の高い発生率の背景には、発生上の複雑性があることが示唆されています。
2) OFTの形成
心管が伸長する間に、心筋は第2心野(SHF;図1A)と呼ばれる咽頭中胚葉の前駆細胞集団から心臓の動脈極に徐々に追加される(Buckingham et al, 2005; Kelly and Buckingham, 2002)、(Cai et al., 2003)。 SHFは中胚葉の内側に位置するが、初期心管を生み出す細胞と連続している。その後SHF細胞は腹側前腸内胚葉の下に位置し、心膜腔の背側壁を構成している。 SHFは、心臓の静脈極と房室領域に加えて右心室にも寄与する。動脈極にのみ寄与する前駆細胞集団は、前心野または第二心野として知られている。 SHFの発生を制御する重要な転写因子として、転写因子Isl1、Foxh1、Tbx1、Pitx2およびMef2cが同定されている(Buckinghamら、2005年総説)。 SHFの主な特性は、内側に位置すること、分化の遅れ、初期心管を生み出す細胞と比較して高い増殖性である。 これらの特性は、線維芽細胞成長因子、骨形成タンパク質、ヘッジホッグおよびWnt経路のシグナル分子の活性を通して、内在的に、また周囲のCNC細胞および咽頭外胚葉と内胚葉によって制御されている(Cohenら、2008;Goddeerisら、2007;Parkら、2008;Prallら、2007)。 これらのシグナルは共に、SHF前駆細胞を維持するニッチを定義し、OFT伸展中の進行性展開を制御している(Rochaisら、2009年)。
心管が伸長する過程で、心筋は咽頭中胚葉の前駆細胞集団から心臓の動脈極に徐々に追加され、第二心野(SHF)と呼ばれる(図1A)(Buckinghamら, 2005; Kelly and Buckingham, 2002)(Cai et al.) SHFは中胚葉の内側に位置するが、初期心管を生み出す細胞と連続している。その後SHF細胞は腹側前腸内胚葉の下に位置し、心膜腔の背側壁を構成している。 SHFは、心臓の静脈極と房室領域に加えて右心室にも寄与する。動脈極にのみ寄与する前駆細胞集団は、前心野または第二心野として知られている。 SHFの発生を制御する重要な転写因子として、転写因子Isl1、Foxh1、Tbx1、Pitx2およびMef2cが同定されている(Buckinghamら、2005年総説)。 SHFの主な特性は、内側に位置すること、分化の遅れ、初期心管を生み出す細胞と比較して高い増殖性である。 これらの特性は、線維芽細胞成長因子、骨形成タンパク質、ヘッジホッグおよびWnt経路のシグナル分子の活性を通して、内在的に、また周囲のCNC細胞および咽頭外胚葉と内胚葉によって制御されている(Cohenら、2008;Goddeerisら、2007;Parkら、2008;Prallら、2007)。 これらのシグナルは共に、SHF前駆細胞を維持するニッチを定義し、OFT伸展中の進行性展開を制御している(Rochaisら、2009年)。
OFTの形成過程で、咽頭弓の形態形成と両側の大動脈弓の形成が行われるため、心臓の動脈極は咽頭領域で尾側に移動する(Waldoら、2005b)。 背側神経管に由来するCNC細胞は、OFTの遠位領域が形成される際に、尾側咽頭弓を通って心臓のOFTに移動する(図1B)(Hutson and Kirby、2003年)。 OFTのリモデリングにおける重要な役割に加えて、CNC細胞は、増殖を制限し、SHFの展開を制御する初期の役割を果たす(Waldo et al.、2005a)。 CNC細胞が遠位OFTに入ると、OFTの近位領域にある内皮細胞は、心筋由来のシグナルに応答して上皮性から間葉性へと変化するプロセスを経て、侵入した神経堤細胞とともに、心筋層と内皮層の間にOFTクッションを形成する (Sugishita et al., 2004b)。 OFTクッションは螺旋状に収束し、胚の左心室と右心室から層流を分離させる。 クッションの発生は、トランスフォーミング成長因子b、線維芽細胞成長因子、骨形成タンパク質、VEGF、Notch、非正規Wntシグナルを含む複数の細胞間シグナル伝達経路に依存している(Wagner and Siddiqui, 2007)。
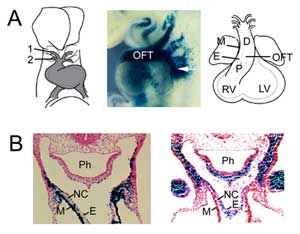
図1
OFTの形成。 (A)マウス胚8.5日目のOFTは、第1(1)および第2(2)大動脈弓状動脈(左)に接続し、咽頭中胚葉からの第2心原細胞(中央、矢印)の追加により拡張する(E9.5にFgf10 enhancer trap transgeneで可視化された)。 OFTはマウス胚10.5日目に最大長に達し、近位(P)および遠位(D)領域から構成される。 (B) E9.5におけるOFTおよび第二心野でのFgf10トランスジーン発現(左)とOFT遠位部での神経堤由来細胞(右)の比較。 右側のパネルは Jiang et al., 2001, Development 127:1607-16 から許可を得て複製した。 Mは心筋、Eは心内膜、RVは右心室、LVは左心室、Phは咽頭、NCは神経堤由来細胞
3) OFTリモデリング
OFTリモデリングの間に、左心室は独立した出口である上行大動脈を獲得し、出生時に酸素を含む血液の重要な全身導管を提供する。 マウスの妊娠10.5~14.5日目には、房室中隔形成と大動脈弓部形成に伴い、円筒状の心室が上行大動脈と肺動脈(右心室の出口)の基部に変化している。 OFTのリモデリングは、遺伝学と血行動態の両方が関与する複雑なプロセスである(Yashiro et al.、2007)。 この過程では、OFTクッションの発達とCNC細胞の重要な役割が確立されている(Sugishitaら、2004b)。 近位OFT心筋は心室出口に組み込まれ、侵襲的な心筋形成の過程で近位出口中隔の筋力化が起こる (Rana et al., 2007; van den Hoff et al., 2001)。 第4および第6大動脈弓部動脈の間の大動脈肺隔膜の成長により、遠位OFTは上行大動脈と肺動脈に分離される(図2A)。
OFTの分離は、OFT壁の反時計回りの回転を伴い、大動脈と左心室、肺動脈と右心室が整列する(Bajolleら、2006)。 この中隔形成過程は、OFT、房室および心室中隔の収束により完了する(図2A)。 元のOFT遠位心筋壁は、一部は右心室肺下に寄与し、一部は心室動脈整列中に低酸素駆動のプログラム細胞死を受ける(Ranaら、2007;Sugishitaら、2004a)。 再形成の過程で、半月弁は、元のOFTクッションと2つのインターカレーションされたOFTクッションからOFTの近位領域と遠位領域の角度的接合部に形成される(Andersonら、2003年)。 冠動脈形成は、心外膜由来の冠動脈叢が肺動脈に面した2つの弁尖の上の大動脈基部に選択的に侵入し、冠動脈系と上行大動脈をつなぐオスティアを形成するプロセスである(図2B)(Tomanek、2005)。
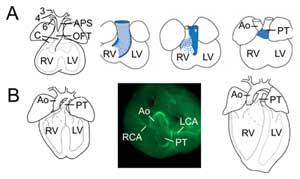
図2.肺動脈血管と上行大動脈をつなぐオスチアを形成している。
Outflow tract remodelling. (A)胚11.5日目の流出路は第3(3)、第4(4)、第6(6)大動脈弓状動脈(左)につながっている。 大動脈肺隔膜(APS)はOFT遠位部を上行大動脈(Ao)と肺動脈(PT)に分離し、OFTクッションに収束する(C)。 右の3つの画像は、OFT隔壁が形成される過程で心筋壁が徐々に回転する様子を示している。胚10.5日目の背側の壁(青)は腹側の肺下心筋を生じさせる。 (B) 胚 14.5 日目には OFT 分裂が完了し、大動脈は左心室に、肺動脈は右心室に接続される。 上面図(中央)では、平滑筋アクチン免疫化学により、左冠動脈(LCA)と右冠動脈(RCA)が大動脈の基部に連結していることが明らかになった。 確定心臓の構造(右)。 RV、右心室;LV、左心室。
4) 円錐角膜先天性心臓障害
OFT発生の根本的な発生の複雑さは、人間における円錐角膜異常の高い発生率に反映されています (Bruneau, 2008; Srivastava and Olson, 2000). SHF または CNC の展開の失敗または OFT リモデリングの失敗は、ヒトの病理学および動物モデルで観察される円錐角膜欠損のスペクトルに寄与します (図 3) (Moon, 2008)
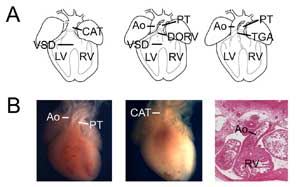
図 3.
先天性心不全。 (A)総動脈幹(または持続性動脈管、CAT、左)、二重出口右心室(DORV、中)および大動脈転位(TGA、右)を示す漫画。 VSD、心室中隔欠損、RV、右心室、LV、左心室、Ao、大動脈、PT、肺動脈幹。 (B)先天性心不全のモデルマウスの例。 大動脈と肺幹を示すコントロール心臓(左)と単一心室出口(CAT)を有するTbx1欠損心臓(中)の比較。 大動脈が右心室とつながっているTbx3欠損心臓(右)の転座型右心室二重出口の例。
SHFの発生に重篤な障害があると心管が伸びないが、より軽度の障害では心室動脈配列の異常や大動脈が左心室と独立した接続を確立できない(Abu-Issa and Kirby, 2007)。 これらの欠陥はSHFに内在するか、SHFの前駆細胞ニッチを制御する周囲の細胞タイプ(CNCまたは咽頭上皮)に影響を及ぼす可能性がある。 このような欠陥は、右心室の二重出口、大動脈のオーバーライド、肺低形成、肺閉鎖、ファロー四徴症などを引き起こす可能性があります。 CNCの欠損や減少は、OFTの隔壁形成の失敗や遅延につながり、持続性動脈洞や二重出口右心室になる。CNC欠損は間接的にSHFの発達にも影響し、複合配列や隔壁の表現型をもたらす(Hutson and Kirby、2003年)。 OFTリモデリング中のOFT壁の回転の失敗はまた、大動脈転位、右心室二重出口および大動脈のオーバーライドを含むアラインメント欠陥をもたらし、一般に胚の側性の欠陥に続く(Bajolleら、2006;Bamforthら、2001年)。 OFT中隔の形成不全はまた、後の心筋壁分化の失敗や、プログラム細胞死や心筋形成などのリモデリングに不可欠な過程の異常から生じることもある(Parkら、2008年)。 OFT心内膜細胞における内在的欠陥は、血行動態の変化と同様に、OFTの異常を引き起こすことも実証されている16, (Zhang et al., 2009), (Bartman and Hove, 2005; Yashiro et al., 2007)。 最後に、近位冠動脈のパターン異常は、しばしば円錐角膜の欠陥と関連し、単独では心臓突然死の重要な原因である(Angeliniら、2002年)。 現在の研究目標は、ゲノムワイドスクリーンによる原因遺伝子変異と修飾因子の同定、および動物モデルを用いたOFT形成とリモデリングにおける遺伝子とエピジェネティックの相対的寄与の解析を通じて、円錐角膜欠損の病因の理解を深めることである。 これらの研究により、OFT の形態形成を促進し、疾患メカニズムの標的となるシグナル伝達経路や細胞プロセスに関する洞察が得られるでしょう。