La fuga de la naturaleza de la prisión genética
Modificaciones postraduccionales: Una breve visión general
¿Cómo funciona la modificación postraduccional?
Las modificaciones postraduccionales más comunes
El impacto de la modificación postraduccional en la salud y la enfermedad
Una breve visión general
¿Qué significa PTM?
Las células necesitan detectar y reaccionar a los cambios en las condiciones internas y externas. Un método utilizado para ajustarse a estos cambios es modificar químicamente las proteínas. Los cambios químicos condicionados se transmiten de los sensores a los efectores a través de las modificaciones postraduccionales (PTM) reversibles de las proteínas. Las PTMs juegan un papel importante en la modificación del producto final de la expresión, contribuyen a los procesos biológicos y a las condiciones de enfermedad, desempeñando un papel clave en muchos procesos celulares como la diferenciación celular (1), la degradación de proteínas, los procesos de señalización y regulación, la regulación de la expresión génica y las interacciones proteína-proteína (2,3).
¿Cómo funciona la modificación postraduccional?
Los PTMs pueden ocurrir en cualquier paso de la vida de las proteínas. Muchas proteínas se modifican poco después de que se complete la traducción para mediar en el plegamiento adecuado o para dirigir la proteína naciente a distintas localizaciones celulares (como el núcleo o la membrana). Otras modificaciones se producen una vez completados el plegamiento y la localización para activar o inactivar la actividad catalítica. Las proteínas también están unidas covalentemente a etiquetas que las dirigen a la degradación. Se modifican mediante una combinación de escisión postraduccional y la adición de grupos funcionales a través de un mecanismo escalonado de maduración o activación de proteínas.
¿Dónde se produce la modificación postraduccional? Las PTM se producen en distintas cadenas laterales de aminoácidos o enlaces peptídicos y, en la mayoría de los casos, están mediadas por la actividad enzimática. De hecho, el 5% del proteoma comprende enzimas que realizan más de 200 tipos de PTMs (4). Estas enzimas incluyen quinasas, fosfatasas, transferasas y ligasas, que añaden o eliminan grupos funcionales, proteínas, lípidos o azúcares a o desde las cadenas laterales de los aminoácidos, y proteasas, que escinden enlaces peptídicos para eliminar secuencias específicas o subunidades reguladoras. Muchas proteínas también pueden modificarse a sí mismas utilizando dominios autocatalíticos, como la autocinasa y los dominios autoprotolíticos. Las PTMs también pueden ser reversibles según la naturaleza de la modificación. Como ejemplo, las fosfatasas hidrolizan el grupo fosfato para eliminarlo de la proteína e invertir su actividad biológica (Figura 1).
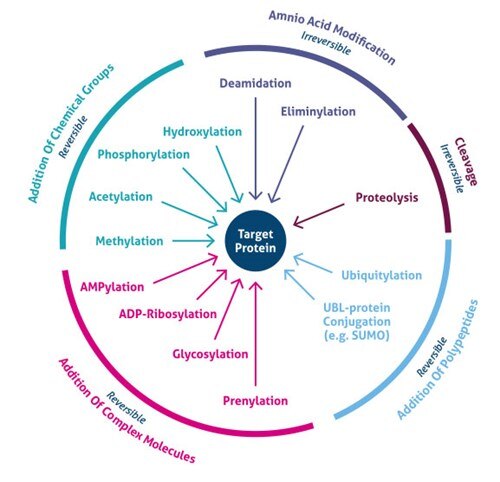
Figura 1. Tipos de modificaciones postraduccionales (PTMs).
Modificaciones postraduccionales más comunes
Los recientes avances en los métodos de espectrometría de masas (MS) han permitido la identificación de miles de sitios PTM. En consecuencia, las nuevas estrategias de enriquecimiento han descubierto la importancia celular global de varios tipos de modificaciones (por ejemplo, acetilación, ubiquitilación, O-GlNac, glicosilación ligada a N). Actualmente se conocen más de 200 tipos diversos de PTMs (5,6), que van desde pequeñas modificaciones químicas (p. ej., fosforilación y acetilación) hasta la adición de proteínas completas (p. ej., ubiquitylación, Figura 3).
Fosforilación
La fosforilación de proteínas (Figura 2) es la modificación postraduccional más estudiada. Se ha estimado que un tercio de las proteínas de los mamíferos pueden estar fosforiladas, y esta modificación suele desempeñar un papel clave en la modulación de la función de las proteínas. La fosforilación tiene lugar en residuos de serina, treonina y tirosina, y actúa para regular la función de las proteínas, la actividad enzimática, las interacciones proteína-proteína y su localización. La fosforilación es catalizada por fosfatasas y puede ser reversible – las proteínas fosforiladas pueden ser desfosforiladas por proteínas desfosfatasas.
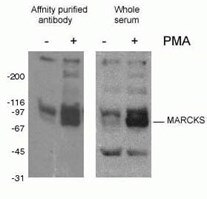
Figura 2. Resultado de WB del anticuerpo fosfo-Marcks (10018-3-AP, 1:1500) con células de macrófagos J774 de ratón tratadas con PMA.
Glicosilación y glicanación
La mayoría de las proteínas que se sintetizan en los ribosomas asociados al retículo endoplásmico sufren glicosilación. Esto significa que se añade una unión covalente de restos de azúcar a la cadena polipeptídica. Los dos tipos más comunes de glicosilación en los eucariotas son la glicosilación ligada al N – a la asparagina, y la glicosilación ligada al O – a la serina y a la treonina.
Ubiquitinación
La ubiquitinación de proteínas significa que se añade una ubiquitina covalente a la lisina, cisteína, serina, treonina o directamente al N-terminal de la proteína. La ubiquitina es una proteína pequeña (+/-8,6 kDa) que se expresa en casi todos los tipos de tejidos (Figura 3). La ubiquitinación es una reacción enzimática catalizada por una cascada de tres enzimas (E1, E2 y E3). Esto proporciona especificidad de sustrato y pasos de activación, conjugación y ligación. Las proteínas pueden ser monoubiquitinadas (con una molécula de ubiquitina) o poliubiquitinadas. La poliubiquitinación tiene lugar cuando se añaden moléculas de ubiquitina adicionales a la molécula de ubiquitina inicial. La ubiquitinación a través del proteoma puede marcar las proteínas para su degradación. También es importante para la señalización celular, la internalización de proteínas de membrana , y el desarrollo y la regulación de la transcripción.

Figura 3. Células MDA-MB-453s fueron sometidas a SDS PAGE seguido de western blot con 10201-2-AP (anticuerpo contra la ubiquitina) a una dilución de 1:600.
El impacto de los PTMs en la salud y la enfermedad
El análisis de las proteínas y sus PTMs es particularmente importante para el estudio de las enfermedades cardíacas, el cáncer, las enfermedades neurodegenerativas y la diabetes (7). Los principales retos en el estudio de las proteínas modificadas postraduccionalmente son el desarrollo de métodos específicos de detección y purificación. Afortunadamente, estos obstáculos técnicos se están superando con una variedad de nuevas y refinadas tecnologías proteómicas.
- Biología química: proteínas vestidas.
- Conceptos en sumoilación: una década después.
- Análisis proteómico en las neurociencias.
- Las funciones de las modificaciones postraduccionales en el contexto de las redes de interacción proteica
- Descifrando una red global de modificaciones postraduccionales asociadas funcionalmente.
- PTMcode: a database of known and predicted functional associations between post-translational modifications in proteins.
- Citrullination: a posttranslational modification in health and disease.
