Características típicas
El síndrome de Rubinstein-Taybi se caracteriza por un desarrollo lento de la talla y el peso, microcefalia, rasgos faciales dismórficos, pulgares anchos y dedos gordos. El desarrollo prenatal es normal, con parámetros de crecimiento medios o casi normales al nacer. Las tablas de crecimiento suelen acercarse a los límites inferiores de la normalidad en el primer periodo postnatal, reflejando principalmente la hipoalimentación exacerbada por el reflujo gastroesofágico. Posteriormente, la tendencia al sobrepeso o la obesidad (más temprana en los varones que en las mujeres) puede observarse durante la adolescencia. Las tablas de crecimiento específicas y recientemente revisadas son esenciales para evaluar adecuadamente el crecimiento de los individuos afectados . Los rasgos faciales se caracterizan principalmente por una línea capilar frontal baja, cejas arqueadas/gruesas, fisuras palpebrales inclinadas hacia abajo, nariz prominente en forma de pico con columela por debajo del alae nasi, orejas displásicas y de implantación baja, paladar arqueado, micrognatia leve, anomalías dentales (conformación alterada, maloclusión y apiñamiento de los dientes) y sonrisa atípica («muecas») con los ojos casi completamente cerrados (Figura 1). Los pies y las manos suelen presentar un primer dedo agrandado y clinodactilia del quinto dedo (Figura 2), mientras que rara vez se observa polidactilia con pulgares y primeros dedos bífidos. Otras anomalías esqueléticas incluyen pulgares abducidos, anomalías vertebrales, laxitud ligamentosa, inflamación aséptica grave y prolongada de la cabeza del fémur, anomalías similares a la enfermedad de Perthes (3%) y, ocasionalmente, deslizamiento de la epífisis capital del fémur. En particular, se ha notificado un alto riesgo de anomalías vertebrales cervicales (inestabilidad de C1-C2, os odontoideum, hipoplasia de la dorsal, fusión de las vértebras cervicales), con una posible estenosis en la unión craneovertebral, que puede causar mielopatía cervical. Se han notificado problemas neurorradiológicos complejos, como disgenesia del cuerpo calloso (17%), malformación de Chiari tipo I con o sin siringomielia, malformación de Dandy Walker e hidrocefalia, y cordón umbilical anclado, que aún se están investigando. También se han descrito anomalías cerebrovasculares como la disección espontánea de las arterias supraaórticas y el infarto cerebral por aneurisma disecante de la arteria cerebral anterior. Sin embargo, cualquier órgano puede verse afectado en los pacientes con TSR. Las posibles malformaciones, problemas médicos y complicaciones incluyen (Tabla 1):
-
Sordera conductiva y/o neurosensorial, infecciones recurrentes del oído medio, infecciones respiratorias recurrentes, inmunodeficiencias ;
-
Anomalías inespecíficas de la electroencefalografía (EEG) (57-66%) y convulsiones (25%) ;
-
Catarata, coloboma unilateral o bilateral del iris/retina/nervio óptico (9-11%), glaucoma, obstrucciones del conducto lagrimal (38-47%), errores de refracción (41-56%) y estrabismo (60-71%) . Además, Jacobs et al. describieron por primera vez la avascularidad periférica con angiografía de fluoresceína en 2012 ;
-
problemas dentales: cúspides del talón (73%), hipoplasia del esmalte y número anormal de dientes ;
-
patologías cardíacas congénitas: comunicación interauricular, comunicación interventricular, conducto arterioso persistente, coartación de aorta, estenosis pulmonar, válvula aórtica bicúspide, pseudotruncus, estenosis aórtica, dextrocardia, anillos vasculares y trastornos de la conducción (24-38%) . También se ha descrito la asociación ocasional de corazón izquierdo hipoplásico con TSR ;
- Malformaciones renales (52%) y criptorquidia (78-100%) ;
-
Trastornos endocrinos: hipotiroidismo congénito , hipoplasia tiroidea, deficiencia de GH e hipoplasia hipofisaria ;
-
Trastornos gastrointestinales: reflujo gastroesofágico, estreñimiento (40-74%) y megacolon/enfermedad de Hirschsprung ;
-
apnea obstructiva del sueño, complicaciones anestésicas y de intubación ;
-
problemas de la piel, incluyendo pilomatrixomas, uñas encarnadas, paroniquia y tendencia a formar queloides (24%) ;
-
Cánceres, especialmente de origen neural y del desarrollo (neuroblastoma, meduloblastoma, oligodendroglioma, meningeoma, feocromocitoma, rabdomiosarcoma, leiomiosarcoma, seminoma, odontoma, coristoma y pilomatrixomas . También se ha informado de leucemia y linfoma ;
-
hirsutism
Figure 1 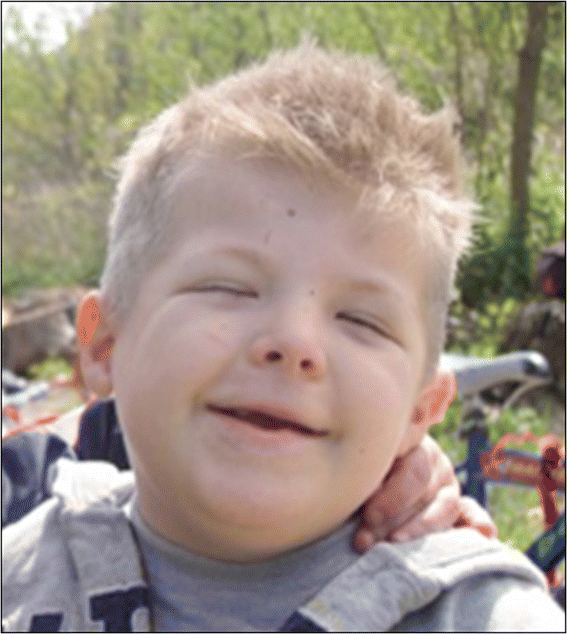
Typical facies of a RSTS patient, including arched eyebrows, slanted palpebral fissures, protruding beaked nose with columella below alae nasi, arched palate, mild micrognathia, labial commissures facing upward, teeth anomalies, and an atypical smile («grimacing») with nearly completely closed eyes.
Figure 2 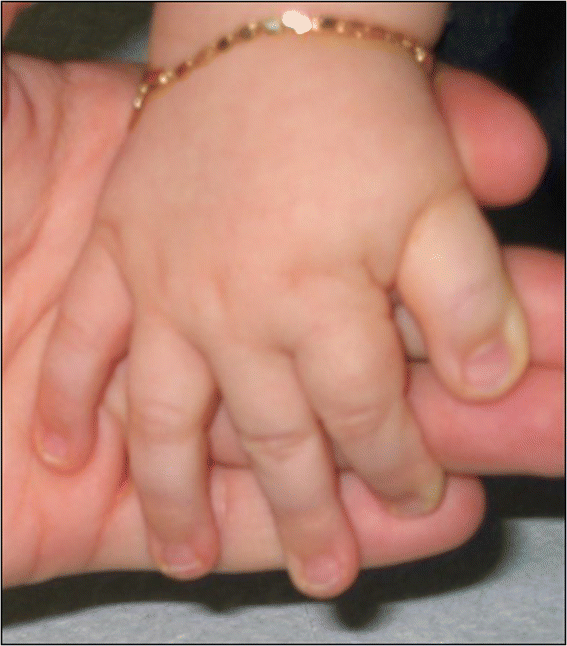
Typical hands of a RSTS patient, including enlarged first finger and clinodactyly of the fifth finger.
Table 1 The incidence of a number of typical features of RSTS
El periodo neonatal de los individuos con RSTS se caracteriza típicamente por la hipotonía y el retraso en el desarrollo psico-motor.desarrollo motor, con grados variables de discapacidad intelectual. Por ejemplo, la puntuación del cociente intelectual (CI) de los pacientes con RSTS en el periodo neonatal suele oscilar entre 25 y 79 (media: 36-51) . En 2009, Galèra et al. describieron tres características cardinales del RSTS, la escasa capacidad de atención, las estereotipias motoras y la mala coordinación . Se han descrito tanto pacientes con RSTS clásico y discapacidad intelectual leve como pacientes con RSTS atípico y discapacidad intelectual leve . Por lo tanto, en los casos más leves, el diagnóstico precoz es especialmente difícil, y deben seguirse estrictamente las principales etapas del desarrollo para iniciar rápidamente una estimulación específica e individualizada. Además, aunque los pacientes con RSTS suelen tener características amistosas y sociables, todavía pueden observarse trastornos de conducta, cambios de humor y trastornos obsesivo-compulsivos, sobre todo en la edad adulta.
Transición y asistencia sanitaria en la edad adulta
Más del 90% de los individuos con RSTS sobreviven hasta la edad adulta , y la asistencia sanitaria para estos pacientes es particularmente compleja, requiere mucho tiempo y a menudo no está estandarizada en directrices específicas. Los problemas médicos de la mayoría de los síndromes genéticos suelen cambiar con la edad y existe un conocimiento limitado sobre el manejo de los adultos con síndromes genéticos . Se han documentado individuos adultos con STSR, pero sólo se dispone de unos pocos estudios de revisión sobre adultos con STSR. En estos estudios de revisión, los pacientes adultos con RSTS tenían problemas médicos relevantes y la mayoría de ellos tenían sobrepeso u obesidad. Durante la adolescencia pueden aparecer una serie de fenotipos conductuales como la ansiedad, la inestabilidad del estado de ánimo y el comportamiento agresivo. Los cuidadores informaron de una disminución de las capacidades a lo largo del tiempo en el 32% de los sujetos con RSTS y de un cierto empeoramiento de las conductas en el 37% de los pacientes con RSTS, lo que coincide con el informe de Hennekam et al. en 1992 . Por lo tanto, la atención de seguimiento es importante para identificar y tratar los problemas psiquiátricos que surgen con la edad . Por último, la prevalencia del TSR puede ser mayor que la estimación original debido al diagnóstico tardío, especialmente en los casos más leves.
Enfoques diagnósticos
Los individuos con sospecha de TSR deben ser evaluados por genetistas pediátricos con conocimientos de dismorfología. Hay una serie de técnicas moleculares que se utilizan ampliamente en los análisis genéticos del TSR. Entre los ensayos, el análisis del cariotipo puede mostrar anomalías raras visibles desde el punto de vista citogenético (translocaciones, inversiones o deleciones); aunque el resultado suele ser normal, esta evaluación debe realizarse en cualquier caso para identificar posibles reordenamientos. El FISH puede identificar microdeleciones, con una tasa de detección del 5-10% . Las pruebas de análisis de deleciones/duplicaciones identifican deleciones/duplicaciones exónicas o de todo el gen no detectables mediante el análisis de la secuencia de las regiones codificantes e intrónicas flanqueantes del ADN genómico. Se pueden utilizar varios métodos (PCR cuantitativa, PCR de largo alcance, amplificación de sonda dependiente de ligadura múltiple (MLPA) y microarray cromosómico). Stef et al. detectaron deleciones en 17 (20,5%) de 83 pacientes utilizando array-CGH y PCR fluorescente múltiplex cuantitativa. El análisis molecular también puede identificar mutaciones en los genes CREBBP y EP300. Se han identificado variantes patogénicas del gen CREBBP en el 50-70% de los individuos con RSTS, mientras que Roelfsema y otros, Bartholdi y otros, y Negri y otros han informado de mutaciones en el gen EP300 en aproximadamente el 5-8% de los pacientes con RSTS. Se ha informado de un fenotipo severo en pacientes con RSTS con grandes deleciones , pero otros estudios no apoyan esta asociación genotipo-fenotipo. Sin embargo, es posible una asociación entre un coeficiente intelectual más bajo y rasgos autistas con deleciones grandes en pacientes con RSTS . Por lo tanto, Calì et al. recomiendan el MLPA que puede identificar estas grandes deleciones para el cribado de los pacientes de RSTS con menor coeficiente intelectual y rasgos autistas . Las mutaciones fuera del dominio de la histona acetiltransferasa (HAT) se asociaron con un fenotipo leve . Además, el mosaicismo somático también puede estar asociado con el RSTS leve . Hasta ahora se han identificado y caracterizado menos de 20 pacientes de RSTS con mutaciones en EP300. Las mutaciones en EP300 se han asociado a la preeclampsia en mujeres con un embarazo afectado por RSTS; se ha descrito la afectación de la piel y un fenotipo leve en anomalías esqueléticas y problemas neuropsiquiátricos.
Asesoramiento genético
La mayoría de los casos de RSTS son esporádicos y hasta la fecha sólo se han descrito unos pocos casos de RSTS que afectan a hermanos. La transmisión vertical es extremadamente rara. Aunque el riesgo de recurrencia del TSR es generalmente bajo, debe proporcionarse un asesoramiento genético adecuado para el diagnóstico prenatal del TSR. El mosacismo somático, por ejemplo, se confirmó en el padre clínicamente no afectado de un niño con TSR y en el padre levemente afectado de tres mujeres con TSR . Además, se planteó la hipótesis de un mosaicismo de línea germinal en dos casos de TSR. Basándose en estos informes, el riesgo de recurrencia del TSR es de aproximadamente el 0,5-1%.
Manejo
Aunque se han realizado avances significativos en el conocimiento de las manifestaciones clínicas y la historia natural del TSR, las directrices para la atención sanitaria y el seguimiento del TSR no han sido bien actualizadas tras la propuesta de Wiley et al. en 2003 (Tabla 2) . Las nuevas terapias genéticas y epigenéticas pueden ser enfoques prometedores para el tratamiento del TSR, pero hay una necesidad urgente de mejorar y personalizar el protocolo de seguimiento estándar. Sobre la base de nuestros conocimientos y de los aspectos críticos que discutimos a continuación, redactamos nuestra propuesta de seguimiento (Tabla 3).
El manejo debe ajustarse en la edad adolescente, por las diferencias conocidas en algunas cuestiones (características oftalmológicas, tendencia a la obesidad y trastornos del estado de ánimo en particular).
Cuestiones desconocidas y críticas en el TSR
Se ha avanzado sustancialmente en los estudios de las bases genéticas y las cuestiones médicas del TSR, lo que contribuye al diagnóstico clínico inicial y a la posterior confirmación mediante análisis moleculares. Dada la complejidad y la rareza de este síndrome, todavía hay numerosas preguntas sin respuesta sobre el RSTS. Por lo tanto, las investigaciones adicionales deben centrarse. en el diagnóstico clínico y el manejo, así como en la correlación genotipo-fenotipo.
Basado en nuestra experiencia, los patrones de crecimiento anormales que se observan en las tablas de crecimiento estándar deben destacarse en los criterios de diagnóstico de RSTS. Además, los criterios de diagnóstico clínico y el cribado podrían clasificarse aún más según los períodos prenatal, infantil y adolescente. En particular, la presencia de un crecimiento normal en el útero, asociada a otros marcadores como los pulgares anchos/alas y otras malformaciones, es útil en el diagnóstico diferencial del TSR de otros síndromes (por ejemplo, el síndrome de Cornelia de Lange). Los genetistas pediátricos deberían prestar más atención a las falanges distales ensanchadas: revisando las fotos de los pacientes enviadas a los análisis moleculares encontramos en una gran mayoría este signo, no reportado en las historias clínicas. El agrandamiento del primer dedo es una característica ampliamente conocida, pero también común en otros síndromes como la acrocefalopolisindactilia, mientras que la conformación de las falanges distales parece ser más específica para el RSTS. Además, las cúspides de los talones, que a menudo se pasan por alto, también son muy específicas del SRTS. Es necesario realizar un estudio de prevalencia multicéntrico de las anomalías cerebrales y de la columna vertebral, en vista de los diversos informes y del significado diagnóstico y pronóstico de estas características; una IRM cerebral/medular de cribado podría ser útil además de la exploración diagnóstica básica. Además, en lo que respecta a las características endocrinológicas, recientemente se ha añadido más información, en particular sobre la forma y la función de la tiroides, y conocemos personalmente otros dos casos con hipotiroidismo leve y tiroides pequeño. Además de la discapacidad intelectual, se conocen algunos cambios de comportamiento en los pacientes con TSR, pero no hay pruebas significativas que apoyen el valor diagnóstico de estas características neuropsiquiátricas en el diagnóstico del TSR. Por lo tanto, ningún rasgo neuropsiquiátrico es lo suficientemente fuerte como para incluirlo en los criterios de diagnóstico del RSTS, aunque algunos rasgos pueden ser más sugestivos de las mutaciones EP300. En estos casos, la ID es leve o está ausente, y predominan las alteraciones del comportamiento (es decir, la ansiedad). Otros rasgos sugestivos de mutaciones EP300 son la preeclampsia y las anomalías menos significativas en el primer dígito, lo que da la pauta para elaborar criterios diferenciales para EP300, y para un diagrama de flujo de laboratorio más preciso e individualizado. Hasta donde sabemos, éste es el único cambio posible en el orden de las investigaciones moleculares, ya que las demás correlaciones genotipo-fenotipo son sólo provisionales. Durante el seguimiento del TSR pueden producirse numerosas complicaciones no específicas, por lo que es difícil establecer un protocolo de seguimiento general y eficaz. Además, no se han identificado correlaciones sólidas entre genotipo y fenotipo. En general, hay que centrarse en el seguimiento ortopédico, el control dietético en la adolescencia y en los periodos neuropsiquiátricos, y las evaluaciones oftalmológicas en los adultos. Un protocolo de seguimiento menos estricto puede ser sólo apropiado para los pacientes con RSTS con mutaciones en EP300 , centrándose en los problemas de la piel (pilomatrixomas y nevos) que son probablemente más frecuentes que en los pacientes con mutaciones en CREBBP. En cuanto al asesoramiento genético, el cepillo salival y las pruebas genéticas son importantes para la evaluación del riesgo de recurrencia en los padres con mosaicismo germinal y somático.
Una discusión sobre los aspectos críticos de los avances en la comprensión de la etiopatogenia del RSTS está fuera del alcance de esta revisión, pero se han realizado diferentes modelos de ratón con resultados interesantes.

