THE ACID-BASE BEHAVIOUR OF AMINO ACIDS
This page looks at what happens to amino acids as you change the pH by adding either acids or alkalis to their solutions.
For simplicity, the page only looks at amino acids which contain a single -NH2 group and a single -COOH group.
Amino acids as zwitterions
Zwitterions in simple amino acid solutions
An amino acid has both a basic amine group and an acidic carboxylic acid group.
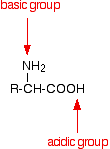
There is an internal transfer of a hydrogen ion from the -COOH group to the -NH2 group to leave an ion with both a negative charge and a positive charge.
This is called a zwitterion.

This is the form that amino acids exist in even in the solid state. Si se disuelve el aminoácido en agua, una solución simple también contiene este ion.
Un zwitterion es un compuesto sin carga eléctrica global, pero que contiene partes separadas con carga positiva y negativa.
Añadir un álcali a una solución de aminoácidos
Si se aumenta el pH de una solución de un aminoácido añadiendo iones hidróxido, se elimina el ion hidrógeno del grupo -NH3+.
![]()

Podrías demostrar que el aminoácido existe ahora como un ion negativo utilizando la electroforesis.
En su forma más sencilla, la electroforesis puede consistir simplemente en un trozo de papel de filtro humedecido en un portaobjetos de microscopio con una pinza de cocodrilo en cada extremo conectada a una pila. Se coloca una gota de solución de aminoácidos en el centro del papel.
Aunque la solución de aminoácidos es incolora, su posición al cabo de un tiempo puede encontrarse rociándola con una solución de ninhidrina. Si se deja secar el papel y luego se calienta suavemente, el aminoácido aparece como una mancha coloreada.
El aminoácido se encontraría viajando hacia el ánodo (el electrodo positivo).
Añadir un ácido a una solución de aminoácidos
Si se disminuye el pH añadiendo un ácido a una solución de un aminoácido, la parte -COO- del zwitterion recoge un ion hidrógeno.
![]()
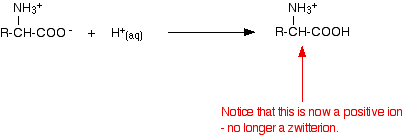
Esta vez, durante la electroforesis, el aminoácido se movería hacia el cátodo (el electrodo negativo).
Cambiando el pH de un extremo a otro
Supongamos que empiezas con el ion que acabamos de producir en condiciones ácidas y le vas añadiendo poco a poco álcalis.
Ese ion contiene dos hidrógenos ácidos -el del grupo -COOH y el del grupo -NH3+.
El más ácido de ellos es el del grupo -COOH, por lo que se elimina primero – y se vuelve al zwitterion.
![]()
![]()
Así que cuando se ha añadido la cantidad justa de álcali, el aminoácido ya no tiene una carga neta positiva o negativa. Eso significa que no se movería ni hacia el cátodo ni hacia el ánodo durante la electroforesis.
El pH al que se produce esta falta de movimiento durante la electroforesis se conoce como punto isoeléctrico del aminoácido. Este pH varía de un aminoácido a otro.
Si sigues añadiendo iones hidróxido, obtendrás la reacción que ya hemos visto, en la que se elimina un ion hidrógeno del grupo -NH3+.
![]()
![]()