Le daratumumab (DARA) est un médicament qui a été récemment approuvé par la FDA et breveté par Janssen pour le traitement du myélome multiple. Ce médicament est un anticorps monoclonal (MoAb) ciblant lgG1k CD38 qui est exprimé dans les cellules du myélome ; il est hautement cytotoxique pour les cellules tumorales de ces patients.1-4 La présence de l’antigène CD38 à la surface des érythrocytes d’individus sains a également été prouvée par cytométrie de flux.5 De plus, la panréactivité a été détectée dans le plasma de patients traités par DARA lors de tests de compatibilité de routine.6 Il s’agit d’un nouveau problème en médecine transfusionnelle qui retarde la livraison en temps voulu des composants sanguins, représentant ainsi un danger potentiel pour la vie du patient. S’agissant d’un sujet d’émergence récente, les manuels de procédures techniques (c’est-à-dire l’AABB), n’envisagent pas une méthodologie spécifique pour la résolution de ces types de problèmes.
Depuis plus de 20 ans, le traitement des globules rouges avec l’agent redox dithiothreitol (DDT) est couramment utilisé pour dénaturer l’antigène Kell, ainsi que d’autres groupes d’antigènes moins cliniquement significatifs à la suite d’une réaction transfusionnelle hémolytique. Nous pouvons le constater comme dans les cas de Landsteiner-Wiener, Cartwright, Dombrock, Indian, Jhon Milton Hagen, Lutheran et Raph. Cette caractéristique est utile dans la recherche des allo-anticorps (manuel technique de l’AABB).7,8
Plus récemment, il a été prouvé que l’antigène CD38 est également sensible à la dénaturation par l’agent redox dithiothreitol (DDT),9 sans affecter le reste des antigènes érythrocytaires cliniquement significatifs. Parmi les possibilités d’éradiquer l’interférence, nous appliquons la technique du DTT, qui permet de détecter la présence d’anticorps cliniquement significatifs, fournissant ainsi des composants sanguins présentant un risque transfusionnel moindre pour le patient.
Matériaux et méthodes
La banque de sang de l’hôpital Zambrano Hellion a reçu une demande de transfusion de 2 unités de paquets globulaires et de 4 concentrés plaquettaires. Le patient, un homme de 64 ans sans transfusion dans ses antécédents, avait un diagnostic de myélome multiple avec une évolution de 4 ans et était résistant au traitement médical conventionnel. Le sang veineux a été prélevé avec de l’EDTA. Les échantillons ont été étudiés pour les tests pré-transfusionnels de routine par les méthodes et techniques conventionnelles utilisées dans la banque du sang (c’est-à-dire les techniques de micro-agglutination en gel). Les études de groupe sanguin ABO et Rh ont été réalisées avec des cartes Grifols.
Pour le suivi et l’identification des anticorps irréguliers, nous avons utilisé un panel complet d’érythrocytes Grifols, ainsi que des colonnes de Coombs en gel Grifols DG. De plus, les tests de cross-matching avant transfusion ont été traités selon la technique décrite dans l’encart DG Coombs (anti-globuline humaine poly-spécifique), pour le traitement des érythrocytes avec du dithiothreitol (DTT) à 0,2M, pH 8, en utilisant la méthode 4.6 du manuel technique de l’EBA (12e édition des sections sur les méthodes générales de laboratoire)8 (voir figure 1).
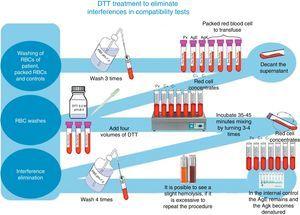
Traitement au TNT pour éliminer les interférences dans les tests de compatibilité.
Résultats
Le plasma du patient a présenté une pan-réactivité avec les érythrocytes du panel et les antigènes connus, qui ont montré un motif de réaction avec une intensité 3+ (grade 0-4) de manière homogène (voir Fig. 2).
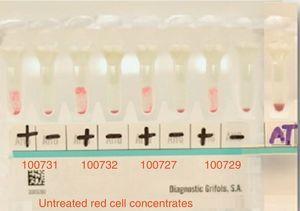
Main cross matching test with 4 donors resulted in incompatibility. Positive=main crossmatching (+), negative=minor crossmatching (−), AT=auto-control crossmatch.
The main cross-matching test resulted in incompatibility with all studied donors (15 in total).
The patient’s erythrocytes presented a negative direct anti-human globulin test (IgG and C3b), as well as a negative control. The presence of hemolysis in the patient’s sample was not detected (see Fig. 3).

Results direct anti-human globulin test (IgG and C3b) presenting negative results.
Au moment de réaliser les tests avec le plasma du patient et les érythrocytes préalablement traités au TNT provenant des différents donneurs, ainsi que ceux utilisés dans le panel de dépistage des anticorps, nous n’avons trouvé de réactivité dans aucun des échantillons étudiés. Des érythrocytes témoins K+ et E+ ont été utilisés pour vérifier que le DTT dénaturait uniquement l’antigène K et préservait l’antigène E ; cela faisait partie du contrôle de qualité de notre étude pour déterminer que les autres antigènes liés aux anticorps cliniquement significatifs étaient inactifs (voir figure 4).

Panel de dépistage d’anticorps érythrocytes DTT threated, montrant des résultats négatifs chez 4 donneurs de sang. C1 (contrôle positif) C2 (contrôle négatif).
Discussion
L’utilisation d’anti-CD38 est un traitement prometteur pour les patients atteints de myélome multiple et est actuellement à l’étude pour d’autres types de néoplasmes malins. Le problème est que ce médicament interfère avec les tests de compatibilité, ce qui complique la livraison opportune et sûre des composants sanguins.
Il est prouvé que les anti-CD38 présents dans le sérum des patients traités par DARA se lient à l’antigène CD38 exprimé dans les érythrocytes utilisés dans le panel de recherche d’anticorps, ainsi que chez les donneurs du test de compatibilité croisée pré-transfusionnel, générant une pan-réactivité. Cela peut masquer la présence d’anticorps cliniquement significatifs, en particulier chez les patientes multipares ou chez les patients polytransfusés. Cette pan-réactivité peut être inversée par l’utilisation d’agents neutralisants, qui rétablissent les tests d’identification et de suivi des anticorps irréguliers. Les anticorps anti-idiotypes, ainsi que le CD38 recombinant soluble, ont été évalués dans des articles précédents avec des résultats positifs.
Parmi les possibilités disponibles pour éliminer cette interférence dans la banque de sang, nous avons utilisé la technique DDT. Sa meilleure caractéristique est le fait qu’il s’agit d’un agent redox qui interrompt la structure tertiaire de la protéine en réduisant de manière irréversible les liaisons disulfure en sulfhydryle libre. Sans structure tertiaire, les antigènes, qui contiennent des protéines, ne peuvent plus fixer les anticorps, inhibant ainsi la réactivité sérologique. Un problème potentiel de cette technique est qu’elle affecte également d’autres antigènes de groupes sanguins. Cependant, dans la pratique quotidienne, seul l’antigène K est cliniquement significatif. Il est donc recommandé aux patients traités par DARA de ne recevoir que des concentrés érythrocytaires K-. La possibilité de perdre la réactivité à d’autres agents comme K et Yta est également présente. Néanmoins, cela s’avère être un événement extrêmement rare. Le DDT ne désactive pas l’activité sérologique de la plupart des antigènes cliniquement significatifs et fréquents tels que les systèmes Rh, Duffy, Kidd et MNS. Il est sage de déterminer le phénotype ou le génotype du patient avant de commencer le traitement par DARA.
En immuno-hématologie, on s’inquiète de l’augmentation possible de ce type d’interférence dans les tests de transfusion sanguine de routine, qui pourrait survenir en conséquence des nouvelles thérapies par anticorps monoclonaux chez les patients atteints de cancer.
En conclusion, notre étude a démontré que le traitement des érythrocytes par le DTT inactive l’antigène CD38, éliminant la réactivité avec le sérum du patient traité par DARA. Cette méthode simple et pratique permet de réaliser des études sans l’interférence que la présence d’allo-anticorps peut provoquer dans les réactions transfusionnelles des patients recevant une thérapie basée sur cet anticorps monoclonal.
Le problème de la panréactivité qui provoque des interférences dans les tests de compatibilité des patients traités avec DARA peut techniquement être résolu avec le traitement des érythrocytes avec du DTT provenant de donneurs de sang potentiels. Cet agent désactive l’antigène CD38 présent dans ces cellules. Cette panréactivité ne doit pas retarder la délivrance des produits sanguins qui, dans les situations d’urgence, utiliseront des paquets globulaires ABO et des globules rouges Rh compatibles identiques, selon les pratiques de la banque du sang. Cela oblige à formuler des recommandations et/ou des guides à l’intention des médecins traitants et du personnel des banques de sang qui s’occupent de ces types de patients. Il est important de considérer qu’à ce jour, aucune réaction transfusionnelle hémolytique n’a été observée chez les quelque 2000 patients qui ont été traités avec DARA.8 Des recherches récentes sur la sécurité transfusionnelle chez des patients traités avec DARA comprenant environ 76 000 cycles d’application du médicament n’ont pas trouvé un seul effet indésirable d’hémolyse transfusionnelle.10-12
Le travail conjoint de l’onco-hématologue et de la banque du sang doit être présent dès l’admission des patients à l’hôpital. Les procédures de transfusion appliquées à ces types de patients doivent inclure l’identification du phénotype érythrocytaire complet de la boîte avec son groupe sanguin, et les tests de compatibilité doivent être effectués au mieux de nos possibilités avant l’application de ce médicament.
La technique de désactivation du TNT décrite ci-dessus représente une mesure alternative de sécurité transfusionnelle dans tous les cas. Notre banque de sang est un pionnier dans notre pays dans l’adoption de cette technologie récemment décrite et validée au niveau international.13 Cependant, dans les situations critiques d’urgence transfusionnelle où la vie du patient est en danger, le sang ne devrait être transfusé qu’avec une compatibilité ABO et RhD, sans effectuer les tests de compatibilité selon les politiques et procédures précédemment décrites dans les transfusions d’urgence.
Conflit d’intérêt
Les auteurs n’ont pas de conflit d’intérêt à déclarer.