1) Introduction
La voie de sortie cardiaque (VFO) est une structure transitoire au pôle artériel du cœur reliant les ventricules embryonnaires au sac aortique. Le TFO se forme pendant le bouclage du cœur à partir de cellules progénitrices cardiaques dans le mésoderme pharyngé. Dans son extension maximale, le TFO est un cylindre myocardique torsadé tapissé de cellules endocardiques, avec des domaines proximal (conal) et distal (troncal) orthogonaux mais contigus. Le TFO est ensuite remodelé, en même temps que la septation ventriculaire, processus au cours duquel la paroi du TFO tourne et se divise pour générer la base de l’aorte ascendante et du tronc pulmonaire. Le remodelage du TFO est associé à la formation d’un septum de sortie, à la morphogenèse de la valve semilunaire, à l’artériogenèse coronaire et à la maturation des composants myocardiques et musculaires lisses de la base des grandes artères. Une perturbation génétique ou environnementale de l’élongation et du remodelage de l’OFT entraîne des malformations cardiaques congénitales conotronculaires, qui représentent 30 % de toutes les malformations cardiaques congénitales (environ 0,3 % des naissances vivantes) (Bruneau, 2008 ; Srivastava et Olson, 2000). Des études anatomiques, expérimentales et génétiques approfondies de la morphogenèse de l’OFT ont révélé l’implication de multiples types de cellules et de voies de signalisation dans le développement de l’OFT, suggérant que la complexité du développement sous-tend l’incidence élevée des anomalies de l’OFT chez l’homme.
2) Formation du TFO
Pendant l’élongation du tube cardiaque, le myocarde est progressivement ajouté au pôle artériel du cœur à partir d’une population de cellules progénitrices dans le mésoderme pharyngé appelée second champ cardiaque (SHF ; Figure 1A) (Buckingham et al, 2005 ; Kelly et Buckingham, 2002), (Cai et al., 2003). Le SHF est positionné dans le mésoderme médian mais contigu aux cellules donnant naissance au tube cardiaque précoce ; par la suite, les cellules SHF sous-tendent l’endoderme ventral du foregut, constituant la paroi dorsale de la cavité péricardique. Le SHF contribue au ventricule droit en plus du pôle veineux et des régions AV du cœur ; cette population de cellules progénitrices contribuant exclusivement au pôle artériel est connue sous le nom de champ cardiaque antérieur ou secondaire. Les régulateurs transcriptionnels critiques du développement du SHF ont été identifiés et comprennent les facteurs de transcription Isl1, Foxh1, Tbx1, Pitx2 et Mef2c (revus dans (Buckingham et al., 2005)). Les propriétés clés du SHF comprennent sa position médiane, son retard de différenciation et sa prolifération élevée par rapport aux cellules qui donnent naissance au tube cardiaque précoce. Ces propriétés sont régulées à la fois intrinsèquement et par les cellules CNC environnantes et l’ectoderme et l’endoderme pharyngés par l’activité de molécules de signalisation du facteur de croissance des fibroblastes, de la protéine morphogénétique osseuse, des voies Hedgehog et Wnt (Cohen et al., 2008 ; Goddeeris et al., 2007 ; Park et al., 2008 ; Prall et al., 2007). Ensemble, ces signaux définissent la niche qui maintient les cellules progénitrices de la FOP et régule leur déploiement progressif pendant l’extension de la FOP (Rochais et al., 2009). L’OFT est tapissé par des cellules endocardiques qui proviendraient également du mésoderme pharyngé (Laugwitz et al., 2008).
Pendant l’élongation du tube cardiaque, le myocarde est progressivement ajouté au pôle artériel du cœur à partir d’une population de cellules progénitrices du mésoderme pharyngé appelée second heart field (SHF ; Figure 1A) (Buckingham et al., 2005 ; Kelly et Buckingham, 2002), (Cai et al., 2003). Le SHF est positionné dans le mésoderme médian mais contigu aux cellules donnant naissance au tube cardiaque précoce ; par la suite, les cellules SHF sous-tendent l’endoderme ventral du foregut, constituant la paroi dorsale de la cavité péricardique. Le SHF contribue au ventricule droit en plus du pôle veineux et des régions AV du cœur ; cette population de cellules progénitrices contribuant exclusivement au pôle artériel est connue sous le nom de champ cardiaque antérieur ou secondaire. Les régulateurs transcriptionnels critiques du développement du SHF ont été identifiés et comprennent les facteurs de transcription Isl1, Foxh1, Tbx1, Pitx2 et Mef2c (revus dans (Buckingham et al., 2005)). Les propriétés clés du SHF comprennent sa position médiane, son retard de différenciation et sa prolifération élevée par rapport aux cellules qui donnent naissance au tube cardiaque précoce. Ces propriétés sont régulées à la fois intrinsèquement et par les cellules CNC environnantes et l’ectoderme et l’endoderme pharyngés par l’activité de molécules de signalisation du facteur de croissance des fibroblastes, de la protéine morphogénétique osseuse, des voies Hedgehog et Wnt (Cohen et al., 2008 ; Goddeeris et al., 2007 ; Park et al., 2008 ; Prall et al., 2007). Ensemble, ces signaux définissent la niche qui maintient les cellules progénitrices de la FOP et régule leur déploiement progressif pendant l’extension de la FOP (Rochais et al., 2009). L’OFT est tapissé par des cellules endocardiques dont on pense également qu’elles dérivent du mésoderme pharyngé (Laugwitz et al., 2008).
Pendant la formation de l’OFT, le pôle artériel du cœur est déplacé caudalement dans la région pharyngée alors que la morphogenèse de l’arc pharyngé et la formation des artères bilatérales de l’arc aortique ont lieu (Waldo et al., 2005b). Les cellules CNC, dérivées du tube neural dorsal, migrent à travers les arcs pharyngés caudaux vers l’OFT du cœur pendant la formation de la région distale de l’OFT (Figure 1B) (Hutson et Kirby, 2003). En plus d’un rôle critique dans le remodelage de l’OFT, les cellules CNC jouent un rôle précoce dans la restriction de la prolifération et le contrôle du déploiement du SHF (Waldo et al., 2005a). Lorsque les cellules CNC pénètrent dans la FOP distale, les cellules endothéliales de la région proximale de la FOP subissent un processus de transition épithéliale à mésenchymateuse en réponse à des signaux provenant du myocarde, pour former, avec les cellules de crête neurale envahissantes, des coussins de FOP entre les couches myocardiques et endothéliales (Sugishita et al., 2004b). La convergence des coussins OFT dans une structure en spirale sépare le flux laminaire des ventricules gauche et droit embryonnaires. Le développement des coussins dépend de multiples voies de signalisation intercellulaires, notamment le facteur de croissance transformant b, le facteur de croissance des fibroblastes, la protéine morpogénétique osseuse, le VEGF, la signalisation Notch et la signalisation Wnt non canonique (Wagner et Siddiqui, 2007). Le TFO atteint sa longueur maximale à la mi-gestation chez la souris (E10,5) ou à la 4e semaine de développement chez l’homme.
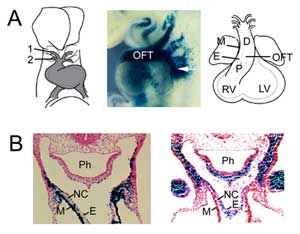
Figure 1
Formation du TFO. (A) Au jour embryonnaire 8,5 de la souris, l’OFT est connecté à la première (1) et à la deuxième (2) artères de l’arc aortique (à gauche) et s’étend par l’ajout de cellules progénitrices du deuxième champ cardiaque provenant du mésoderme pharyngé (au milieu, flèche), visualisé avec un transgène piège de l’exhausteur Fgf10 à E9,5. L’OFT atteint sa longueur maximale au jour embryonnaire 10,5 de la souris et comprend des régions proximale (P) et distale (D). (B) Comparaison de l’expression du transgène Fgf10 dans le TFO et le deuxième champ cardiaque (à gauche) avec les cellules dérivées de la crête neurale (à droite) dans le TFO distal à E9,5. Le panneau de droite est reproduit de Jiang et al, 2001, Development 127:1607-16, avec permission. M, myocarde ; E, endocarde ; VR, ventricule droit ; VG, ventricule gauche ; Ph, pharynx ; NC, cellules dérivées de la crête neurale.
3) Remodelage de l’OFT
Lors du remodelage de l’OFT, le ventricule gauche acquiert une sortie indépendante, l’aorte ascendante, fournissant un conduit systémique critique pour le sang oxygéné à la naissance. Le TFO cylindrique se transforme en base de l’aorte ascendante et du tronc pulmonaire (sortie du ventricule droit) concomitamment avec la septation auriculo-ventriculaire et le remodelage de l’artère de l’arc aortique entre les jours 10,5 et 14,5 de la gestation de la souris. Le remodelage de la FOP est un processus complexe auquel contribuent à la fois la génétique et l’hémodynamique (Yashiro et al., 2007). Les rôles critiques du développement du coussin de l’OFT et des cellules CNC dans ce processus sont établis (Sugishita et al., 2004b). Le myocarde de l’OFT proximal est incorporé dans la sortie ventriculaire et un processus de myocardisation invasive conduit à la muscularisation du septum de sortie proximal (Rana et al., 2007 ; van den Hoff et al., 2001). La croissance du septum aorticopulmonaire entre les 4e et 6e artères de l’arc aortique sépare le TFO distal en l’aorte ascendante et le tronc pulmonaire (Figure 2A). Des parois musculaires lisses se développent à la base des grandes artères à partir de la contribution finale du deuxième champ cardiaque et, plus distalement, à partir des CNC (Sugishita et al., 2004b ; Waldo et al., 2005b).
La septation du TFO s’accompagne d’une rotation de la paroi du TFO dans le sens inverse des aiguilles d’une montre, ce qui entraîne l’alignement de l’aorte avec le ventricule gauche et du tronc pulmonaire avec le ventricule droit (Bajolle et al., 2006). Ce processus de septation est complété par la convergence des septa OFT, atrio-ventriculaire et ventriculaire (Figure 2A). La paroi myocardique distale originale de l’OFT contribue en partie au myocarde sous-pulmonaire du ventricule droit et subit en partie une mort cellulaire programmée sous l’effet de l’hypoxie pendant l’alignement ventriculo-artériel (Rana et al., 2007 ; Sugishita et al., 2004a). Au cours du processus de remodelage, des valves semilunaires se forment à la jonction angulaire des régions proximale et distale de l’OFT à partir du coussin original et des deux coussins intercalaires de l’OFT (Anderson et al., 2003). L’artériogenèse coronaire est le processus par lequel le plexus coronaire d’origine épicardique envahit sélectivement la base de l’aorte au-dessus des deux feuillets valvulaires faisant face au tronc pulmonaire, formant des ostia reliant le système coronaire à l’aorte ascendante (Figure 2B) (Tomanek, 2005).
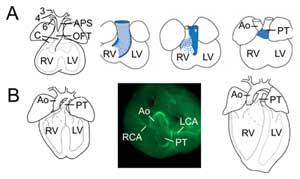
Figure 2.
Remodelage des voies d’écoulement. (A) Au jour embryonnaire 11,5, le TFO est connecté aux troisième (3), quatrième (4) et sixième (6) artères de l’arc aortique (à gauche). Le septum aorticopulmonaire (APS) sépare l’OFT distal en l’aorte ascendante (Ao) et le tronc pulmonaire (PT) convergeant avec les coussins de l’OFT (C). Les trois images de droite montrent la rotation progressive de la paroi myocardique au cours de la septation du TFO : la paroi dorsale au jour embryonnaire 10,5 (bleu) donne naissance au myocarde sous-pulmonaire ventral. (B) Au jour embryonnaire 14,5, la septation du TFO est terminée et l’aorte est connectée au ventricule gauche et le tronc pulmonaire au ventricule droit. Dans une vue supérieure (milieu), l’immunochimie de l’actine musculaire lisse révèle les connexions des artères coronaires gauche (ACL) et droite (ACR) à la base de l’aorte. Structure du cœur définitif (à droite). VR, ventricule droit ; VG, ventricule gauche.
4) Anomalies cardiaques congénitales conotruncales
La complexité sous-jacente du développement de la FOP se reflète dans la forte incidence des anomalies conotruncales chez l’homme (Bruneau, 2008 ; Srivastava et Olson, 2000). L’échec du déploiement de la SHF ou de la CNC ou du remodelage de l’OFT contribue au spectre des anomalies conotronculaires observées en pathologie humaine et dans les modèles animaux (Figure 3) (Moon, 2008).
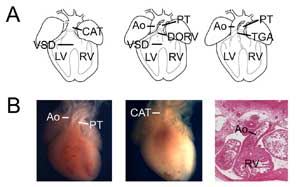
Figure 3.
Défauts cardiaques congénitaux. (A) Dessins humoristiques montrant le tronc artériel commun (ou tronc artériel persistant, CAT, à gauche), le ventricule droit à double sortie (DORV, au milieu) et la transposition des grandes artères (TGA, à droite). VSD, anomalie septale ventriculaire ; RV, ventricule droit ; LV, ventricule gauche, Ao, aorte ; PT, tronc pulmonaire. (B) Exemples de modèles murins d’anomalies cardiaques congénitales. Cœur témoin montrant l’aorte et le tronc pulmonaire (à gauche) comparé à un cœur Tbx1 nul (au milieu) avec une seule sortie ventriculaire (CAT). Exemple de ventricule droit à double sortie de type transposition montrant l’aorte connectée au ventricule droit dans un cœur nul Tbx3 (à droite).
Alors qu’une atteinte sévère du développement de la SHF entraîne un défaut d’élongation du tube cardiaque, des défauts plus légers entraînent des anomalies d’alignement ventriculo-artériel et l’incapacité de l’aorte à établir une connexion indépendante avec le ventricule gauche (Abu-Issa et Kirby, 2007). Ces défauts peuvent être intrinsèques au SHF ou affecter les types de cellules environnantes (CNC ou épithéliums pharyngés) qui contrôlent la niche de cellules progénitrices du SHF. De tels défauts peuvent entraîner un ventricule droit à double sortie, un chevauchement de l’aorte, une hypoplasie pulmonaire, une atrésie pulmonaire et une tétralogie de Fallot. La perte ou la réduction de la CNC entraîne un échec ou un retard de la septation de l’OFT, ce qui se traduit par un tronc artériel persistant ou un ventricule droit à double sortie ; la déficience en CNC affecte aussi indirectement le développement de l’OFT, ce qui entraîne un phénotype composite d’alignement et de septation (Hutson et Kirby, 2003). L’échec de la rotation de la paroi de l’OFT pendant le remodelage de l’OFT entraîne également des défauts d’alignement, notamment la transposition des grandes artères, le ventricule droit à double sortie et l’aorte chevauchante, généralement à la suite de défauts de latéralité embryonnaire (Bajolle et al., 2006 ; Bamforth et al., 2001). Les défauts de formation du septum de l’OFT peuvent également résulter d’un échec ultérieur de la différenciation de la paroi myocardique et d’anomalies dans les processus essentiels au remodelage, tels que la mort cellulaire programmée ou la myocardialisation (Park et al., 2008). Il a également été démontré que les défauts intrinsèques des cellules endocardiques de l’OFT, ainsi que les changements hémodynamiques, entraînent des anomalies de l’OFT 16, (Zhang et al., 2009), (Bartman et Hove, 2005 ; Yashiro et al., 2007). Enfin, une anomalie de la configuration de l’artère coronaire proximale est fréquemment associée aux anomalies conotronculaires et, isolément, constitue une cause importante de mort cardiaque subite (Angelini et al., 2002). Parmi les objectifs de recherche actuels figurent une meilleure compréhension de l’étiologie des anomalies conotronculaires grâce à l’identification des mutations génétiques et des modificateurs responsables par des cribles à l’échelle du génome et la dissection de la contribution relative des acteurs génétiques et épigénétiques dans la formation et le remodelage de l’OFT à l’aide de modèles animaux. Ces études permettront de mieux comprendre les voies de signalisation et les processus cellulaires qui dirigent la morphogenèse de l’OFT et qui sont les cibles des mécanismes pathologiques.