Introduction
Dois sinais visuais que aparecem simultaneamente são detectados mais rapidamente do que qualquer um dos sinais que aparecem sozinhos (Hershenson, 1962; Raab, 1962). Parte deste efeito alvo redundante (RTE) pode ser contabilizada estocasticamente por um modelo ‘horse-race’. Ou seja, se dois estímulos são processados em canais paralelos e independentes para os quais a velocidade de processamento varia aleatoriamente de tentativa para tentativa, em cada apresentação o estímulo mais rápido vence a corrida e atinge o limiar de detecção para desencadear a resposta; portanto, em média, dois estímulos têm mais probabilidade de produzir uma resposta mais rápida do que o tempo médio de resposta a um estímulo processado em um dos dois canais.
No entanto, análises de distribuições de frequência acumulada mostraram que há uma contribuição adicional para o RTE que não pode ser contabilizada por um modelo de cavalo de corrida entre dois canais independentes. Miller (1982) propôs um modelo de ‘co-ativação’ no qual os dois sinais são somados em um pool de ativação. Miniussi et al. (1998) mostraram que alvos redundantes produziam latências mais curtas para potenciais cerebrais relacionados a eventos P1 e N1, indicando que a soma neural ocorre no início da via visual. Experimentos em pacientes hemianópicos também mostraram que o TET não pode ser totalmente contabilizado por uma corrida de cavalos para atingir o limiar de detecção, uma vez que um TET pode ser manifestado mesmo na ausência de consciência fenomenal de um dos dois estímulos (Marzi et al., 1986; Tomaiuolo, 1997; de Gelder et al., 2001; Leh et al., 2006a,b). De fato, em pacientes com hemisferectomia, um alvo redundante no campo cego não só gera um TET, como o TET é aumentado quando o estímulo redundante completa um padrão gestual (Georgy et al., 2016). Estas observações em hemianópicos sugerem que a soma neural ocorre subcorticamente e não depende do córtex visual primário.
As evidências indiretas cumulativas implicaram coliculus superior (SC) como o substrato para a soma neural que contribui para a ETR. Entretanto, a evidência direta ainda não foi relatada. A pesquisa atual investiga a via neural que transmite os sinais visuais que estão integrados no SC. O CC consiste em camadas superficiais e profundas. As camadas profundas do colículo recebem aferentes, tanto diretos como através dos gânglios basais, do córtex oculomotor (Hikosaka e Wurtz, 1983; Pare e Wurtz, 1997; Sommer e Wurtz, 2000). Aferentes visuais para as camadas superficiais do colículo, entretanto, são transmitidos tanto da retina (via trato retino-tectal) quanto do córtex visual inicial (Fries, 1984), via braquium do SC.
Desde que os efeitos da soma neural foram demonstrados em pacientes neurológicos sem córtex visual, os sinais visuais somados no colículo poderiam ser transmitidos diretamente da retina para as camadas superficiais do colículo via trato retino-tectal. Se este for o caso, a soma neural poderia ser abolida por lesões do braquio da SC.
São muito raras as lesões que perturbam o braquio da SC. Aqui relatamos estudos de casos individuais de dois pacientes com lesões subcorticais unilaterais que desautorizaram a SC a partir da entrada visual, e que não manifestaram um ETR. Um paciente tinha uma lesão que danificava tanto o núcleo pulvinar do tálamo, a SC rostral, quanto seu braquio. No outro paciente, com lesão no miocárdio dorsal por traumatismo cranioencefálico, a CC parecia estar intacta, mas seu braquio estava perturbado.
Materiais e Métodos
Participantes
Dois pacientes neurológicos, cada um com seu próprio grupo controle de idade, foram testados em um experimento para medir a ETR.
ARE tinha 71 anos de idade no momento do teste. Uma hemorragia talâmica posterior 3 anos antes destruiu o pulvinar medial, núcleos talâmicos ventro-laterais e o membro posterior da cápsula interna, com danos que se estenderam até o cérebro médio dorsal, incluindo o pretectum e a CS rostral (Figura 1) A tractografia probabilística do DTI (Behrens et al., 2003, Behrens et al., 2007) confirmou que a lesão destruiu o braquio da CS (Figura 2). RE foi paralisada no lado esquerdo do corpo com perda de sensibilidade na face e braço esquerdos. Ela tinha movimentos oculares anormais, incluindo retração da pálpebra, movimentos oculares verticais paralisados e convergência prejudicada, que eram conseqüência da extensão da lesão no cérebro médio dorsal.
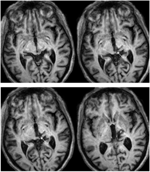 p>FIGURA 1. Ressonância magnética de alta resolução (0,7 mm3) T1 da paciente RE. Cortes axiais do ventral (superior esquerdo) para o dorsal (inferior direito) mostrando a lesão no cérebro médio dorsal direito e tálamo. Extensão da lesão no colículo superior rostral (SC) mostrada pelas setas brancas.
p>FIGURA 1. Ressonância magnética de alta resolução (0,7 mm3) T1 da paciente RE. Cortes axiais do ventral (superior esquerdo) para o dorsal (inferior direito) mostrando a lesão no cérebro médio dorsal direito e tálamo. Extensão da lesão no colículo superior rostral (SC) mostrada pelas setas brancas. 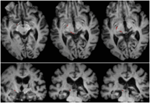 p>FIGURA 2. Tractografia demonstrando o tracto retinotectal no paciente RE co-registrado a fatias axiais ponderadas em T1 (superior da ventral para dorsal) e fatias coronais (inferior da anterior para posterior). O curso do trato retinotectal é mostrado no hemisfério esquerdo (vermelho). No hemisfério direito não foi traçada nenhuma linha de racionalização e, em comparação com o hemisfério intacto, pode-se ver que a lesão destruiu o braquium do SC no hemisfério direito. A linha de racionalização mostrada em vermelho foi gerada com tractografia probabilística usando FSL FDT (FMRIB Diffusion Toolbox; Behrens et al., 2003, Behrens et al., 2007; http://fsl.fmrib.ox.ac.uk/fsl/fslwiki). As imagens de ressonância magnética de plano de difusão foram obtidas com resolução de 1,5 mm3 com 32 direções isotrópicas de codificação de difusão (b = 800) e uma linha de base (b = 0). Tempo de repetição = 2 s, e tempo de eco = 35 ms. Para a tractografia probabilística, marcamos manualmente a região inicial (isto é, desenhamos máscaras de sementes) no trato óptico de cada hemisfério logo após o quiasma e uma região alvo (máscara de alvo) no SC.
p>FIGURA 2. Tractografia demonstrando o tracto retinotectal no paciente RE co-registrado a fatias axiais ponderadas em T1 (superior da ventral para dorsal) e fatias coronais (inferior da anterior para posterior). O curso do trato retinotectal é mostrado no hemisfério esquerdo (vermelho). No hemisfério direito não foi traçada nenhuma linha de racionalização e, em comparação com o hemisfério intacto, pode-se ver que a lesão destruiu o braquium do SC no hemisfério direito. A linha de racionalização mostrada em vermelho foi gerada com tractografia probabilística usando FSL FDT (FMRIB Diffusion Toolbox; Behrens et al., 2003, Behrens et al., 2007; http://fsl.fmrib.ox.ac.uk/fsl/fslwiki). As imagens de ressonância magnética de plano de difusão foram obtidas com resolução de 1,5 mm3 com 32 direções isotrópicas de codificação de difusão (b = 800) e uma linha de base (b = 0). Tempo de repetição = 2 s, e tempo de eco = 35 ms. Para a tractografia probabilística, marcamos manualmente a região inicial (isto é, desenhamos máscaras de sementes) no trato óptico de cada hemisfério logo após o quiasma e uma região alvo (máscara de alvo) no SC. ML tinha 23 anos no momento do teste. Ela tinha sofrido um traumatismo cranioencefálico grave em um acidente de trânsito 7 anos antes, resultando em lesão axonal difusa com hemorragia no putamen direito e no cérebro médio dorsal. Detalhes de sua história, exame neurológico e achados de neuroimagem foram relatados por (Poliva et al., 2015). Embora a esquerda tivesse algumas deficiências motoras, incluindo espasticidade e ataxia, ela tinha recuperado a independência. Sua principal incapacidade foi a agnosia auditiva grave devido a danos nas vias auditivas do tronco cerebral, incluindo o colículo inferior esquerdo. A acuidade visual e os campos visuais não foram prejudicados e não houve negligência ou extinção visual. Os sinais oculomotores da disfunção do cérebro médio incluíam os macroscópios de onda quadrada e espasmo de convergência no olhar vertical (mais para baixo do que para cima.) Não houve ptose ou anormalidade pupilar. A RM de alta resolução mostrou uma cavidade cística no putamen direito no local da hemorragia anterior, e pequena lesão periventricular nos pons inferiores direitos, na região do pedúnculo cerebelar inferior (Figura 3). Ela tinha avulsão quase completa do colículo inferior esquerdo, poupando apenas suas partes mais mediais e caudais. Os danos se estenderam para o pretectum lateral e tegmento médio do cérebro, destruindo a braquial do colículo superior e inferior, e ventralmente para o núcleo vermelho. A tractografia probabilística do DTI confirmou que a lesão destruiu o braquial do SC (Figura 4).
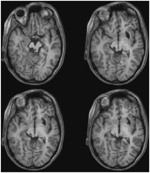 p>FIGURA 3. RM de alta resolução (0,7 mm3) T1 do paciente ML. Cortes axiais do ventral (superior esquerdo) para o dorsal (inferior direito) mostrando danos no colículo inferior esquerdo e tegmento mesencéfalo ventral e lateral ao SC.
p>FIGURA 3. RM de alta resolução (0,7 mm3) T1 do paciente ML. Cortes axiais do ventral (superior esquerdo) para o dorsal (inferior direito) mostrando danos no colículo inferior esquerdo e tegmento mesencéfalo ventral e lateral ao SC. 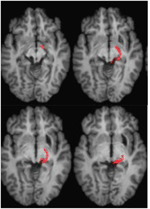
FIGURA 4. Tractograma DTI no paciente ML mostrando o tracto retino-tectal no hemisfério direito (vermelho) co-registado a imagens RM ponderadas em T1 no plano axial desde o ventral (superior esquerdo) até ao dorsal (inferior direito). As imagens de ressonância magnética planar eco-ponderadas por difusão foram obtidas com resolução de 2 mm3 com 63 direções isotrópicas de codificação de difusão distribuídas (b = 1000) e uma linha de base (b = 0). Tempo de repetição = 2 s, e tempo de eco = 35 ms. A tractografia foi implementada conforme descrito na Figura 2.
Neurologicamente saudável para o paciente RE, incluindo 11 adultos maiores (seis mulheres e cinco homens, idade média: 68,5, intervalo 59-73). Eles foram recrutados do painel de participantes da comunidade da Universidade de Bangor. Os participantes não apresentavam deficiências neurológicas, psicológicas, psiquiátricas ou cognitivas conhecidas e todos os participantes tinham visão normal/corrigida. Os participantes receberam um pagamento de £6 pela sua participação.
Neurologicamente saudáveis sujeitos de controle para pacientes ML incluíam 11 graduados e pós-graduados da Universidade de Bangor com idades entre 18-26 anos (sete mulheres e quatro homens).
Apparatus and Viewing Conditions
Apresentação® software de programação executado em um computador de PC com tempo de reação registrado (RT) respostas e gerou estímulos que foram apresentados em um monitor Dell (12.5″ × 25″, taxa de atualização 60 Hz.) colocado ao nível dos olhos 57 cm na frente dos participantes com visualização binocular em condições de luz diminuída. Um queixo e um apoio de cabeça foram usados para garantir a estabilidade da cabeça. As respostas dos participantes foram gravadas através da tecla da barra de espaço – pressionada em um teclado.
Estímulos
Os estímulos experimentais consistiram de quadrados de marcadores brancos não preenchidos (1 cm × 1 cm) posicionados 8° à esquerda e à direita de uma pequena caixa de fixação (0,2 cm × 0,2 cm) no centro da tela. Os estímulos alvo consistiram no preenchimento de uma ou ambas as caixas de marcadores periféricos para produzir um quadrado branco sólido. Todos os estímulos eram brancos apresentados sobre um fundo cinza.
Figure 5 mostra a seqüência de uma única tentativa. As caixas de marcadores permaneceram visíveis durante todo o experimento. Após um intervalo entre ensaios de 1750 ms, a caixa de fixação apareceu para iniciar o ensaio. Após um intervalo aleatório de 250 a 750 ms (em incrementos de 25 ms), um alvo que necessitava de uma resposta simples de teclas na barra de espaço do teclado, apareceu no local de uma ou ambas as caixas de marcadores. O alvo era um quadrado branco preenchido, gerado pelo preenchimento de uma ou ambas as caixas de marcadores. Aleatoriamente e com igual probabilidade, os alvos apareceram à esquerda, à direita, ou a ambos simultaneamente. Nenhum alvo apareceu nas tentativas de captura (10% das tentativas).
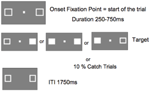 p>FIGURA 5. Sequência de exibição de um único estudo (ITI, intervalo entre as respostas dos participantes e o início do ponto de fixação que inicia o próximo estudo).
p>FIGURA 5. Sequência de exibição de um único estudo (ITI, intervalo entre as respostas dos participantes e o início do ponto de fixação que inicia o próximo estudo). Procedimento
Cada participante foi testado em uma única sessão. Após a leitura das instruções na tela, foram mostrados exemplos de todos os estímulos que foram apresentados na tarefa (a caixa de fixação e cada uma das três apresentações dos alvos) e foi solicitado aos participantes que confirmassem o reconhecimento de cada alvo através da tecla de barra de espaço. As instruções foram para manter a fixação na caixa central durante a duração de cada ensaio, e para responder o mais rapidamente possível pressionando a barra de espaço do teclado com a mão direita assim que um alvo aparecesse.
Após o participante confirmar verbalmente e através da tecla de pressão que todas as instruções foram compreendidas, prosseguiu a apresentação dos ensaios práticos (10 de cada condição de apresentação do alvo e 3 ensaios ‘catch’ sem alvo). O feedback na tela foi apresentado durante a conclusão dos ensaios práticos, incluindo as seguintes afirmações: (1) “Correto”, (2) “Tente responder mais rápido!” e (3) “Só responda se você vir um alvo”. Uma vez concluída a sessão de prática e tanto o participante como o experimentador estavam confiantes de que as instruções da tarefa foram entendidas corretamente, o participante foi convidado a começar o experimento. Os primeiros 30 ensaios de cada bloco experimental foram excluídos como ensaios práticos. Cada bloco consistia de um total de 233 ensaios: 70 à direita, 70 à esquerda, 70 ambos, e 23 ensaios ‘catch’. Uma pequena pausa foi feita na metade do bloco. O paciente ML e os controles mais jovens foram testados em um único bloco. Devido à variabilidade relacionada com a idade e condição da paciente RE, ela foi testada em dois blocos em dias separados; e seus participantes de controle de idade também foram testados em duas sessões em um único dia.
Análises
Para cada grupo-controle, a RT mediana de cada participante em cada condição (meta esquerda, meta direita, metas bilaterais) foi calculada após a exclusão dos ensaios que se seguiram aos ensaios de captura e daqueles com RTs de <100 ms ou >800 ms. Um teste t de amostra pareada foi feito para confirmar que não havia assimetria para respostas a alvos unilaterais direita e esquerda, e uma RT média para alvos unilaterais foi calculada. O RTE foi calculado subtraindo as RTs para ensaios bilaterais das RTs para ensaios unilaterais. Um teste t de amostra pareada comparada unilateralmente com bilateral para estabelecer se a TTR foi estatisticamente confiável.
Para cada paciente, após excluir os testes após os testes de captura e aqueles com RTs de <100 ms ou >800 ms, um teste t de amostra pareada comparada mediana das RTs para alvos unilaterais contralaterais e ipsilaterais. Como relatado abaixo, as RTs para respostas a alvos contralaterais foram maiores do que para alvos unilaterais ipsilesionais. Para determinar se a presença de um alvo contralesional gerava uma TTR estatisticamente confiável, um teste t de amostras pareadas comparou as RTs medianas para os testes com alvos bilaterais com alvos ipsilesionais unilaterais.
Para testar se a TTR era menor de forma confiável para cada paciente do que para seu respectivo grupo controle, a TTR foi calculada para cada participante controle e os limites superior e inferior dos intervalos de confiança de 95% (IC) foram calculados. O Z-score para cada ETR de cada paciente foi computado em relação ao seu grupo controle e testado para confiabilidade estatística com o teste t de Crawford.
Valores de P para testes t de amostra pareada foram relatados para duas caudas e para Crawford t, uma cauda.
Resultados
Patient RE
Participantes do controle: A média das RTs medianas não diferiu para as respostas esquerda e direita (t = 0,6.) A Figura 6 mostra que as RTs foram mais curtas (as RTE) para alvos bilaterais do que para qualquer um dos alvos esquerdos (t = 6,8, p < 0,001, ou direita (t1,10) = 3,8, p = 0,003) alvos unilaterais. O RT mediano para os testes bilaterais foi subtraído da média do RT mediano para alvos unilaterais para calcular uma TIR média para cada participante controle. A média da ETR média do grupo controle foi de 24,3 ms (SEM = 2,75).
 p>FIGURA 6. Mediana das RTs para o Patient RE, e média das RTs medianas para os participantes do grupo de controle para os alvos que aparecem no campo visual esquerdo (‘Esquerda’), campo visual direito (‘Direita’), e simultaneamente em ambos os campos visuais (‘Ambos’). As barras de erro para os participantes do grupo de controle denotam erros padrão.
p>FIGURA 6. Mediana das RTs para o Patient RE, e média das RTs medianas para os participantes do grupo de controle para os alvos que aparecem no campo visual esquerdo (‘Esquerda’), campo visual direito (‘Direita’), e simultaneamente em ambos os campos visuais (‘Ambos’). As barras de erro para os participantes do grupo de controle denotam erros padrão. As RTs medianas das ERs dos participantes do grupo de controle eram maiores que as dos controles (Figura 6), e estavam acima do limite superior do IC 95% das RTs médias do grupo de controle para as três condições (esquerda = 457 ms; direita = 449 ms; ambas = 426 ms). As RTs para alvos unilaterais no campo contralesional (esquerdo) foram maiores do que para alvos unilaterais no campo ipsilesional (direito) (t = 6,0, p < 0,001).
Importante, não houve RTE: O RT mediano para alvos bilaterais (500 ms) não foi menor do que para alvos unilaterais no campo visual ipsilesional (à direita) (494 ms; t = 1,141), p = ns (Figura 6). A Tabela 1 (superior) mostra que a TIR calculada para a paciente ER foi significativamente menor do que para a TIR do grupo controle.
 p>TABLE 1. Efeito alvo redundante para o paciente RE (superior) e ML (inferior), e RTE médio para seus respectivos grupos de controle com intervalos de confiança de 95% (IC), Z-scores e teste t de Crawford comparando cada paciente com seu respectivo grupo de controle.
p>TABLE 1. Efeito alvo redundante para o paciente RE (superior) e ML (inferior), e RTE médio para seus respectivos grupos de controle com intervalos de confiança de 95% (IC), Z-scores e teste t de Crawford comparando cada paciente com seu respectivo grupo de controle. Patiente ML
Participantes de controle: A média da mediana das RTs não diferiu para respostas aos alvos esquerdo e direito (t = 0,86. A Figura 7 mostra que as RTs foram mais curtas (as RTE) para alvos bilaterais do que para alvos esquerdos (t = 4,7, p = 0,001, ou direitos (t1,11) = 7,8, p < 0,001) alvos unilaterais.

FIGURA 7. Mediana das RTs do paciente ML e média das RTs medianas dos participantes do grupo controle para os alvos que aparecem no campo visual esquerdo, no campo visual direito e simultaneamente em ambos os campos visuais. As barras de erro para os participantes do grupo-controle denotam erros padrão.
RT mediana para ensaios bilaterais de alvos foi subtraída da média da RT mediana para alvos unilaterais esquerda e direita para calcular uma ETR para cada participante do grupo-controle.
A média das RTs do grupo foi de 33 ms (SEM = 6,65).
As RTs médias das MLs do grupo controle foram maiores que as do grupo controle (Figura 7), e estavam acima do limite superior do IC 95% das RTs médias do grupo controle para as três condições (esquerda = 322 ms; direita = 307 ms; ambas = 277 ms). As RTs para alvos unilaterais no campo direito (contralesional) foram maiores do que para alvos unilaterais no campo esquerdo (ipsilesional) (t = 4,9, p = 0,001). Não houve RTE. RTs para alvos bilaterais (361 ms) não foram menores do que para alvos unilaterais no campo visual ipsilesional (esquerda) (363 ms). A Tabela 1 (inferior) mostra que as TTRs calculadas para a paciente ML foram significativamente menores que as TTRs para seu grupo controle.
Discussão
Ts simples foram medidas para detectar alvos individuais no campo contralesional ou ipsilesional, e alvos bilaterais, em dois pacientes nos quais o braquium da SC foi danificado em um hemisfério. Em um dos pacientes (uma mulher jovem), o dano estava no hemisfério esquerdo e era devido a lesão cerebral traumática; e, enquanto a lesão envolvia o colículo inferior e se estendia até o tegmento cerebral médio, o dano à SC per se não era evidente com neuroimagem de alta resolução. Na outra paciente (uma mulher mais velha) o dano estava no hemisfério direito e foi causado por hemorragia hipertensiva que também causou dano extenso ao pulvinar medial e tálamo lateral e se estendeu para o cérebro médio dorsal, incluindo a SC rostral. Em ambos os pacientes a RT simples para detectar alvos visuais no campo contralesional foi retardada em comparação com o campo ipsilesional. Nenhum dos pacientes apresentou efeito de soma espacial (ETR) para detecção do alvo quando os estímulos foram apresentados aos dois campos visuais.
Estas observações esclarecem o papel da SC na detecção do alvo e, mais especificamente, o papel dos aferentes visuais à SC. Posner et al. (1980) definiram operacionalmente a detecção como sendo evidenciada pela capacidade de fazer uma resposta arbitrária a um sinal visual (por exemplo, um simples toque de tecla com um dedo, como no experimento atual). Eles afirmaram que a detecção requer uma alocação de atenção para selecionar o alvo para processamento em um sistema de capacidade limitada que prioriza sua atuação.
Song et al. (2011) mostraram que a inativação do macaco SC causa déficits marcantes na seleção do alvo que não podem ser prontamente explicados como uma simples deficiência na percepção visual ou execução motora, e sugeriram que ela contribui para um mapa de prioridade de propósito mais geral. Nesse experimento os macacos foram apresentados com dois estímulos em campos visuais opostos e tiveram que indicar, com uma resposta de alcance, que apareceu primeiro. Um macaco foi treinado para alcançar o estímulo que apareceu primeiro; e um macaco foi treinado para alcançar o alvo que apareceu em segundo lugar. Em ambos os casos, houve um forte viés contra a seleção do alvo que se encontrava no campo visual contralateral à lesão. Como o mesmo viés foi visto no macaco que atingiu o segundo alvo que apareceu, o viés não podia ser atribuído a um atraso na percepção do alvo contralateral à lesão. A inativação colicular não causou um prejuízo no julgamento perceptual do qual o estímulo apareceu primeiro. Pelo contrário, os estímulos no campo visual contralateral ao colículo inativado estavam em desvantagem em serem priorizados para ação.
Zhaoping (2016) destacou recentemente uma distinção entre mapas de saliência neural e mapas prioritários, e argumentou por uma migração evolutiva de um mapa de saliência perceptual do tectum óptico/SC para o córtex visual primário. Ela propôs que os sinais de saliência podem ser transmitidos para um mapa prioritário no SC sem projetar a propriedade de ajuste da característica.
O braquio do SC transmite sinais visuais aferentes às camadas superficiais do colículo desde a retina através do trato retino-tectal; mas a maioria das fibras visuais aferentes transmitidas através do braquio são projeções do córtex visual primário. Se o braquio for perturbado, os sinais de saliência do córtex visual primário podem ser retransmitidos para o colículo através dos campos oculares frontais. Mas na ausência de projeções diretas para as camadas superficiais do colículo a partir da retina ou do córtex visual, como presumimos ser o caso nos pacientes com lesões braquiais, leva mais tempo para que o mapa de prioridade colicular seja ativado, resultando em respostas mais lentas aos sinais visuais contralesionais.
Como observado na introdução, a contribuição para o RTE que se baseia em um modelo probabilístico de cavalo de corrida depende da detecção de ambos os alvos; e de uma corrida na qual a eficiência dos canais independentes nos quais os dois alvos são transmitidos são equivalentes, de modo que o resultado da corrida para atingir o limiar de detecção é aleatório de ensaio para ensaio. Como o limiar de detecção de sinais contralesionais é maior nos pacientes aqui relatados, alvos redundantes não poderiam se beneficiar com base em uma raça de cavalos estocásticos; ou seja, o resultado da raça entre sinais ipsilesionais e contralesionais não é aleatório – sinais contralesionais têm maior probabilidade de perder a raça do que de vencê-la.
Não obstante, pesquisas em pacientes hemianópicos mostraram que há também um componente de soma neural que contribui para a TIR que não depende da detecção de ambos os alvos (Marzi et al, 1986; Tomaiuolo, 1997; de Gelder et al., 2001). Desde que pacientes commissurotomizados demonstraram ter uma TET (Marzi et al., 1986; Reuter-Lorenz et al., 1995), tem sido argumentado que a integração interhemisférica de sinais através do meridiano vertical deve ocorrer subcorticamente.
Savazzi e Marzi (2004) mostraram que a soma neural não ocorreu com estímulos cromáticos de curto comprimento de onda em pessoas neurologicamente intactas ou pacientes com cérebro dividido. Leh et al. (2006b) relataram que, embora um ETR tenha ocorrido com estímulos acromáticos em alguns pacientes hemianópicos hemisferectomizados, não houve ETR nesses pacientes quando foram usados como alvos estímulos cromáticos de ondas curtas. Os estímulos de ondas curtas (ou seja, roxos) ativam apenas os ossos em S na retina. As células ganglionares da retina que recebem entrada de S-cones não se projetam diretamente para a CC, nem para as camadas magnocelulares do núcleo geniculado lateral (De Monasterio, 1978). Desde projeções do córtex visual primário até o SC através do braquium do relé visual SC somente sinais visuais de aferentes geniculóstriados magnocelulares (Schiller et al.., 1979), o insucesso dos estímulos de S-cone em gerar um RTE sugere que a soma neural ocorre na SC e é dependente de aferentes visuais transmitidos através de seu braquium.
Existe, assim, evidência convergente em pacientes com cérebro dividido, pacientes hemianópicos com visão cega, e de experimentos usando estímulos de ondas curtas, que a soma neural ocorre na SC. Entretanto, enquanto os estímulos de ondas curtas não ativam células ganglionares da retina que se projetam para a CC através do braquio, não se pode concluir que o colículo é totalmente cego para tais estímulos. Gravações unitárias em macacos SC têm demonstrado que os estímulos de comprimento de onda curto ativam respostas em camadas superficiais do colículo. Além disso, a tractografia tem demonstrado, naqueles pacientes hemisferectomizados com um ETR (ou seja, cegos), mas não naqueles pacientes que não mostraram evidência de cegos visuais, que a SC tinha conexão com o hemisfério intacto (Leh et al, 2006a).
Os resultados da investigação atual, portanto, fornecem a primeira evidência direta de que a soma espacial ocorre na SC que é dependente da transmissão de sinais visuais através de seu braquium.
Ethics Statement
Este estudo foi realizado de acordo com as diretrizes e com a aprovação do protocolo do NHS Ethics Committee, Bangor, Reino Unido, e do School of Psychology Ethics Committee da Universidade de Bangor, Reino Unido. O consentimento livre e esclarecido oral e escrito foi obtido de todos os participantes de acordo com a Declaração de Helsinki.
Contribuições dos autores
MvK: Conceberam a pesquisa, desenharam e programaram o experimento, coletaram e analisaram os dados dos pacientes e contribuíram para a redação do manuscrito. KK: Coletou dados de controle, revisou a literatura relevante, analisou dados de controle e contribuiu para a redação do manuscrito. RR: Recrutou pacientes e analisou estudos de neuroimagem incluindo dissecção virtual com tractografia DTI, preparou histórias de casos de pacientes e contribuiu para escrever o manuscrito.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Behrens, T., Woolrich, M. W., Jenkinson, M., Johansen-Berg, H., Nunes, R. G., Clare, S., et al. (2003). Characterization and propagation of uncertainty in diffusion-weighted MR imaging. Magn. Reson. Med. 50, 1077-1088. doi: 10.1002/mrm.10609
PubMed Abstract | CrossRef Full Text | Google Scholar
Behrens, T. E., Berg, H. J., Jbabdi, S., Rushworth, M. F., e Woolrich, M. W. (2007). Tractografia de difusão probabilística com múltiplas orientações de fibras: o que podemos ganhar? Neuroimage 34, 144–155.
Google Scholar
de Gelder, B., Pourtois, G., van Raamsdonk, M., Vroomen, J., and Weiskrantz, L. (2001). Unseen stimuli modulate conscious visual experience: evidence from interhemispheric summation. Neuroreport 12, 385–391. doi: 10.1097/00001756-200102120-00040
CrossRef Full Text | Google Scholar
De Monasterio, F. M. (1978). Properties of ganglion cells with atypical receptive-field organization in retina of macaques. J. Neurophysiol. 41, 1435–1449.
PubMed Abstract | Google Scholar
Fries, W. (1984). Cortical projections to the superior colliculus in the macaque monkey: a retrograde study using horseradish peroxidase. J. Comp. Neurol. 230, 55–76. doi: 10.1002/cne.902300106
PubMed Abstract | CrossRef Full Text | Google Scholar
Georgy, L., Celeghin, A., Marzi, C. A., Tamietto, M., and Ptito, A. (2016). O colículo superior é sensível à configuração de estímulo gestual em pacientes com hemisferectomia. Cortex 81, 151-161. doi: 10.1016/j.cortex.2016.04.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Hershenson, M. (1962). Tempo de reacção como medida de facilitação intersensorial. J. Exp. Psychol. 63, 289-293. doi: 10.1037/h0039516
CrossRef Full Text | Google Scholar
Hikosaka, O., e Wurtz, R. (1983). Funções visuais e oculomotoras do macaco substantia nigra pars reticulata. III. respostas visuais e de sacadela contingentes de memória. J. Neurophysiol. 49, 1268-1284.
PubMed Abstract | Google Scholar
Leh, S. E., Johansen-Berg, H., e Ptito, A. (2006a). Unconscious vision: new insights into the neuronal correlate of blindsight using diffusion tractography. Brain 129(Pt 7), 1822–1832.
PubMed Abstract | Google Scholar
Leh, S. E., Mullen, K. T., and Ptito, A. (2006b). Absence of S-cone input in human blindsight following hemispherectomy. Eur. J. Neurosci. 24, 2954–2960.
PubMed Abstract | Google Scholar
Marzi, C., Tassinari, G., Aglioti, S., and Lutzemberger, L. (1986). Spatial summation across the vertical meridian in hemianopics: a test of blindsight. Neuropsychologia 24, 749–758. doi: 10.1016/0028-3932(86)90074-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Miller, J. (1982). Divided attention: evidence for coactivation with redundant signals. Cogn. Psychol. 14, 247–279. doi: 10.1016/0010-0285(82)90010-X
CrossRef Full Text | Google Scholar
Miniussi, C., Girelli, M., and Marzi, C. A. (1998). Neural site of the redundant target effect electrophysiological evidence. J. Cogn. Neurosci. 10, 216–230. doi: 10.1162/089892998562663
CrossRef Full Text | Google Scholar
Pare, M., and Wurtz, R. (1997). Monkey posterior parietal cortex neurons antidromically activated from superior colliculus. J. Neurophysiol. 78, 3493–3497.
PubMed Abstract | Google Scholar
Poliva, O., Bestelmeyer, P. E., Hall, M., Bultitude, J. H., Koller, K., and Rafal, R. D. (2015). Mapeamento funcional do córtex auditivo humano: investigação por fMRI de um paciente com agnosia auditiva desde o trauma até o colículo inferior. Cogn. Behav. Neurol. 28, 160-180. doi: 10.1097/WNN.0000000000000072
PubMed Abstract | CrossRef Full Text | Google Scholar
Posner, M., Snyder, C., e Davidson, B. (1980). Atenção e a detecção de sinais. J. Exp. Psychol. Gen. 109, 160-174. doi: 10.1037/0096-3445.109.2.160
CrossRef Full Text | Google Scholar
Raab, D. H. (1962). Facilitação estatística dos tempos de reacção simples. Trans. N. Y. Acad. Sci. 24, 574-590. doi: 10.1111/j.2164-0947.1962.tb01433.x
CrossRef Full Text | Google Scholar
Reuter-Lorenz, P., Nozawa, G., Gazzaniga, M. S., e Hughes, H. C. (1995). Fate of negliglected targets: a chronometric analysis of redundant target effects in the bisected brain. J. Exp. Psychol. Hum. Percept. Perform. 21, 211-230. doi: 10.1037/0096-1523.21.2.211
PubMed Abstract | CrossRef Full Text | Google Scholar
Savazzi, S., e Marzi, C. A. (2004). O colículo superior subserva a soma neural interhemisférica tanto em normais como em pacientes com uma secção total ou agenesia do corpo caloso. Neuropsicologia 42, 1608-1618. doi: 10.1016/j.neuropsicologia.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Schiller, P. H., Malpeli, J. G., and Schein, S. J. (1979). Composição do geniculostriate input do colículo superior do macaco rhesus. J. Neurophysiol. 42, 1124-1133.
PubMed Abstract | Google Scholar
Sommer, M., e Wurtz, R. (2000). Composição e organização topográfica dos sinais enviados do campo ocular frontal para o colículo superior. J. Neurophysiol. 83, 1979–2001.
PubMed Abstract | Google Scholar
Song, J. H., Rafal, R. D., and McPeek, R. M. (2011). PNAS Plus: deficits in reach target selection during inactivation of the midbrain superior colliculus. Proc. Natl. Acad. Sci. U.S.A. 108, E1433–E1440. doi: 10.1073/pnas.1109656108
PubMed Abstract | CrossRef Full Text
Tomaiuolo, F. (1997). Blindsight in hemispherectomized patients as revealed by spatial summation across the vertical meridian. Brain 120, 795–803. doi: 10.1093/brain/120.5.795
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhaoping, L. (2016). From the optic tectum to the primary visual cortex: migration through evolution of the saliency map for exogenous attentional guidance. Curr. Opin. Neurobiol. 40, 94–102. doi: 10.1016/j.conb.2016.06.017
PubMed Abstract | CrossRef Full Text | Google Scholar