1) Bevezetés
A szív kiáramlási traktus (OFT) egy átmeneti struktúra a szív artériás pólusán, amely az embrionális kamrákat az aortazsákkal köti össze. Az OFT a szívhurok kialakulása során a szív progenitor sejtjeiből alakul ki a garat mezodermában. Maximális kiterjedésében az OFT egy endokardiális sejtekkel bélelt, torzult szívizomhenger, ortogonális, de egymás mellett elhelyezkedő proximális (kúpos) és disztális (törzsi) tartományokkal. Az OFT később átalakul, a kamrai szeptációval egyidejűleg, amely folyamat során az OFT fala elfordul és osztódik, hogy létrehozza a felszálló aorta és a tüdőtörzs alapját. Az OFT átalakulása a kivezető szeptum kialakulásával, a semilunáris billentyű morfogenezisével, a koszorúér arteriogenezissel és a nagy artériák alapjának szívizom- és simaizom komponenseinek érésével jár együtt. Az OFT megnyúlásának és átalakulásának genetikai vagy környezeti perturbációja conotruncalis veleszületett szívhibákhoz vezet, amelyek az összes veleszületett szívhiba 30%-át teszik ki (az élve születések kb. 0,3%-a) (Bruneau, 2008; Srivastava és Olson, 2000). Az OFT morfogenezisének kiterjedt anatómiai, kísérletes és genetikai vizsgálatai több sejttípus és jelátviteli útvonal részvételét tárták fel az OFT fejlődésében, ami arra utal, hogy a fejlődési komplexitás áll az emberben előforduló OFT-rendellenességek gyakoriságának hátterében.
2) OFT kialakulása
A szívcső megnyúlása során a szív artériás pólusához a szívizom fokozatosan hozzáadódik a szív második szívmezejének (SHF; 1A ábra) nevezett progenitor sejtpopulációból a garat mezodermában (Buckingham et al, 2005; Kelly és Buckingham, 2002), (Cai és mtsai., 2003). Az SHF a mezodermában medialisan, de a korai szívcsövet adó sejtekkel szomszédosan helyezkedik el; később az SHF sejtek a ventrális előbél endoderma alá kerülnek, és a szívburok dorzális falát alkotják. Az SHF a szív vénás pólusán és AV régióin kívül a jobb kamrához is hozzájárul; a progenitor sejtek azon populációját, amely kizárólag az artériás pólushoz járul hozzá, elülső vagy másodlagos szívmezőnek nevezik. Az SHF fejlődésének kritikus transzkripciós szabályozóit azonosították, és ezek közé tartoznak az Isl1, Foxh1, Tbx1, Pitx2 és Mef2c transzkripciós faktorok (áttekintve: (Buckingham et al., 2005)). Az SHF kulcsfontosságú tulajdonságai közé tartozik a mediális pozíció, a differenciálódás késleltetése és a korai szívcsövet létrehozó sejtekhez képest megnövekedett proliferáció. Ezeket a tulajdonságokat mind belsőleg, mind a környező CNC sejtek és a garat ektoderma és endoderma által szabályozzák a fibroblaszt növekedési faktor, a csont morfogenetikus protein, a Hedgehog és a Wnt jelátviteli molekulák aktivitásán keresztül (Cohen et al., 2008; Goddeeris et al., 2007; Park et al., 2008; Prall et al., 2007). Ezek a jelek együttesen határozzák meg az SHF progenitor sejteket fenntartó niche-t és szabályozzák progresszív bevetésüket az OFT kiterjesztése során (Rochais és mtsai., 2009). Az OFT-t endokardiális sejtek bélelik, amelyekről szintén úgy gondolják, hogy a garat mezodermából származnak (Laugwitz et al., 2008).
A szívcső megnyúlása során a szív artériás pólusához fokozatosan hozzáadódik a szívizom a garat mezodermában található progenitor sejtpopulációból, amelyet második szívmezőnek (SHF; 1A ábra) neveznek (Buckingham et al., 2005; Kelly és Buckingham, 2002), (Cai et al., 2003). Az SHF a mezodermában medialisan, de a korai szívcsövet adó sejtekkel szomszédosan helyezkedik el; később az SHF sejtek a ventrális előbél endoderma alá kerülnek, és a szívburok dorzális falát alkotják. Az SHF a szív vénás pólusán és AV régióin kívül a jobb kamrához is hozzájárul; a progenitor sejtek azon populációját, amely kizárólag az artériás pólushoz járul hozzá, elülső vagy másodlagos szívmezőnek nevezik. Az SHF fejlődésének kritikus transzkripciós szabályozóit azonosították, és ezek közé tartoznak az Isl1, Foxh1, Tbx1, Pitx2 és Mef2c transzkripciós faktorok (áttekintve: (Buckingham et al., 2005)). Az SHF kulcsfontosságú tulajdonságai közé tartozik a mediális pozíció, a differenciálódás késleltetése és a korai szívcsövet létrehozó sejtekhez képest megnövekedett proliferáció. Ezeket a tulajdonságokat mind belsőleg, mind a környező CNC sejtek és a garat ektoderma és endoderma által szabályozzák a fibroblaszt növekedési faktor, a csont morfogenetikus protein, a Hedgehog és a Wnt jelátviteli molekulák aktivitásán keresztül (Cohen et al., 2008; Goddeeris et al., 2007; Park et al., 2008; Prall et al., 2007). Ezek a jelek együttesen határozzák meg az SHF progenitor sejteket fenntartó niche-t és szabályozzák progresszív bevetésüket az OFT kiterjesztése során (Rochais és mtsai., 2009). Az OFT-t endokardiális sejtek bélelik, amelyekről szintén feltételezhető, hogy a garat mezodermájából származnak (Laugwitz et al., 2008).
Az OFT kialakulása során a szív artériás pólusa a garat régiójában kaudálisan eltolódik, ahogy a garatív morfogenezise és a kétoldali aortaív artériák kialakulása zajlik (Waldo et al., 2005b). A dorsalis neurális csőből származó CNC sejtek az OFT disztális régiójának kialakulása során a caudalis garatíveken keresztül vándorolnak a szív OFT-jébe (1B ábra) (Hutson és Kirby, 2003). Az OFT átalakításában játszott kritikus szerepük mellett a CNC sejtek korai szerepet játszanak a proliferáció korlátozásában és az SHF településének szabályozásában (Waldo és mtsai., 2005a). Ahogy a CNC sejtek belépnek a disztális OFT-be, az OFT proximális régiójában lévő endotélsejtek a szívizomból származó jelekre válaszul epithelialis-mesenchymalis átmenet folyamatán mennek keresztül, hogy a behatoló neurális crest sejtekkel együtt OFT-párnákat képezzenek a szívizom és az endotél rétegek között (Sugishita és mtsai., 2004b). Az OFT-párnák spirális struktúrában történő konvergenciája elválasztja a lamináris áramlást az embrionális bal és jobb kamrától. A párnák kialakulása több intercelluláris jelátviteli útvonaltól függ, beleértve a b transzformáló növekedési faktor, a fibroblaszt növekedési faktor, a csontmorfogenetikai fehérje, a VEGF, a Notch és a nem-kanonikus Wnt jelátvitelt (Wagner és Siddiqui, 2007). Az OFT maximális hosszát az egérnél a középső stádiumban (E10,5), illetve az embernél a 4. fejlődési héten éri el.
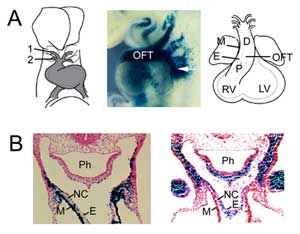
1. ábra
OFT kialakulása. (A) Az OFT az egér embrió 8,5. napján az első (1) és a második (2) aortaív artériához kapcsolódik (balra), és a második szívmező progenitor sejtjeinek a garat mezodermából történő hozzáadásával bővül (középen, nyíl), amit E9,5-ben Fgf10 enhancer trap transzgénnel vizualizáltunk. Az OFT a 10,5. embrionális napon éri el maximális hosszát, és proximális (P) és disztális (D) régiókból áll. (B) Az Fgf10 transzgén expressziójának összehasonlítása az OFT-ben és a második szívmezőben (balra) a neurális gerincből származó sejtekkel (jobbra) a disztális OFT-ben E9,5-ben. A jobb oldali panel a Jiang és munkatársai, 2001, Development 127:1607-16, engedélyével reprodukálva. M, myocardium; E, endocardium; RV, jobb kamra; LV, bal kamra; Ph, garat; NC, neurális gerincből származó sejtek.
3) OFT remodelling
Az OFT remodelling során a bal kamra önálló kivezető nyílást, a felszálló aortát kap, amely a születéskor az oxigéndús vér számára kritikus szisztémás csatornát biztosít. A hengeres OFT a felszálló aorta és a tüdőtörzs (a jobb kamra kivezetése) alapjává alakul át az atrioventricularis szeptációval és az aortaív artéria remodellingjével egyidejűleg az egér vemhesség 10,5. és 14,5. napja között. Az OFT remodelling összetett folyamat, amelyhez a genetika és a hemodinamika egyaránt hozzájárul (Yashiro és mtsai., 2007). Az OFT-párna fejlődésének és a CNC sejteknek kritikus szerepe ebben a folyamatban megalapozott (Sugishita és mtsai., 2004b). A proximális OFT myocardium beépül a kamrai kimenetbe, és az invazív myocardializáció folyamata a proximális kimeneti szeptum izmosodásához vezet (Rana és mtsai., 2007; van den Hoff és mtsai., 2001). Az aortopulmonális septum benövése a 4. és 6. aortaív artéria között elválasztja a distalis OFT-t a felszálló aortától és a tüdőtörzstől (2A ábra). Sima izomfalak alakulnak ki a nagy artériák tövében a második szívmező végső hozzájárulásából és distalisabban a CNC-kből (Sugishita et al., 2004b; Waldo et al., 2005b).
Az OFT szeptációját az OFT falának az óramutató járásával ellentétes irányú elfordulása kíséri, ami az aorta bal kamrához és a tüdőtörzs jobb kamrához való igazodását eredményezi (Bajolle et al., 2006). Ezt a szeptációs folyamatot az OFT, az atrioventrikuláris és a kamrai szepták konvergenciája zárja le (2A. ábra). Az eredeti disztális OFT szívizomfal részben hozzájárul a jobb kamrai szubpulmonális szívizomhoz, részben pedig hipoxia által vezérelt programozott sejthalálon megy keresztül a kamra-artériás összehangolódás során (Rana és mtsai., 2007; Sugishita és mtsai., 2004a). A remodellációs folyamat során az OFT proximális és disztális régióinak szögletes találkozásánál az eredeti és két interkalált OFT-párnából szemilunáris billentyűk alakulnak ki (Anderson és mtsai., 2003). A koronária arteriogenezis az a folyamat, amelynek során az epikardiális eredetű koszorúér-plexus szelektíven behatol az aorta aljába a tüdőtörzs felé néző két billentyűlebeny felett, és ostiumokat képez, amelyek összekötik a koszorúérrendszert a felszálló aortával (2B ábra) (Tomanek, 2005).
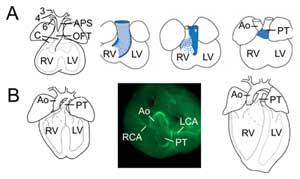
2. ábra.
A kiáramlási traktus átalakulása. (A) A 11,5. embrionális napon az OFT a harmadik (3), negyedik (4) és hatodik (6) aortaív artériához kapcsolódik (balra). Az aorticopulmonalis septum (APS) elválasztja a distalis OFT-t a felszálló aortára (Ao) és a tüdőtörzsre (PT), amely az OFT-párnákkal konvergál (C). A jobb oldali három kép a szívizomfal progresszív elfordulását mutatja az OFT-szeptáció során: a dorzális fal a 10,5. embrionális napon (kék) ventrális szubpulmonális szívizmot eredményez. (B) A 14,5. embrionális napon az OFT-szeptáció befejeződött, és az aorta a bal kamrához, a tüdőtörzs pedig a jobb kamrához kapcsolódik. Felső nézetben (középen) a simaizomaktin immunkémia kimutatja a bal (LCA) és a jobb (RCA) koszorúérnek az aorta alapjához való kapcsolódását. A végleges szív felépítése (jobbra). RV, jobb kamra; LV, bal kamra.
4) Konotruncális veleszületett szívhibák
Az OFT fejlődésének alapvető fejlődési komplexitását tükrözi a konotruncális anomáliák nagy gyakorisága az emberben (Bruneau, 2008; Srivastava és Olson, 2000). Az SHF vagy a CNC kialakulásának, illetve az OFT remodellingjének hibája hozzájárul a humán patológiában és állatmodellekben megfigyelt conotruncalis defektusok spektrumához (3. ábra) (Moon, 2008).
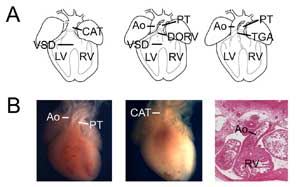
3. ábra.
Congenitalis szívhibák. (A) A közös artériás törzset (vagy perzisztáló truncus arteriosus, CAT, balra), a kettős kivezetésű jobb kamrát (DORV, középen) és a nagy artériák transzpozícióját (TGA, jobbra) bemutató karikatúrák. VSD, kamrai szeptumdefektus; RV, jobb kamra; LV, bal kamra, Ao, aorta; PT, tüdőtörzs. (B) Példák a veleszületett szívhibák egérmodelljeire. Kontroll szív, amely az aortát és a tüdőtörzset mutatja (balra), összehasonlítva egy Tbx1 null szívvel (középen), egyetlen kamrai kivezetéssel (CAT). Példa transzpozíciós típusú kettős kivezetésű jobb kamra, amely a Tbx3 null szívben (jobbra) a jobb kamrával összekapcsolt aortát mutatja.
Míg az SHF fejlődésének súlyos károsodása a szívcső megnyúlásának elmaradásához vezet, addig az enyhébb hibák ventrikuloarteriális igazodási rendellenességeket eredményeznek, és az aorta nem tud önálló kapcsolatot kialakítani a bal kamrával (Abu-Issa és Kirby, 2007). Ezek a hibák lehetnek az SHF sajátjai, vagy érinthetik a környező sejttípusokat (CNC vagy torokhám), amelyek az SHF progenitorsejt niche-jét szabályozzák. Az ilyen defektusok kettős kivezetésű jobb kamrát, túlnyúló aortát, pulmonális hipoplasiát, pulmonális atresiát és Fallot tetralógiát eredményezhetnek. A CNC elvesztése vagy csökkenése az OFT-szeptáció elmaradásához vagy késedelméhez vezet, ami tartós truncus arteriosust vagy kettős kivezetésű jobb kamrát eredményez; a CNC hiánya közvetve befolyásolja az SHF fejlődését is, ami egy összetett igazodási és szeptációs fenotípust eredményez (Hutson és Kirby, 2003). Az OFT falának forgási hibája az OFT remodelling során szintén igazodási hibákat eredményez, beleértve a nagy artériák transzpozícióját, a kettős kivezetésű jobb kamrát és a túllógó aortát, általában az embrionális lateralitás hibáit követően (Bajolle és mtsai., 2006; Bamforth és mtsai., 2001). Az OFT-szeptum kialakulásának hibái a szívizomfal differenciálódásának későbbi elmaradásából és a remodellinghez nélkülözhetetlen folyamatok, mint például a programozott sejthalál vagy a myocardializáció anomáliáiból is adódhatnak (Park és mtsai., 2008). Az OFT endokardiális sejtek intrinzikális hibái, valamint a hemodinamikai változások szintén bizonyítottan vezetnek OFT-anomáliákhoz 16, (Zhang és mtsai., 2009), (Bartman és Hove, 2005; Yashiro és mtsai., 2007). Végül, az abnormális proximális koszorúér-mintázat gyakran társul konotrinkális defektusokkal, és önmagában jelentős oka a hirtelen szívhalálnak (Angelini és mtsai., 2002). A jelenlegi kutatási célok között szerepel a conotruncális defektusok etiológiájának jobb megértése a kiváltó genetikai mutációk és módosítók genom-széles körű szűrésekkel történő azonosítása révén, valamint a genetikai és epigenetikai szereplők relatív hozzájárulásának feltárása az OFT kialakulásában és átalakulásában állatmodellek segítségével. Ezek a vizsgálatok betekintést nyújtanak az OFT morfogenezisét irányító és a betegségmechanizmusok célpontjait képező jelátviteli útvonalakba és sejtfolyamatokba.