Világszerte 36 millió ember szenved teljes látásvesztésben1. Nem látják a formákat, de még a fényforrásokat sem. A legtöbb ilyen ember vaksága olyan orvosolható problémákból ered, mint a szürkehályog – egyszerűen nem férnek hozzá a megfelelő egészségügyi ellátáshoz. A fennmaradó milliók azonban olyan betegségek következtében vakulnak meg, amelyek jelenleg nem rendelkeznek hatékony kezeléssel.
“A vakság az egyik legmegváltoztatóbb állapot, amelyet egy ember átélhet” – mondja William Hauswirth, a Gainesville-i Floridai Egyetem szemészorvosa. A látáskárosodás a mobilitás és a munkakeresés nehézségei mellett számos más egészségügyi problémával is jár, beleértve az álmatlanságot, a szorongást és a depressziót, sőt az öngyilkosság kockázatát is. “A hasznos látás helyreállítása szinte elképzelhetetlen javulást jelentene az életminőségben” – mondja Hauswirth.
A magas jövedelmű országokban, ahol a látáskárosodás megelőzhető okaival rutinszerűen foglalkoznak, a vakság vezető oka a retina degenerációja. Ez a szem hátsó részén található szövet olyan speciális sejteket tartalmaz, amelyek reagálnak a fényre és feldolgozzák a vizuális jeleket, és ezért kulcsfontosságú a látás szempontjából. A fotoreceptorsejtek – az általánosan pálcikák és csapok néven ismert neuronok – a retinára érkező fényt elektrokémiai jelekké alakítják. Ezek a jelek ezután más neuronok, köztük bipoláris sejtek, amakrin sejtek és horizontális sejtek bonyolult hálózatán szűrődnek át, mielőtt elérnék a retina ganglionsejtjeiként ismert neuronokat. E sejtek hosszú nyúlványai vagy axonjai alkotják a látóideget, amelyen keresztül a retináról érkező jelek az agy látókéregébe jutnak, ahol azokat képként értelmezik.
A retina rendellenességei általában a fotoreceptorsejtek elvesztésével járnak, ami csökkenti a szem fényérzékenységét. Egyes retinabetegségek, köztük az időskori makuladegeneráció (AMD) esetében ez a veszteség a retina hátsó részén található, retinális pigmenthámnak (RPE) nevezett réteget alkotó hámsejtek meghibásodásából ered. Az RPE a fényreakció során keletkező toxikus melléktermékek megtisztításával, valamint a tápanyagok biztosításával tartja egészségesen a fotoreceptorsejteket. Azokban a retinabetegségekben, amelyekben a fotoreceptorok jó állapotban maradnak, a vakság fő oka a retina ganglionsejtjeinek degenerációja.
Hallgassa meg a cikk hangos változatát
Your browser does not support the audio element.
A látáskárosodás okainak sokfélesége megnehezíti a megoldások megtalálását. A több területen elért előrelépések azonban felcsillantják a reményt, hogy a retina rendellenességének szinte minden formája kezelhetővé válhat.
Az egyik megközelítés a sérült szemek funkcionális protézisekkel történő kiegészítése vagy áthidalása. Az ilyen bionikus szemek jelenleg csak korlátozottan képesek helyreállítani a látást, de a kutatók tovább fejlesztik az eszközök képességeit. Egy másik lehetőség a génterápia. Ez már elérhető bizonyos genetikai mutációkkal rendelkező emberek számára, de a kutatók arra törekszenek, hogy ezt a megközelítést több emberre és állapotra is kiterjesszék. Egyes tudósok az optogenetika nevű kapcsolódó technikán alapuló kezelésekkel is foglalkoznak, amely a sejtek genetikai módosítását jelenti a retina fényérzékenységének helyreállítása érdekében. Ez a munka még korai stádiumban van, de a kutatók remélik, hogy ez a megközelítés végül az emberek széles körén tud majd segíteni, mivel a retina degeneráció okaitól független. A retina elvesztett vagy károsodott sejtjeinek helyben vagy sejtátültetéssel történő pótlására irányuló erőfeszítések pedig arra utalnak, hogy még a késői stádiumban lévő retinabetegségek is kezelhetővé válhatnak.
A kutatások nagy része még gyerekcipőben jár. Hauswirth azonban bizakodó a már elért eredményekkel kapcsolatban. Tíz évvel ezelőtt, mondja, gyakran kellett azt mondania a betegeknek, hogy semmit sem tud tenni értük. “Sok ilyen betegség esetében ez teljesen megváltozott.”
Bionikus szemek
Majdnem 30 évvel ezelőtt Mark Humayun, a Los Angeles-i Dél-Kaliforniai Egyetem biomérnöke elkezdte elektromosan stimulálni a vakságban szenvedő emberek retináját. A kaliforniai Sylmarban működő Second Sight Medical Products orvosi technológiai cég munkatársaival együttműködve kísérletei kimutatták, hogy az ilyen ingerlés képes a foszféneknek nevezett fényfoltok vizuális érzékelését kiváltani. Miután egy évtizedig dolgoztak állatokon, hogy megállapítsák, mekkora elektromos áramot lehet biztonságosan a szembe juttatni, és a degenerálódó emberi retinában megmaradó sejtek számáról és típusairól szerzett, jelentősen megnövekedett ismeretek birtokában Humayun csapata készen állt arra, hogy emberekkel kezdjen el dolgozni. A kutatók 2002 és 2004 között hat olyan emberbe ültettek be egy-egy bionikus szemet, akik egyik szemükre teljesen vagy majdnem teljesen megvakultak – ez volt az első ilyen jellegű kísérlet. Az Argus I néven ismert eszköz befogadói arról számoltak be, hogy képesek voltak érzékelni a foszféneket, az irányított mozgást és még a formákat is2. Jelenleg mintegy 300 ember tapasztalja a világot a készülék utódja, az Argus II segítségével, amelyet az európai szabályozó hatóságok 2011-ben hagytak jóvá retinitis pigmentosában szenvedő emberek számára – a ritka genetikai rendellenességek egy csoportja, amely a fotoreceptorsejtek degenerációját okozza. Az amerikai Élelmiszer- és Gyógyszerügyi Hatóság (FDA) két évvel később követte a példát.

A Argus II implantátum egy elektródasort tartalmaz, amelyet a retina felületére rögzítenek.Credit: Ringo Chiu/ZUMA /Alamy
Az Argus II implantátum beültetéséhez a betegek műtéten esnek át, amelynek során egy elektródasort tartalmazó chipet rögzítenek a retina felszínére. A készülékkel való “látáshoz” egy szemüvegre szerelt miniatűr videokamera továbbítja a jeleket egy feldolgozó egységnek, amelyet a recipiens visel. A processzor a jeleket utasításokká alakítja, amelyeket vezeték nélkül továbbít a beültetett eszközhöz. Az elektródák ezután stimulálják a retina ganglionsejtjeit a retina elülső részén. A protézis használata tanulási folyamat. A viselőnek be kell tanítania az agyát, hogy értelmezze a kapott új típusú információkat. És mivel a videokamera nem követi a szem mozgását, azt is meg kell tanulniuk, hogyan mozgassák a fejüket a tekintet irányításához.
A készülék csak korlátozott látást biztosít. A felhasználók érzékelik a fényforrásokat és a nagy kontrasztú szélekkel rendelkező tárgyakat, például az ajtókat vagy az ablakokat, és néhányan meg tudják fejteni a nagy betűket. Ezek a korlátok részben azért merülnek fel, mert az eszköz 60 elektródája nagyon alacsony felbontást biztosít az egészséges szem több millió fotoreceptorsejtjéhez képest. De még ez a minimális javulás is jelentősen javíthatja az emberek életét.
Míg az Argus II egy epiretinalis implantátum – ami azt jelenti, hogy a retina felszínén helyezkedik el -, más, fejlesztés alatt álló eszközöket a retina alá terveztek. Ezek a retina alatti implantátumok olyan sejteket képesek stimulálni, amelyek közelebb vannak azokhoz, amelyek normális esetben jeleket juttatnak a retinába – a fotoreceptor sejtekhez. A látópálya magasabb pontjain elhelyezkedő sejtek stimulálásával a kutatók azt remélik, hogy az egészséges retina által végzett jelfeldolgozásból többet megőrizhetnek.
A reutlingeni (Németország) biotechnológiai vállalat, a Retina Implant olyan szubretinális implantátumot készített, amely fotodiódákat (a fényt elektromos árammá alakító félvezető eszközök) tartalmaz, amelyek közvetlenül érzékelik a szembe érkező fényt. Ez kiküszöböli a külső videokamera szükségességét, lehetővé téve a felhasználók számára, hogy tekintetüket természetes módon irányítsák. Az áramellátást egy kézben tartott egység biztosítja egy tekercsen keresztül, amelyet a fül fölé, a bőr alá ültetnek. A rendszer jelenlegi változata, az Alpha AMS már megkapta a hatósági engedélyt Európában a retinitis pigmentosában szenvedőknél történő alkalmazásra.
A párizsi Pixium Vision egy Prima nevű fotovoltaikus szubretinális implantátumot tesztel. A rendszer egy szemüvegre szerelt videokamerából közel infravörös fényt használó jeleket vetít a szembe, amelynek hullámhossza optimálisan vezérli az eszközben lévő fotodiódákat a retinasejtek stimulálása érdekében. A képek ily módon történő kivetítése némi kontrollt biztosít a felhasználóknak a tekintetük iránya felett, mivel csak a szemük mozgatásával fedezhetik fel a jelenetet. Az áramellátást is a közeli infravörös fény biztosítja, így az implantátum vezeték nélküli, és a felszereléséhez szükséges műtét kevésbé bonyolult. “A betegek gyorsabban tanulják meg, hogyan nyerhetik vissza a látásukat, és a felbontás is jobbnak tűnik” – mondja José-Alain Sahel, a pennsylvaniai Pittsburgh-i Egyetem szemészorvosa, aki tíz AMD-s emberen végzi az eszköz biztonsági tesztjeit. “Korai még, de ez nagyon ígéretes.”
Az összes ilyen eszköz csak akkor működik, ha a retinában működőképes sejtek maradnak. Az olyan gyakori szembetegségeknél, amelyek főként a fotoreceptorsejteket érintik, beleértve a retinitis pigmentosát és az AMD-t, általában marad néhány sejt, amelyeket stimulálni lehet. Ha azonban túl sok retinális ganglionsejt pusztul el, mint az előrehaladott diabéteszes retinopátiában és glaukómában, az ilyen implantátumok nem tudnak segíteni. Azoknál az embereknél, akiknek nincs megmaradt retina funkciója, akár betegség, akár sérülés miatt, egy alternatív bionikus megközelítés lehet célravezetőbb.
Humayun és kollégái egy olyan rendszeren dolgoznak, amely a szemet megkerülve egyenesen az agyba küldi a jeleket. Az ötlet nem új: az 1970-es években William Dobelle amerikai biomérnök kimutatta, hogy a látókéreg közvetlen stimulálása kiváltja a foszfének érzékelését3. A bionikus szemtechnológia azonban csak most kezd felzárkózni. A Second Sight kifejlesztette az Oriont, egy olyan rendszert, amely Humayun szerint “alapvetően egy módosított Argus II”. Az eredetihez hasonlóan ez is videokamerát és jelfeldolgozó processzort használ, amely vezeték nélkül kommunikál az implantátummal, de a chipet nem a retinán, hanem a látókéreg felszínén helyezik el. Az eszközt öt olyan emberen tesztelik, akik szemsérülés, illetve a retina vagy a látóideg károsodása miatt korlátozottan vagy egyáltalán nem érzékelik a fényt. “Az eddigi eredmények jók” – mondja. “Még semmi sem lepett meg minket.”
Mivel a technológia egy részét már kipróbálták és tesztelték embereken, Humayun optimista, hogy a rendszer néhány éven belül megkaphatja a hatósági engedélyt. “Nyilvánvaló, hogy az agyműtéteknek más a kockázati szintje, de az eljárás elég egyszerű, és az Orion sokkal több betegnek segíthet” – mondja. Az agy hasznos látást biztosító stimulálásáról azonban sokkal kevesebbet tudunk. “Sokat tudunk a retináról, de nagyon keveset az agykéregről” – mondja Roska Botond, a svájci Bázeli Molekuláris és Klinikai Szemészeti Intézet neurobiológusa. “De sosem fogunk eleget tudni, ha nem próbálkozunk” – mondja.”
Génterápia
A szem ideális célpont a génterápia számára. Mivel viszonylag zárt, a vírusoknak, amelyekkel a retina sejtjeibe géneket juttatnak, nem szabadna eljutniuk a test más részeibe. És mivel a szem egy immunprivilégiummal rendelkező hely, az immunrendszer kevésbé valószínű, hogy védekezni tudna egy ilyen vírus ellen.
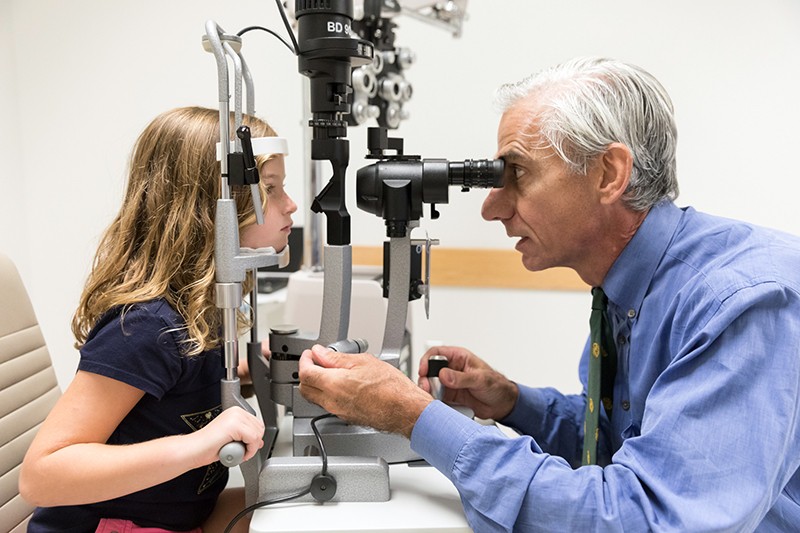
Albert Maguire szemészorvos egy Leber-kongenitális amaurozisban szenvedő lány szemét vizsgálja, akinek látását a voretigene neparvovec (Luxturna) génterápia állította helyre.Credit: Children’s Hospital of Philadelphia
A génterápia vakság elleni küzdelemben rejlő lehetőségeinek első demonstrációjaként három kutatócsoport alkalmazta a technikát a Leber-kongenitális amaurozisban (LCA) szenvedők sikeres kezelésére. Ez az örökletes betegség súlyos látáskárosodáshoz vezet, és az élet első néhány évében kezdődik, gyakran éjszakai vakságként jelentkezik, mielőtt a látótér perifériáján kezdődő széles körű látásvesztéshez vezetne. A betegség körülbelül minden 40 000 csecsemőből 1-et érint.
A kutatók az állapot egy speciális formáját, az LCA 2-t tűzték ki célul. Ezt az RPE65 gén mutációi okozzák, amelyet az RPE fejez ki. A mutálódott gén hátrányosan befolyásolja az RPE működését, ami viszont károsítja a fotoreceptor sejteket. 2008-ban a három kutatócsoport, köztük a Hauswirth által vezetett egyik, korai stádiumban lévő klinikai vizsgálatokban mindhárom kimutatta, hogy az RPE65 egészséges másolatának a retinába juttatása biztonságos, és korlátozott látásjavulást eredményezett4,5,6 . Egy Albert Maguire, a philadelphiai Pennsylvaniai Egyetem szemészorvosa által vezetett III. fázisú klinikai vizsgálat 2017 augusztusában kimutatta, hogy azok az LCA 2-ben szenvedő emberek, akik megkapták a kezelést, jobban tudtak navigálni az akadálypályákon különböző megvilágítási szinteken, mint azok, akik nem kaptak7. 2017 decemberében az FDA jóváhagyta a voretigene neparvovec (Luxturna) nevű kezelést, így ez az első génterápia bármilyen betegségre, amely zöld utat kapott a klinikai alkalmazásra.
Az LCA 2 ilyen módon történő kezelésére azért van lehetőség, mert az érintett génmutációk recesszív öröklődési mintát mutatnak. Ez azt jelenti, hogy egy személy mindkét RPE65-kópiájának hordoznia kell a megfelelő mutációkat ahhoz, hogy a rendellenességet okozza. Egyetlen, mutáció nélküli változat beadása tehát megoldja a problémát. A dominánsan öröklődő mutációk által okozott állapotok azonban csak a gén egy mutáns példányát igénylik a megnyilvánuláshoz. Ezek többségénél a gén egy normális példányának egyszerű hozzáadása nem segít; ehelyett a mutáns gént inaktiválni kell. Az egyik lehetőség a gén elhallgattatása olyan specifikus RNS-molekulák hozzáadásával, amelyek megszakítják a mutáns gén utasításait a hibás fehérje előállítására, majd a gén egy normál példányát biztosítják, hogy átvegye annak feladatait – ezt a megközelítést szuppressziónak és pótlásnak nevezik. Egy másik lehetőség a mutáció kijavítása a CRISPR-Cas9 génszerkesztési technika segítségével. Az olaszországi Modena és Reggio Emilia Egyetem kutatói 2016-ban mutatták be ezt a megközelítést a retinitis pigmentosa8 egérmodelljében. A következő évben egy egyesült államokbeli kutatócsoport egerekben és tenyésztett emberi sejtekben egyaránt a glaukóma egy típusát okozó mutáció korrigálására használta9.
A génterápia fejlődésének fontos motorja volt az adeno-asszociált vírus (AAV) alkalmazása a helyettesítő gének sejtekbe juttatására. Az AAV-ok biztonságosnak bizonyultak, részben azért, mert általában nem integrálódnak a gazdasejt genomjába, ami minimálisra csökkenti a sejtek rákossá válásának kockázatát. Kis méretük pedig lehetővé teszi, hogy széles körben elterjedjenek a szemen keresztül, és így nagyszámú sejtet fertőzzenek meg. Az AAV-ok génszállítási képességének azonban vannak korlátai: egyes gének egyszerűen túl nagyok ahhoz, hogy az AAV-ok hordozzák őket, például az ABCA4, amelynek mutációi a Stargardt-kórhoz, a makuladegeneráció egy örökletes formájához vezethetnek. Két megoldási módot keresnek. Az első egy nagyobb teherbírású vírust, például lentivírust használ a helyettesítő gének átadására. Ennek a megközelítésnek a biztonságossága és hatékonysága még nem ismert, de klinikai kísérletek már folyamatban vannak. A második stratégia az, hogy a helyettesítő gént kettétörik, és mindkét felét külön-külön szállítják a sejtbe, a rekombináció eszközével együtt. “Ez jelenleg legalább egy állatmodellben működik” – mondja Hauswirth.
A megközelítéstől függetlenül a génterápiának van egy jelentős korlátja. A vakságban több mint 250 gén játszik szerepet, és mivel mindegyikre számosféle mutáció hathat, a potenciális terápiás célpontok száma óriási. Például az RHO gén több mint 100 mutációja vezet a retinitis pigmentosához, a leggyakoribb dominánsan öröklődő retina rendellenességhez. Hauswirth szerint nem célszerű minden egyes mutációra génterápiát kifejleszteni.
A kutatók egy olyan lehetséges megoldáson dolgoznak, amely a szuppresszió és helyettesítés megközelítésének egy csavarját jelenti. Ahelyett, hogy az RHO egy adott mutációt tartalmazó példányait vennék célba, egy csendesítő RNS-t használnak a gén teljes expressziójának elnyomására, függetlenül attól, hogy az RHO mutálódott-e vagy sem, miközben egy olyan helyettesítő példányt juttatnak a szervezetbe, amely immunis a csendesítő RNS-re. A dublini Trinity College genetikusa, Jane Farrar által vezetett csoport 2011-ben a domináns retinitis pigmentosa egérmodelljében10 mutatta ki ennek a stratégiának az ígéretét. Hauswirth és munkatársai 2018-ban retinitis pigmentosában szenvedő kutyákon tesztelték a megközelítést11. Kimutatták, hogy a retina kezelt területein a fotoreceptorsejtek degenerációja megállítható volt – ez a javulás legalább nyolc hónapig fennállt. Ez a stratégia egyetlen kezeléssel kezeli az összes olyan mutációt, amely dominánsan öröklődő retinitis pigmentosát okozhat, és így a génterápiát “meglehetősen egyszerű módon” kiterjeszti a recesszíven öröklődő állapotokra is – mondja Hauswirth. Azt tervezi, hogy megvizsgálja, hogy a kezelést kapott kutyák mennyire jól tudnak tájékozódni egy labirintusban, és összegyűjti a klinikai vizsgálat megkezdéséhez szükséges biztonsági adatokat.
Optogenetika
A génterápia csak azoknál az embereknél működik, akiknek vakságát genetikai mutáció okozza. Nem alkalmas a végstádiumú retinabetegségek kezelésére sem, amelyekben nem marad elegendő számú sejt a javításra. Az optogenetika nevű technikán alapuló kapcsolódó megközelítés azonban nem függ a rendellenességektől, és a degeneráció különböző stádiumainak kezeléséhez vezethet. Az optogenetikában vírus segítségével olyan géneket juttatnak a sejtekbe, amelyek lehetővé teszik, hogy a sejtek fényérzékeny fehérjéket, úgynevezett opszinokat termeljenek. Az opsinok bevitele helyreállíthatja a károsodott fotoreceptorok fényérzékenységét, vagy akár a retina más sejtjeit, például a bipoláris sejteket vagy a retina ganglionsejtjeit is fényérzékennyé teheti.

Az optogenetikát a retinitis pigmentosa egérmodelljében a kúpsejtek (zöld) fényérzékenységének helyreállítására használták; a technika sikerét egy retinális ganglionsejt (magenta) aktivitásának mérésével értékelték, amelyet a kúpok fényre reagálva stimulálnak.Credit: IOB.ch
Problémás azonban, hogy míg a szem fotoreceptorsejtjei a fényintenzitások széles skálájával képesek megbirkózni – jól működnek világos napfényben és szürkületben egyaránt -, az opsineknek korlátozott a tartományuk, és gyakran jobban teljesítenek nagy fényintenzitásnál. A lehetséges megoldás a Pixium Vision Prima bionikus szemrendszeréhez hasonlóan működő rendszer alkalmazása, amelyben a viselők olyan szemüveget kapnak, amely egy videokamerát tartalmaz, amely rögzíti a felhasználó látását, és egy kivetítőt, amely a szemükbe irányul. Akárcsak a Prima esetében, az előnye az, hogy a szembe jutó fény jellegét a retina módosításához lehet igazítani; ebben az esetben azonban a beültetett fotodiódák helyett azokat az intenzitásokat és hullámhosszakat választják, amelyek a legjobban működtetik az újonnan bevezetett opsinokat.
AGenSight Biologics, egy párizsi biotechnológiai vállalat, amely Sahel és Roska alapítói között tartja számon, már tesztel egy ilyen rendszert. Célja, hogy egy opsint juttasson a retinális ganglionsejtekhez, de van egy lehetséges bökkenő: a retinális ganglionsejtek természetüknél fogva fényérzékenyek. Melanopszint fejeznek ki, egy olyan fehérjét, amely részt vesz a pupilláris fényreflexben, amelyben a szem pupillája összehúzódik erős fényre. Hogy ezt elkerüljék, a GenSight kutatói olyan opsint használnak, amely a vörös hullámhosszú fényre reagál, mivel a melanopszin a spektrum kék végén lévő fényre reagál. A vállalat 2018 októberében kezdett egy korai fázisú klinikai vizsgálatot előrehaladott retinitis pigmentosában szenvedő embereken, akiknek minimális látásuk maradt. A vizsgálatban az Egyesült Királyságból, Franciaországból és az Egyesült Államokból származó kohorszok vesznek részt, és a kezdeti eredmények 2020 végére várhatók.
“Ez egy egyszerű megközelítés, és meg kell néznünk, hogy mit nyerünk” – mondja Roska. “Aztán áttérhetünk az egyre kifinomultabb megközelítésekre”. Az egyik probléma továbbra is az, hogy számos olyan rendellenesség, amelyet optogenetikai technikákkal lehetne kezelni, a retina bizonyos részeinek degenerációjával jár, miközben a hasznos látás más területeken megmarad. Az opsinokat vezérlő fény látható, és zavarhatja a megmaradt természetes látást. A jövőben a közeli infravörös fényre reagáló opszinok lehetővé tehetik, hogy az optogenetikai kezelések a maradék természetes látással együtt működjenek.
Cellregeneráció
A törzsejtterápia potenciálisan a betegség késői stádiumában is gyógyíthatja a vakságot. Mivel az őssejtek bármilyen sejttípussá alakíthatók, felhasználhatók lennének arra, hogy friss retinasejteket növesszenek a szembe történő átültetéshez az elvesztett sejtek pótlására. Állatokon végzett vizsgálatok azonban azt mutatták, hogy az átültetett neuronoknak csak kis hányada képes megfelelően beilleszkedni a retina bonyolult idegi áramkörébe. Ez jelentős akadályt jelent a retina neuronjainak pótlását célzó őssejtes kezelések számára.

A retina összetett sejtes szerkezete a fotoreceptorok (zöld), valamint a vérerek és idegek (magenta) rétegeit tartalmazza.Credit: Louise Hughes/SPL
A retina pigmenthámját alkotó sejtek viszont a retina áramkörein kívül helyezkednek el. Az őssejt-alapú terápiák ezért az olyan állapotok, például az AMD és a retinitis pigmentosa esetében a legígéretesebbek, amelyek az RPE-sejtek degenerációját okozzák. “A fotoreceptoroknak kapcsolódniuk kell az áramkörhöz, de a retina pigmenthámjának nem” – mondja Roska. “Ez az a terület, ahol az emberek a legközelebb állnak az előrelépéshez.” Kezdetben a kutatók megpróbálták a retinába szuszpenzióban lévő, őssejtekből származó RPE-sejteket injektálni, de túl kevés maradt ott, ahol szükség lett volna rájuk. Több kutatócsoport most úgy gondolja, hogy jobb megközelítés az RPE-sejtek átültetése a szembe előre elkészített lemezként, amelyet aztán egy biokompatibilis állványzat tart a helyén. “Az állványzatos megközelítés hatalmas előrelépés a szuszpenzióhoz képest az RPE-sejtek esetében” – mondja Sahel.”
2018 márciusában a londoni University College London és a londoni Moorfields Szemkórház együttműködésével működő London Project to Cure Blindness bejelentette egy I. fázisú vizsgálat eredményeit, amelyben két nedves AMD-ben (az AMD ritka, súlyos formája, amely az erek rendellenes növekedésével és szivárgásával jár) szenvedő ember retinájába ültettek be egy RPE-sejtekből álló lapot. Mindkét recipiens jól tűrte az eljárást, és 21-29 betűvel több betűt tudtak elolvasni egy olvasótáblán, mint a kezelés előtt12. A következő hónapban a Humayun által vezetett csoport hasonló I. fázisú eredményekről számolt be öt száraz AMD-ben, a betegség gyakoribb formájában szenvedő személy esetében13. Ezek a kezdeti eredmények ígéretesek. “Ez nagy izgalomhoz vezetett” – mondja Humayun. Az eredményeket azonban még nagyobb számú résztvevőn végzett III. fázisú vizsgálatoknak kell megerősíteniük, és Humayun figyelmeztet, hogy a kezelés még sok évre lehet a klinikai alkalmazástól, mivel a retina rendellenességeire alkalmazott őssejtterápia még nem jutott át az engedélyezési eljáráson.
A kapcsolódó megközelítés, amely még az alapkutatás korai szakaszában van, beválthatja az elveszett neuronok pótlásának reményét, megnyitva az utat a szembetegségek széles körének kezelése előtt. Az emberben az érett neuronok nem osztódnak, ezért nem képesek regenerálódni, ami különösen megnehezíti a látás helyreállítását. De ugyanez nem igaz minden állatra. A hüllők és bizonyos halak képesek regenerálni a retina neuronjait, és a madarak is rendelkeznek bizonyos regenerációs képességgel. Thomas Reh, a seattle-i Washingtoni Egyetem idegkutatója ezt a képességet próbálja felszabadítani az emberben. De a laboratóriumban növesztett sejtek átültetése helyett Reh célja, hogy a retinában már meglévő sejteket rávegye arra, hogy új idegsejtekké differenciálódjanak.
2001-ben Reh felvetette, hogy a Müller-glia – a retina szerkezetét biztosító és annak működését támogató sejtek – a halakban és madarakban megfigyelt új idegsejtek forrása14. Ő és csapata ezután nekilátott annak kiderítéséhez, hogy a Müller-glia felhasználható-e friss neuronok létrehozására egerekben. 2015-ben úgy alakítottak ki egereket, hogy azok Ascl1-et termeljenek, egy olyan fehérjét, amely fontos a halakban az idegsejtek termelődéséhez, majd károsították az állatok retináját15. Azt remélték, hogy az Ascl1 arra készteti a Müller-gliákat, hogy neuronokká alakuljanak át.
A kísérlet nem hozott létre új neuronokat a felnőtt egerekben, de a fiatal egerekben sikerült. Nikolas Jorstad, a Rehs csoport biokémikusa és PhD-hallgatója azt javasolta, hogy a sejtmagban a fejlődés során a kromatinon (DNS, RNS és fehérjék komplexe) végzett kémiai módosítások megakadályozhatják az érett sejtekben az olyan génekhez való hozzáférést, amelyek lehetővé teszik a Müller-glia idegsejtekké való átalakulását. 2017 augusztusában Reh csoportja kimutatta, hogy egy olyan enzim bevezetésével, amely visszafordítja ezeket a módosításokat, rá tudják venni a Müller-gliákat a differenciálódásra16. “Először tudtunk neuronokat regenerálni felnőtt egérben” – mondja Reh. “Ennyi év után eléggé izgatott voltam.” Bár nem voltak valódi fotoreceptorsejtek, és inkább bipoláris sejtekre hasonlítottak, az idegsejtek csatlakoztak a meglévő áramkörökhöz, és fényérzékenyek voltak. “Meglepett, hogy ilyen jól kapcsolódnak” – mondja Reh.”
Noha a munka még messze van attól, hogy készen álljon az emberek retina rendellenességeinek kezelésére, hatalmas potenciál rejlik benne. A következő lépés az lesz, hogy megismételjék a vizsgálatokat olyan állatokon, amelyek szeme jobban hasonlít az emberekéhez. Reh csapata már dolgozik nem emberi főemlősökből származó retinasejt-kultúrákkal. A kutatóknak azt is ki kell találniuk, hogyan irányítsák a differenciálódási folyamatot, hogy specifikus sejttípusok, például pálcikák és kúpok jöjjenek létre. “Most, hogy már beleléptünk az idegsejtek előállításába, a kúpok is nagyszerűek lennének” – mondja Reh.
Siker esetén a megközelítés széles körben alkalmazható lenne. “Végső soron ez lesz az összes ilyen szembetegség kezelésének módja” – jósolja Reh. “Egyszerűen van értelme. Nem kell aggódni a megfelelő transzplantáció miatt. A sejtek ott vannak, ahol szükség van rájuk.”
Humayun is bátorítja a munka. “Mindenkinek szurkolok, akinek új, jó ötlete van” – mondja. “Ez még nagyon korai, nagy kockázatú, de soha ne mondd, hogy soha. Ezt tanultam meg.”