世界では、3600万人が完全な視覚障害を抱えています1。 彼らは、形や光源さえも見ることができません。 これらの人々のほとんどは、白内障のような改善可能な問題から失明しており、単に適切な医療を受けることができないだけなのです。
「失明は、人が経験し得る中で最も人生を左右する症状のひとつです」と、フロリダ大学ゲインズビル校の眼科医ウィリアム・ハウスワース(William Hauswirth)は述べています。 視覚障害は、移動や就職に困難をもたらすだけでなく、不眠症、不安やうつ病、さらには自殺のリスクなど、多くの健康問題と関連しているのです。 「
視覚障害の予防可能な原因に日常的に対処している高所得国では、失明の主な原因は網膜の変性です。 目の奥にあるこの組織には、光に反応し視覚信号を処理する特殊な細胞があり、そのため視覚にとって極めて重要です。 視細胞(一般に杆体や錐体と呼ばれる神経細胞)は、網膜に当たった光を電気化学的な信号に変換しています。 これらの信号は、双極細胞、アマクリン細胞、水平細胞など、他の神経細胞の複雑なネットワークを通過して、網膜神経節細胞と呼ばれる神経細胞に到達します。
網膜の障害では一般に、視細胞が失われ、光に対する目の感度が低下します。 加齢黄斑変性症 (AMD) などの一部の網膜疾患では、網膜色素上皮 (RPE) と呼ばれる網膜の奥の層を形成する上皮細胞の障害により、この損失が生じます。 RPEは、光との反応によって生じる有害な副産物を掃除したり、栄養分を供給したりして、視細胞を健康に保っています。
この記事のオーディオ版を聴く
あなたのブラウザはオーディオ要素に対応していません。
視覚障害の原因はさまざまであるため、解決策を見つけるのはより困難です。 しかし、いくつかの分野での進歩により、ほとんどすべての網膜障害が治療可能になる可能性があります。
1つのアプローチは、機能的な人工物で損傷した目を補強またはバイパスすることです。
1つの方法は、損傷した目を機能的な人工物で補強またはバイパスすることです。このようなバイオニックアイは、現時点では限られた視力しか回復できませんが、研究者はこの装置の能力を高め続けています。 もうひとつの選択肢は、遺伝子治療です。 すでに特定の遺伝子に変異がある人に適用されているが、研究者はこの方法をより多くの人や症状に適用しようと考えている。 また、一部の科学者は、オプトジェネティクスと呼ばれる関連技術に基づく治療法を追求しています。これは、遺伝子操作によって細胞を変化させ、網膜に光感受性を回復させるものです。 この研究はまだ初期段階にありますが、研究者たちは、この治療法が網膜変性の原因にとらわれないため、最終的にさまざまな人々を救うことができると期待しています。 また、網膜の失われた細胞や損傷した細胞をその場で、あるいは細胞移植によって置き換える取り組みは、末期の網膜障害さえも最終的には治療可能になることを示唆しています
この研究の多くはまだ初期段階にあります。
この研究の多くはまだ始まったばかりですが、Hauswirth氏はすでに達成された進歩に明るい表情を見せています。 10年前、彼はしばしば患者に「何もできない」と言わなければならなかったと言います。 「これらの疾患の多くについて、それは完全に変わりました」
約 30 年前、ロサンゼルスの南カリフォルニア大学の生物医学エンジニアである Mark Humayun は、失明者の網膜を電気的に刺激することを始めました。 カリフォルニア州シルマーにある医療技術会社 Second Sight Medical Products の同僚と協力し、彼の実験は、そのような刺激がフォスフェンと呼ばれる光のスポットの視覚認識を誘発することを示しました。 動物実験から10年を経て、眼球に安全に印加できる電流の量がわかり、さらに、変性した人間の網膜に残存する細胞の数や種類に関する知識が大幅に増えたことで、ヒューマユン氏のチームは人間に対する研究を始める準備が整ったのです。 2002年から2004年にかけて、研究チームは片方の目が完全に、あるいはほとんど見えなくなった6人の人々に、それぞれ義眼を移植した。この種の実験としては初めてのことである。 アーガスIと呼ばれるこの装置の装着者は、フォスフェーンや方向性のある動き、さらには形状を知覚することができたと報告している2。 この装置は、視細胞が変性するまれな遺伝子疾患である網膜色素変性症の患者さんへの使用が2011年にヨーロッパの規制当局から承認されています。

ArgusIIインプラントは網膜表面に取り付けられる電極配列で構成されています。Credit: Ringo Chiu/ZUMA /Alamy
Argus IIを装着するために、患者は電極配列を含むチップを網膜表面に装着する手術を受けます。 この装置で「見る」ために、メガネに取り付けられた小型ビデオカメラは、受信者が装着する処理ユニットに信号を中継します。 プロセッサーは信号を命令に変換し、ワイヤレスで埋め込みデバイスに送信する。 そして、電極が網膜の前面にある網膜神経節細胞を刺激します。 義眼の使用は、学習プロセスです。 受信者は、受信する新しいタイプの情報を解釈するために脳を訓練しなければなりません。 また、ビデオカメラは目の動きを追跡しないので、視線を向けるために頭を動かすことも学ばなければなりません。
この装置では、限られた視野しか得られません。
この装置は限られた視覚しか提供しません。ユーザーは光源やドアや窓のような高コントラストのエッジを持つ物体を検出でき、大きな文字を判読できる人もいます。 これらの制限は、この装置の 60 個の電極が、健康な目の数百万個の視細胞に比べると非常に低い解像度を提供するために、部分的に発生します。
Argus II が網膜上移植であるのに対し、開発中の他のデバイスは網膜の下に設置するように設計されています。 これらの網膜下インプラントは、通常網膜に信号を送る細胞 (視細胞) に近い細胞を刺激することができます。
ドイツのロイトリンゲンに拠点を置くバイオテクノロジー企業であるレティナ・インプラントは、目に入る光を直接感知するフォトダイオード (光を電流に変換する半導体デバイス) から成る網膜下インプラントを構築しました。 これにより、外付けのビデオカメラが不要になり、視線を自然に向けることができるようになりました。 電源は、耳の上の皮下に埋め込まれたコイルを通して、手持ちのユニットから供給されます。
パリのPixium Visionは、Primaと呼ばれる光起電力網膜下インプラントをテストしています。 このシステムは、メガネに取り付けられたビデオカメラからの信号を、近赤外線を使って目に投影するもので、その波長は、デバイス内のフォトダイオードを最適に駆動して網膜細胞を刺激します。 このように映像を投影することで、ユーザーは視線方向をある程度コントロールすることができ、目だけを動かして探索することができます。 また、電源は近赤外線から供給されるため、インプラントはワイヤレスで、装着のための手術もそれほど複雑ではありません。 「ペンシルバニア州ピッツバーグ大学の眼科医であるJosé-Alain Sahel氏は、10人のAMD患者を対象に安全性試験を実施しています。 「まだ初期段階ですが、これは非常に有望です」
これらの装置はすべて、機能している細胞が網膜に残っている場合にのみ機能します。 網膜色素変性症やAMDなど、主に視細胞に影響を与える一般的な目の疾患では、通常、刺激するための細胞がいくつか残っているのです。 しかし、進行した糖尿病性網膜症や緑内障のように、網膜神経節細胞があまりにも多く死んでしまうと、このようなインプラントは役に立ちません。
Humayunと彼の同僚は、信号を脳に直接送ることにより、眼球を迂回するシステムの開発に取り組んでいます。 1970年代、米国の生物医学エンジニアであるWilliam Dobelleは、視覚野を直接刺激することでフォスフェーンの知覚を誘発することを示しました3。 しかし、バイオニックアイの技術は、現在ようやく追いついてきたところである。 セカンドサイト社が開発した「オリオン」は、ヒューマユン氏によれば「基本的にはアーガスIIを改良したもの」である。 オリジナルと同様に、ビデオカメラと信号処理装置を使い、インプラントと無線通信を行うが、チップは網膜ではなく、視覚野の表面に配置されている。 この装置は、目の損傷や網膜、視神経の損傷により光を感じることができない、またはできない5人の人々でテストされています。 「今のところ、結果は良好です」と彼は言う。 「
この技術の一部はすでに人々によって試され、テストされていることから、Humayunは、このシステムが数年以内に規制当局の承認を受けることができると楽観的です。 「明らかに、脳手術には異なるレベルのリスクがありますが、手術は非常に簡単であり、Orionはより多くの患者を助けることができます」と彼は述べています。 しかし、脳を刺激して有用な視覚を提供することについては、あまり知られていない。 スイスのバーゼル分子臨床眼科研究所の神経生物学者であるボトンド・ロスカは、「網膜については多くのことが分かっているが、大脳皮質についてはほとんど分かっていない」という。 「しかし、やってみなければ十分なことはわからない」と彼は言います。
遺伝子治療
眼は遺伝子治療の理想的なターゲットです。 眼は比較的自己完結しているため、網膜の細胞に遺伝子を運ぶのに使われるウイルスは、体の他の部分に移動することはできないはずです。 また、眼球は免疫的に優位な部位であるため、免疫系がそのようなウイルスに対して防御を行う可能性は低い。
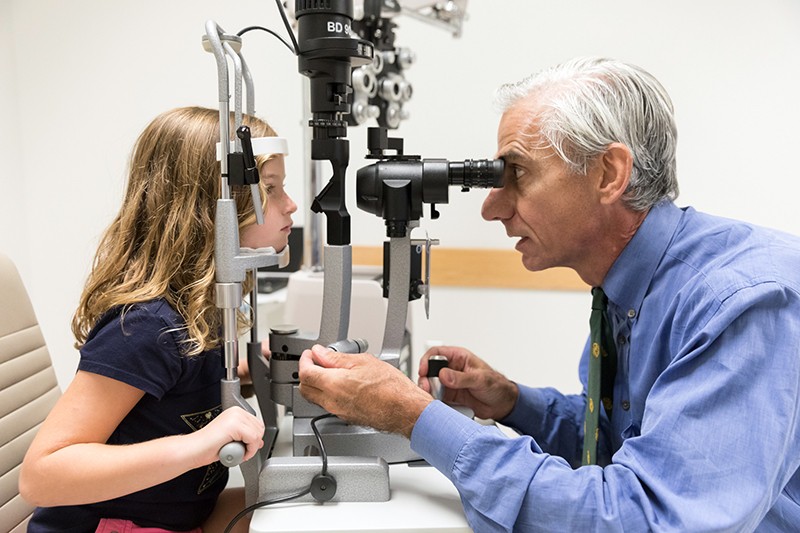
遺伝子治療ボレティジェン・ネパルボヴェック(ラクスターナ)で視力を回復したレーバー先天性黒色障害の少女の目を診察する眼科医のアルバート・マグワイア氏。Credit: Children’s Hospital of Philadelphia
失明に対する遺伝子治療の可能性を初めて示すものとして、研究者の3チームがこの技術を用いてレーバー先天性黒色症(LCA)の人々の治療に成功したことが挙げられます。 この遺伝性疾患は重度の視覚障害を引き起こし、生後数年から始まり、しばしば夜盲症として現れ、その後、視野の周辺から始まる広い視野の喪失へと進行します。
研究者たちは、LCA 2として知られるこの疾患の特定の形態に取り組むことにしました。 これは、RPEによって発現されるRPE65という遺伝子の変異によって引き起こされます。 この変異した遺伝子はRPEの機能に悪影響を及ぼし、その結果、視細胞にダメージを与えます。 2008年、Hauswirthが率いるチームを含む3つのチームはそれぞれ、初期段階の臨床試験において、RPE65の健康なコピーを網膜に送達することが安全であり、視力の限定的な改善につながることを示しました4,5,6。 フィラデルフィアのペンシルベニア大学の眼科医であるAlbert Maguireが率いる第III相臨床試験では、治療を受けたLCA 2の人々は、治療を受けなかった人々と比較して、さまざまな照度レベルの障害物コースを移動する能力が優れていることが2017年8月に明らかになりました7。 2017年12月、FDAは治療薬であるvoretigene neparvovec(Luxturna)を承認し、あらゆる疾患に対する遺伝子治療として初めて臨床使用の許可が下りました
LCA2をこのように治療できるのは、関与する遺伝子変異が劣性遺伝のパターンを示すからです。
この方法でLCA 2を治療することができるのは、関係する遺伝子変異が劣性遺伝を示すためです。つまり、障害を引き起こすには、人のRPE65の両方のコピーが関連する変異を持つ必要があるということです。 したがって、変異のない単一のバージョンを提供すれば、問題は解決する。 しかし、優性遺伝の突然変異で起こる疾患は、遺伝子の片方のコピーに変異があるだけで発症する。 このような場合、単に遺伝子の正常なコピーを追加するだけでは解決しないので、代わりに変異した遺伝子を不活性化する必要がある。 一つは、変異した遺伝子が異常なタンパク質を作る命令を妨害する特定のRNA分子を加え、正常な遺伝子のコピーにその命令を引き継がせることで遺伝子を不活性化する方法であり、抑制と置換と呼ばれるアプローチである。 もうひとつは、遺伝子編集技術であるCRISPR-Cas9を用いて変異を修正する方法である。 イタリアのモデナにあるモデナ・レッジョ・エミリア大学の研究者たちは、2016年に網膜色素変性症のモデルマウスでこの方法を実証しました8。 翌年には、米国のチームがこれを用いて、マウスと培養ヒト細胞の両方で緑内障の一種を引き起こす変異を修正しました9。
遺伝子治療の進歩の重要な推進力は、アデノ随伴ウイルス(AAV)を用いて置換遺伝子を細胞に送達することでした。 AAVは、宿主細胞のゲノムに組み込まれない傾向があり、細胞ががん化するリスクを最小限に抑えられるため、安全であることが示されています。 また、サイズが小さいため、眼球内を広く拡散し、多くの細胞に感染させることができます。 例えば、ABCA4は遺伝子の変異によってスターガート病(遺伝性黄斑変性症)を発症させる可能性があるため、AAVが運ぶには大きすぎるのだ。 そこで、2つの回避策が検討されている。 1つは、レンチウイルスのような運搬能力の高いウイルスを用いて、置換遺伝子を導入する方法である。 この方法の安全性と有効性は未知数ですが、臨床試験が進行中です。 もう一つの方法は、置換遺伝子を二つに分解し、それぞれの半分を別々に細胞内に運び、それらを再結合させる方法をとることである。 「
どのような方法であれ、遺伝子治療にはかなりの限界があります。 250以上の遺伝子が失明に関与しており、それぞれが多くの種類の変異によって影響を受ける可能性があるため、潜在的な治療標的の数は膨大である。 例えば、RHOという遺伝子には100以上の変異があり、これが網膜色素変性症という最も一般的な優性遺伝性網膜疾患の原因となっています。
研究者たちは、抑制と置換のアプローチに一工夫を加えた解決策に取り組んでいるところです。 特定の変異を持つRHOのコピーを標的とするのではなく、サイレンシングRNAを用いて、RHOが変異しているかどうかにかかわらず、その遺伝子の発現をすべて抑制し、同時にサイレンシングRNAに対する免疫力を持つ代替コピーを供給するのである。 ダブリンのトリニティ・カレッジの遺伝学者Jane Farrarが率いるチームは、2011年に、優性網膜色素変性症のマウスモデルで、この戦略の有望性を示した10。 2018年、Hauswirthたちは、網膜色素変性症の犬でこのアプローチを検証した11。 彼らは、網膜の治療領域の視細胞の変性を止めることができること、すなわち、少なくとも8カ月間持続する改善を示しました。 この治療法は、一度の治療で優性遺伝性網膜色素変性症の原因となるすべての変異を治療できるため、遺伝子治療を劣性遺伝性疾患から優性遺伝性疾患へと「極めて簡単な方法で」拡大できる、とHauswirth研究員は述べている。
光遺伝学
遺伝子治療は、遺伝子変異によって失明した人だけに有効です。 また、修復すべき細胞の数が十分に残っていない末期の網膜疾患への取り組みには適していません。 しかし、光遺伝学と呼ばれる技術に基づく関連アプローチは、障害に関係なく、変性の異なる段階に対する治療法につながる可能性がある。 オプトジェネティクスでは、オプシンとして知られる光に反応するタンパク質を細胞が作り出すための遺伝子をウイルスによって導入する。 オプシンを導入することで、損傷した視細胞に光感受性を回復させたり、双極細胞や網膜神経節細胞など、網膜の他の細胞に光感受性を持たせたりすることができる。

網膜色素変性のモデルマウスで、光遺伝学を使って円錐細胞(緑)に光感受性を取り戻しました。この技術の成功は、光に反応して錐体に刺激を与える網膜神経節細胞(赤)の活動を測ることで評価されています。Credit: IOB.ch
しかし問題は、目の中の視細胞は幅広い光量に対応でき、明るい日光でも薄明かりでもよく働くのに対し、オプシンには範囲が狭く、しばしば高い光量でよりよく働くことがあるのです。 ピクシオビジョン社のバイオニックアイシステム「プリマ」と同じような仕組みで、ビデオカメラとプロジェクターを内蔵したメガネを装着し、目の中に投影する。
サヘルとロスカを創業者に持つパリのバイオテクノロジー企業、GenSight Biologicsは、すでにこのようなシステムのテストを行っています。
サヘルとロスカを創業者に持つパリのバイオテクノロジー企業であるGenSight Biologicsは、すでにこのようなシステムをテストしています。 この細胞はメラノプシンを発現しており、明るい光に反応して瞳孔が収縮する瞳孔光反射に関与するタンパク質である。 メラノプシンはスペクトルの青い端の光に優先的に反応するため、これを誘発しないように、ジェンサイトの研究者は赤い波長の光に反応するオプシンを使用しています。 同社は2018年10月、視力がわずかに残っている進行した網膜色素変性症の人を対象に、初期段階の臨床試験を開始した。 この試験には、英国、フランス、米国のコホートが参加し、2020年末までに初期結果が得られる予定です
「これは単純なアプローチであり、何が得られるかを確認する必要があります」とRoska氏は述べています。 “その後、より洗練されたアプローチに移行することができます。”
「これは単純なアプローチであり、得られるものを見てみなければなりません」とロスカは言います。 オプシンを駆動する光は目に見えるため、残存する自然な視覚を妨害する可能性がある。
細胞再生
幹細胞療法は、病気の末期であっても失明を治せる可能性があります。 幹細胞はあらゆる種類の細胞になるように誘導することができるため、失われた細胞の代わりに眼球に移植するために、新しい網膜細胞を増殖させるのに使用することができるのです。 しかし、動物実験では、移植された神経細胞のうち、網膜の複雑な神経回路に正しく統合されるのはごく一部に過ぎないことが分かっている。

網膜の複合細胞構造は、光受容体の層(緑)と血管および神経(マゼンタ)を含んでいます。Credit: Louise Hughes/SPL
一方、網膜色素上皮を構成する細胞は、網膜回路の外に位置しています。 そのため、幹細胞を用いた治療法は、AMDや網膜色素変性症など、RPE細胞の変性を引き起こす疾患に対して最も有望視されています。 「視細胞は回路に接続しなければなりませんが、網膜色素上皮はそうではありません」とロスカは言う。 “そこが、人々が最も進歩に近いところなのです。” 当初、研究者たちは、網膜に幹細胞由来のRPE細胞を浮遊状態で注入してみたが、必要な場所にとどまる数が少なすぎた。 現在では、RPE細胞をあらかじめシート状にして眼球に移植し、それを生体適合性のある足場材で固定するのがよりよい方法だと考えているチームもある。 足場のアプローチは、RPE細胞の懸濁液と比較して、大きな改善です」とサヘル氏は言います。
2018年3月、ロンドン大学ロンドンとロンドンのムーアフィールズ眼科病院のコラボレーションである「失明の治療プロジェクト」は、RPE細胞のシートをウェットAMD(血管の異常増殖と漏れを伴うまれで深刻な形態のAMD)の患者2人の網膜に移植した第1相試験の結果を発表しました。 両者とも処置によく耐え、治療前に比べて読書表で21〜29文字多く読むことができた12。 翌月には、Humayunが率いるチームが、より一般的なタイプのドライ型AMDの患者5名に対して同様の第I相試験結果を報告した13。 これらの初期結果は、期待に満ちたものである。 「とHumayun氏は言う。「この結果は、大きな興奮を呼び起こしました。
関連するアプローチとして、まだ基礎研究の初期段階であるが、失われた神経細胞を補充することで、さまざまな眼疾患に対する治療法の扉を開くことが期待されている。 ヒトでは、成熟したニューロンは分裂しないため再生できず、視力の回復が特に困難です。 しかし、すべての動物に同じことが当てはまるわけではありません。 爬虫類や特定の魚類は網膜ニューロンを再生することができ、鳥類もある程度の再生能力を有している。 シアトルにあるワシントン大学の神経科学者、トーマス・レーは、この能力を人間で解き放とうとしている。
2001年、Rehはミュラー・グリア (網膜に構造を与え、その機能をサポートする細胞) が、魚や鳥で観察された新しいニューロンの源であることを示唆しました14。 そして、彼と彼のチームは、ミュラー・グリアを利用して、マウスで新鮮なニューロンを生成できるかどうかを調べることに着手した。 2015年、彼らは、魚類の神経細胞生成に重要なタンパク質であるAscl1を作るようにマウスを操作し、その動物の網膜に損傷を与えた15。 彼らの望みは、Ascl1がミュラーグリアを刺激してニューロンに変化させることでした。
この実験は、成体マウスでは新しいニューロンの生成に失敗しましたが、若いマウスでは成功したのです。 Rehs氏のチームの生化学者であり博士課程の学生であるNikolas Jorstad氏は、発生過程で細胞核内のクロマチン(DNA、RNA、タンパク質の複合体)に加えられた化学修飾が、成熟細胞において、ミュラーグリアがニューロンに変化するための遺伝子へのアクセスを遮断するのではないかと提唱したのです。 2017年8月、レーのチームは、そうした修飾を逆転させる酵素を導入することで、ミュラーグリアを分化するように誘導できることを示した16。 “初めて、成体マウスで神経細胞を再生することができました “と、Rehは言う。 「何年か経ってから、私はとても感激しました」。 それらは真の視細胞ではなく、むしろ双極細胞のように見えましたが、ニューロンは既存の回路に接続され、光に感度を持ちました。 「
人の網膜障害を治療できるようになるには程遠いものの、この研究には大きな可能性があります。 次のステップは、人間に近い目を持つ動物で研究を繰り返すことである。 Reh教授のチームは、すでに霊長類の網膜細胞培養液を使って研究を行っている。 また、杆体や錐体など特定の種類の細胞を作り出すために、分化のプロセスをどのように指示するかについても検討する必要がある。 「
成功すれば、この方法は広く応用できるかもしれません。
この方法が成功すれば、広く応用することができます。「最終的には、この方法がすべての眼病に対する治療法になるでしょう」とレーは予測しています。 「これは理にかなっています。 移植がうまくいくかどうか心配する必要はないのです。
フマユンもこの研究に勇気づけられています。 「新しい良いアイデアを持つ人は誰でも応援します」と彼は言います。 「非常に初期で、リスクも高いですが、絶対とは言いません。 それが私の学んだことです」
フマユンもこの仕事に勇気づけられている。