Identify the building blocks of matter
At its most fundamental level, life is made up of matter. Materie is elke stof die ruimte inneemt en massa heeft. Elementen zijn unieke vormen van materie met specifieke chemische en fysische eigenschappen die niet door gewone chemische reacties kunnen worden afgebroken tot kleinere stoffen. Er zijn 118 elementen, maar slechts 92 komen in de natuur voor. De overige elementen worden in laboratoria gesynthetiseerd en zijn onstabiel.
De vier elementen die alle levende organismen gemeen hebben zijn zuurstof (O), koolstof (C), waterstof (H), en stikstof (N). In de niet-levende wereld worden elementen in verschillende verhoudingen gevonden, en sommige elementen die veel voorkomen in levende organismen zijn relatief zeldzaam op de aarde als geheel, zoals te zien is in tabel 1. De atmosfeer is bijvoorbeeld rijk aan stikstof en zuurstof, maar bevat weinig koolstof en waterstof, terwijl de aardkorst weliswaar zuurstof en een kleine hoeveelheid waterstof bevat, maar weinig stikstof en koolstof. Ondanks hun verschillen in abundantie, gehoorzamen alle elementen en de chemische reacties tussen hen aan dezelfde chemische en fysische wetten, ongeacht of ze deel uitmaken van de levende of niet-levende wereld.
| Tabel 1. Approximate Percentage of Elements in Living Organisms (Humans) Compared to the Non-living World | |||
|---|---|---|---|
| Element | Life (Humans) | Atmosphere | Earth’s Crust |
| Oxygen (O) | 65% | 21% | 46% |
| Carbon (C) | 18% | trace | trace |
| Hydrogen (H) | 10% | trace | 0.1% |
| Nitrogen (N) | 3% | 78% | trace |
Learning Objectives
- Draw a diagram of an atom, according to current scientific understanding
- Understand the periodic table of elements and how to use it to understand elements
- Describe the behavior and location of electrons, en hoe deze factoren de vorming van bindingen tussen atomen beïnvloeden
Atomen
De structuur van het atoom
Om te begrijpen hoe elementen samenkomen, moeten we eerst het kleinste onderdeel of de bouwsteen van een element bespreken, het atoom. Een atoom is de kleinste eenheid van materie die alle chemische eigenschappen van een element behoudt. Bijvoorbeeld, één goudatoom heeft alle eigenschappen van goud in die zin dat het een vast metaal is bij kamertemperatuur. Een gouden munt is gewoon een zeer groot aantal goudatomen die in de vorm van een munt zijn gegoten en die kleine hoeveelheden andere elementen bevatten die onzuiverheden worden genoemd. Een atoom bestaat uit twee gebieden: de kern, die zich in het centrum van het atoom bevindt en protonen en neutronen bevat, en het buitenste gebied van het atoom, dat de elektronen in een baan rond de kern houdt, zoals in figuur 1 is afgebeeld. Atomen bevatten protonen, elektronen en neutronen, naast andere subatomaire deeltjes. De enige uitzondering is waterstof (H), dat bestaat uit één proton en één elektron zonder neutronen.

Figuur 1. Elementen, zoals het hier afgebeelde helium, zijn opgebouwd uit atomen. Atomen bestaan uit protonen en neutronen die zich in de kern bevinden, met elektronen in banen die de kern omringen.
Protonen en neutronen hebben ongeveer dezelfde massa, ongeveer 1,67 × 10-24 gram. Wetenschappers definiëren deze hoeveelheid massa arbitrair als één atomaire massaeenheid (amu) of één Dalton, zoals weergegeven in tabel 1. Hoewel gelijk in massa, verschillen protonen en neutronen in hun elektrische lading. Een proton is positief geladen, terwijl een neutron ongeladen is. Daarom draagt het aantal neutronen in een atoom in belangrijke mate bij tot zijn massa, maar niet tot zijn lading. Elektronen zijn veel kleiner in massa dan protonen, met een gewicht van slechts 9,11 × 10-28 gram, of ongeveer 1/1800 van een atomaire massaeenheid. Daarom dragen ze niet veel bij aan de totale atoommassa van een element. Daarom is het gebruikelijk om bij het bepalen van de atoommassa de massa van elektronen te negeren en de massa van het atoom te berekenen op basis van het aantal protonen en neutronen alleen. Hoewel ze geen significante bijdrage leveren aan de massa, dragen elektronen wel in belangrijke mate bij aan de lading van het atoom, aangezien elk elektron een negatieve lading heeft die gelijk is aan de positieve lading van een proton. In ongeladen, neutrale atomen is het aantal elektronen dat om de kern draait gelijk aan het aantal protonen in de kern. In these atoms, the positive and negative charges cancel each other out, leading to an atom with no net charge.
Accounting for the sizes of protons, neutrons, and electrons, most of the volume of an atom—greater than 99 percent—is, in fact, empty space. With all this empty space, one might ask why so-called solid objects do not just pass through one another. The reason they do not is that the electrons that surround all atoms are negatively charged and negative charges repel each other.
| Table 1. Protons, Neutrons, and Electrons | |||
|---|---|---|---|
| Charge | Mass (amu) | Location | |
| Proton | +1 | 1 | nucleus |
| Neutron | 0 | 1 | nucleus |
| Elektron | -1 | 0 | orbitalen |
Atoomnummer en massa
Atomen van elk element bevatten een karakteristiek aantal protonen en elektronen. Het aantal protonen bepaalt het atoomnummer van een element en wordt gebruikt om het ene element van het andere te onderscheiden. Het aantal neutronen is variabel, wat leidt tot isotopen, dat zijn verschillende vormen van hetzelfde atoom die alleen verschillen in het aantal neutronen dat ze bezitten. Het aantal protonen en het aantal neutronen samen bepalen het massagetal van een element, zoals geïllustreerd in figuur 2. Merk op dat bij de berekening van het massagetal geen rekening wordt gehouden met de kleine bijdrage van elektronen aan de massa. Deze benadering van de massa kan worden gebruikt om gemakkelijk te berekenen hoeveel neutronen een element heeft door eenvoudig het aantal protonen af te trekken van het massagetal. Aangezien de isotopen van een element lichtjes verschillende massagetallen zullen hebben, bepalen wetenschappers ook de atoommassa, die het berekende gemiddelde is van het massagetal voor zijn natuurlijk voorkomende isotopen. Vaak bevat het resulterende getal een breuk. De atoommassa van chloor (Cl) is bijvoorbeeld 35,45 omdat chloor uit verschillende isotopen bestaat, sommige (de meerderheid) met atoommassa 35 (17 protonen en 18 neutronen) en sommige met atoommassa 37 (17 protonen en 20 neutronen).
Praktijkvraag
Koolstof heeft een atoomnummer van zes, en twee stabiele isotopen met massagetallen van respectievelijk twaalf en dertien. Zijn atoommassa is 12,11.

Figuur 2. Koolstof-12 en koolstof-13
Hoeveel neutronen hebben koolstof-12 en koolstof-13 respectievelijk?
Het Periodiek Systeem der Elementen
De verschillende elementen zijn geordend en weergegeven in het periodiek systeem. Het werd in 1869 ontworpen door de Russische chemicus Dmitri Mendelejev (1834-1907) en groepeert elementen die, hoewel uniek, bepaalde chemische eigenschappen delen met andere elementen. De eigenschappen van elementen zijn verantwoordelijk voor hun fysische toestand bij kamertemperatuur: zij kunnen gassen, vaste stoffen of vloeistoffen zijn. Elementen hebben ook een specifieke chemische reactiviteit, het vermogen om te combineren en zich chemisch met elkaar te verbinden.
In het periodiek systeem, weergegeven in figuur 3, zijn de elementen georganiseerd en weergegeven op basis van hun atoomnummer en zijn ze gerangschikt in een reeks rijen en kolommen op basis van gedeelde chemische en fysische eigenschappen. Naast het atoomnummer van elk element geeft het periodiek systeem ook de atoommassa van het element weer. Als we bijvoorbeeld naar koolstof kijken, zien we het symbool (C) en de naam, evenals het atoomnummer van zes (linksboven) en de atoommassa van 12,11.

Figuur 3. Het periodiek systeem toont de atoommassa en het atoomnummer van elk element. Het atoomnummer staat boven het symbool van het element en de geschatte atoommassa staat eronder.
Het periodiek systeem groepeert de elementen volgens hun chemische eigenschappen. De verschillen in chemische reactiviteit tussen de elementen zijn gebaseerd op het aantal en de ruimtelijke verdeling van de elektronen van een atoom. Atomen die chemisch reageren en zich aan elkaar binden, vormen moleculen. Moleculen zijn eenvoudigweg twee of meer atomen die chemisch met elkaar verbonden zijn. Het is logisch dat wanneer twee atomen een chemische verbinding aangaan om een molecuul te vormen, hun elektronen, die het buitenste gebied van elk atoom vormen, het eerst samenkomen wanneer de atomen een chemische verbinding aangaan.
Bekijk deze video voor een meer diepgaande inleiding tot het periodiek systeem:
Elektronen
Elektronschillen en het Bohr-model

Figuur 4. Het Bohr-model.
Er moet worden benadrukt dat er een verband bestaat tussen het aantal protonen in een element, het atoomnummer dat het ene element van het andere onderscheidt, en het aantal elektronen dat het heeft. In alle elektrisch neutrale atomen is het aantal elektronen gelijk aan het aantal protonen. Elk element, althans wanneer het elektrisch neutraal is, heeft dus een karakteristiek aantal elektronen dat gelijk is aan zijn atoomnummer.
Een vroeg model van het atoom werd in 1913 ontwikkeld door de Deense wetenschapper Niels Bohr (1885-1962). In dit model bestaan de elektronen in hoofdschillen. Een elektron bevindt zich normaal gesproken in de laagst beschikbare energieschil, die zich het dichtst bij de kern bevindt. Energie van een lichtfoton kan het elektron naar een hogere energieschil brengen, maar deze situatie is onstabiel en het elektron valt snel terug naar de grondtoestand. Daarbij komt een lichtfoton vrij.
Het Bohr-model toont het atoom als een centrale kern met protonen en neutronen, met de elektronen in cirkelvormige banen op specifieke afstanden van de kern, zoals geïllustreerd in figuur 4. Deze banen vormen elektronenschillen of energieniveaus, die een manier zijn om het aantal elektronen in de buitenste schillen weer te geven. Deze energieniveaus worden aangeduid met een getal en het symbool “n”. Zo staat 1n voor het eerste energieniveau dat zich het dichtst bij de kern bevindt.
Elektronen vullen de banen in een consistente volgorde: eerst vullen zij de banen die zich het dichtst bij de kern bevinden, daarna gaan zij verder met het vullen van banen met toenemende energie die zich verder van de kern bevinden. Als er meerdere banen van gelijke energie zijn, zullen deze in elk energieniveau met één elektron worden gevuld voordat er een tweede elektron wordt toegevoegd. De elektronen van het buitenste energieniveau bepalen de energetische stabiliteit van het atoom en zijn neiging om chemische bindingen te vormen met andere atomen om moleculen te vormen.
Onder standaardomstandigheden vullen atomen eerst de binnenste schillen, wat vaak resulteert in een variabel aantal elektronen in de buitenste schil. De binnenste schil heeft maximaal twee elektronen, maar de volgende twee elektronenschillen kunnen elk maximaal acht elektronen hebben. Dit staat bekend als de octet-regel, die stelt dat, met uitzondering van de binnenste schil, atomen energetisch stabieler zijn wanneer zij acht elektronen in hun valentieschil, de buitenste elektronenschil, hebben. Voorbeelden van enkele neutrale atomen en hun elektronenconfiguraties zijn te zien in figuur 5. Merk op dat helium in deze figuur een volledige buitenste elektronenschil heeft, met twee elektronen die de eerste en enige schil vullen. Evenzo heeft neon een volledige buitenste 2n schil met acht elektronen. Chloor en natrium daarentegen hebben respectievelijk zeven en één in hun buitenste schil, maar theoretisch zouden zij energetisch stabieler zijn als zij de octetregel volgden en er acht hadden.
Praktijkvraag
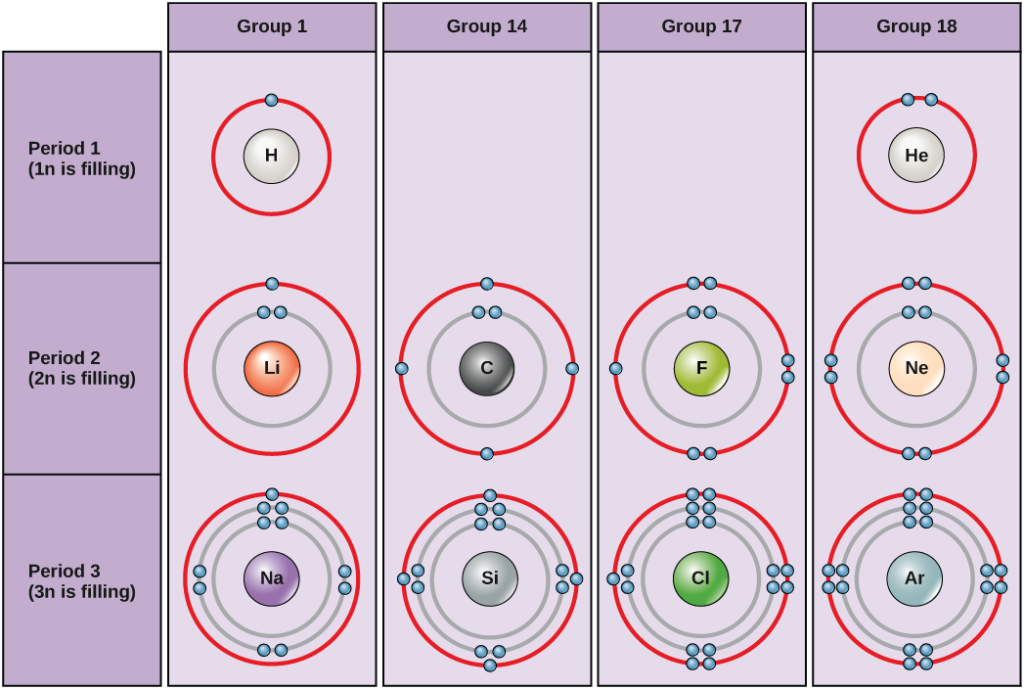
Figuur 5. Bohr-diagrammen voor waterstof, helium, lithium, koolstof, fluor, neon, natrium, silicium, chloor en argon.
Bohr-diagrammen geven aan met hoeveel elektronen elke hoofdschil is gevuld. De elementen van groep 18 (helium, neon en argon zijn afgebeeld in figuur 5) hebben een volle buitenste schil, de valentieschil. Een volle valentieschil is de meest stabiele elektronenconfiguratie. Elementen in andere groepen hebben gedeeltelijk gevulde valentieschillen en winnen of verliezen elektronen om een stabiele elektronenconfiguratie te bereiken.
Een atoom kan elektronen geven, nemen of delen met een ander atoom om een volle valentieschil te bereiken, de meest stabiele elektronenconfiguratie. Als je naar deze figuur kijkt, hoeveel elektronen moeten elementen uit groep 1 dan verliezen om een stabiele elektronenconfiguratie te krijgen? Hoeveel elektronen moeten elementen uit groep 14 en 17 winnen om een stabiele configuratie te bereiken?
Weten dat de organisatie van het periodiek systeem gebaseerd is op het totale aantal protonen (en elektronen) helpt ons te weten hoe de elektronen over de buitenste schil zijn verdeeld. Het periodiek systeem is gerangschikt in kolommen en rijen op basis van het aantal elektronen en waar deze elektronen zich bevinden. Bekijk enkele elementen in de meest rechtse kolom van het periodiek systeem eens van dichtbij in figuur 3.
De atomen uit groep 18, helium (He), neon (Ne) en argon (Ar), hebben allemaal gevulde buitenste elektronenschillen, waardoor ze geen elektronen hoeven te delen met andere atomen om stabiliteit te bereiken; ze zijn zeer stabiel als afzonderlijke atomen. Omdat ze niet reactief zijn, worden ze de inerte gassen (of edelgassen) genoemd. Vergelijk dit met de elementen van groep 1 in de linkerkolom. Deze elementen, waaronder waterstof (H), lithium (Li), en natrium (Na), hebben allemaal één elektron in hun buitenste schil. Dat betekent dat zij een stabiele configuratie en een gevulde buitenste schil kunnen krijgen door een elektron af te staan of te delen met een ander atoom of een molecuul, zoals water. Waterstof zal zijn elektron afstaan of delen om deze configuratie te bereiken, terwijl lithium en natrium hun elektron zullen afstaan om stabiel te worden. Als gevolg van het verlies van een negatief geladen elektron, worden zij positief geladen ionen. Elementen van groep 17, waaronder fluor en chloor, hebben zeven elektronen in hun buitenste schil, zodat ze de neiging hebben deze schil te vullen met een elektron van andere atomen of moleculen, waardoor ze negatief geladen ionen worden. De elementen van groep 14, waarvan koolstof het belangrijkste is voor levende systemen, hebben vier elektronen in hun buitenste schil, waardoor ze verschillende covalente bindingen (die hieronder worden besproken) kunnen aangaan met andere atomen. De kolommen van het periodiek systeem geven dus de potentiële gemeenschappelijke toestand van de buitenste elektronenschillen van deze elementen weer, die verantwoordelijk is voor hun vergelijkbare chemische eigenschappen.
Elektronenbanen
Hoewel het nuttig is om de reactiviteit en chemische binding van bepaalde elementen te verklaren, geeft het Bohr-model van het atoom niet nauwkeurig weer hoe de elektronen ruimtelijk verdeeld zijn rond de kern. Zij draaien niet rond de kern zoals de aarde rond de zon, maar bevinden zich in elektronenbanen. Deze relatief complexe vormen zijn het gevolg van het feit dat elektronen zich niet alleen als deeltjes gedragen, maar ook als golven. Wiskundige vergelijkingen uit de kwantummechanica, bekend als golffuncties, kunnen met een bepaalde mate van waarschijnlijkheid voorspellen waar een elektron zich op een bepaald moment kan bevinden. Het gebied waar een elektron zich het meest waarschijnlijk bevindt, wordt zijn orbitaal genoemd.

Figuur 6. Klik voor een grotere afbeelding. De s-deelschalen hebben de vorm van bollen. Zowel de 1n- als de 2n-hoofdschil hebben een s-baan, maar de grootte van de bol is groter bij de 2n-baan. Elke bol is een enkele orbitaal. p deelschelpen bestaan uit drie haltervormige orbitalen. Hoofdschil 2n heeft een p-subschil, maar schil 1 niet.
Herinner u eraan dat het Bohr-model de elektronenschilconfiguratie van een atoom weergeeft. Binnen elke elektronenschil zijn subschillen, en elke subschil heeft een bepaald aantal banen die elektronen bevatten. Hoewel het onmogelijk is precies te berekenen waar een elektron zich bevindt, weten wetenschappers dat het zich hoogstwaarschijnlijk binnen zijn baan bevindt. Subschillen worden aangeduid met de letters s, p, d en f. De s-subschil is bolvormig en heeft één orbitaal. Hoofdschil 1n heeft slechts één s-schil, die twee elektronen kan bevatten. Hoofdschil 2n heeft één s- en één p-subschil, en kan in totaal acht elektronen bevatten. De p-subschil heeft drie haltervormige orbitalen, zoals geïllustreerd in figuur 6. De d- en f-subschalen hebben een complexere vorm en bevatten respectievelijk vijf en zeven orbitalen. Deze zijn niet afgebeeld in de illustratie. De hoofdschil 3n heeft s-, p- en d-subschillen en kan 18 elektronen bevatten. De hoofdschil 4n heeft s-, p-, d- en f-banen en kan 32 elektronen bevatten. Als men zich van de atoomkern verwijdert, neemt het aantal elektronen en banen in de energieniveaus toe. Van het ene atoom naar het volgende in het periodiek systeem kan de elektronenstructuur worden uitgewerkt door een extra elektron in te passen in de eerstvolgende beschikbare baan.
De baan die het dichtst bij de kern ligt, de 1s-baan genoemd, kan maximaal twee elektronen bevatten. Deze orbitaal komt overeen met de binnenste elektronenschil van het Bohr-model van het atoom. Hij wordt de 1s-baan genoemd omdat hij bolvormig is rond de atoomkern. De 1s-baan is de baan die het dichtst bij de atoomkern ligt, en wordt altijd als eerste gevuld, voordat een andere baan kan worden gevuld. Waterstof heeft één elektron; daarom is er maar één plek in de 1s-baan bezet. Dit wordt aangeduid als 1s1, waarbij de superscripted 1 verwijst naar het ene elektron in de 1s-baan. Helium heeft twee elektronen; daarom kan het de 1s-baan volledig vullen met zijn twee elektronen. Dit wordt aangeduid als 1s2, verwijzend naar de twee elektronen van helium in de 1s orbitaal. In het periodiek systeem Figuur 6 zijn waterstof en helium de enige twee elementen in de eerste rij (periode); dit komt omdat zij alleen elektronen hebben in hun eerste schil, de 1s-baan. Waterstof en helium zijn de enige twee elementen die de 1s en geen andere elektronenbanen hebben in de elektrisch neutrale toestand.
De tweede elektronenschil kan acht elektronen bevatten. Deze schil bevat nog een bolvormige s-baan en drie “halter”-vormige p-banen, die elk twee elektronen kunnen bevatten, zoals te zien is in figuur 6. Nadat de 1s-baan is gevuld, wordt de tweede elektronenschil gevuld, waarbij eerst de 2s-baan en daarna de drie p-banen worden opgevuld. Bij het vullen van de p-banen neemt elke p-baan een enkel elektron op; zodra elke p-baan een elektron heeft, kan een tweede worden toegevoegd. Lithium (Li) bevat drie elektronen die de eerste en tweede schil bezetten. Twee elektronen vullen de 1s orbitaal, en het derde elektron vult dan de 2s orbitaal. De elektronenconfiguratie is 1s22s1. Neon (Ne) daarentegen heeft in totaal tien elektronen: twee in de binnenste 1s-baan en acht in de tweede schil (telkens twee in de 2s-baan en drie p-banen); het is dus een inert gas en energetisch stabiel als een enkel atoom dat zelden een chemische verbinding met andere atomen zal vormen. Grotere elementen hebben extra banen, die samen de derde elektronenschil vormen. Hoewel de concepten van elektronenschillen en orbitalen nauw verwant zijn, geven orbitalen een nauwkeuriger beeld van de elektronenconfiguratie van een atoom, omdat het orbitaalmodel de verschillende vormen en speciale oriëntaties specificeert van alle plaatsen die elektronen kunnen innemen.
Bekijk deze visuele animatie om de ruimtelijke rangschikking van de p- en s-banen te zien. Note that this video has no audio.
Video Review
This video gives another overview of the electron:
Check Your Understanding
Answer the question(s) below to see how well you understand the topics covered in the previous section. This short quiz does not count toward your grade in the class, and you can retake it an unlimited number of times.
Use this quiz to check your understanding and decide whether to (1) study the previous section further or (2) move on to the next section.