Een elektrolyt is een chemische verbinding die in ionen uiteenvalt en daardoor elektrische lading kan transporteren – een elektrolyt is dus een elektrische geleider; in tegenstelling tot metalen is de stroom van lading geen stroom van elektronen, maar een beweging van ionen.
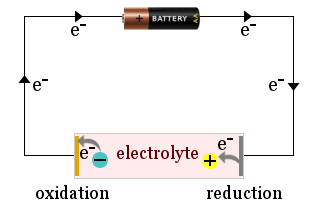
Het schema laat bijvoorbeeld zien hoe een huishoudbatterij wordt gebruikt om elektrolytionen naar de elektroden van een elektrochemische cel te trekken, waar de ionen elektronen winnen (worden gereduceerd) of elektronen verliezen (worden geoxideerd).
Soms reageren de elektroden zelf, bijvoorbeeld een metalen elektrode kan worden geoxideerd en ionen afgeven aan de elektrolyt.
Elektrolyten kunnen vast, vloeibaar of een oplossing zijn.
Voorbeelden van elektrolyten
1. Gesmolten natriumchloride fungeert als elektrolyt bij de productie van natriummetaal. Er ontstaat ook chloorgas.
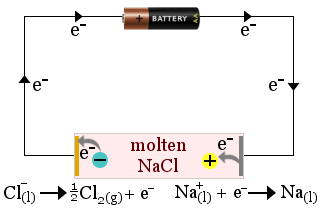 In dit geval wordt de elektrolyt verbruikt door de redoxreacties van de cel.
In dit geval wordt de elektrolyt verbruikt door de redoxreacties van de cel.
2. Kaliumhydroxide opgelost in water levert een sterk geleidende elektrolyt op in de Edisoncel, een vroege oplaadbare cel.
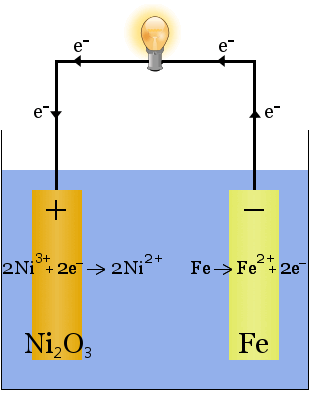
In tegenstelling tot de natriumproductie hierboven wordt bij deze reactie geen elektrolyt verbruikt.De rol van het kaliumhydroxide in dit geval is de beschikbaarheid van ionen te vergroten om het geleidingsvermogen van de elektrolyt te vergroten en het elektrische circuit te voltooien.
De chemische vergelijkingen voor de reacties aan de elektroden zijn:
Voor ontlading worden de vergelijkingen van links naar rechts afgelezen; voor oplading van rechts naar links.
3. Traditioneel waren elektrolyten vloeistoffen om de beweging van ionen mogelijk te maken.Er zijn nu echter vaste materialen beschikbaar die ionen gemakkelijk door hun structuren laten bewegen.Vaste elektrolyten zijn wenselijk in veel consumentenproducten, omdat ze niet lekken.
Lithiumtinsulfidesulfide, Li10SnP2S12, is een vast elektrolyt voor gebruik in lithiumionbatterijen.De kristalstructuur van het vaste elektrolyt in combinatie met de zwakke interactie met lithiumionen zorgt voor een omgeving waar lithiumionen gemakkelijk doorheen kunnen springen.
4. Elektrolyten zijn enorm belangrijk voor de elektrochemische processen in levende organismen.De belangrijkste ionen in deze elektrolyten zijn calcium (Ca2+), magnesium (Mg2+), natrium (Na+), kalium (K+), chloride (Cl-), waterstofcarbonaat (HCO3-), en waterstoffosfaat (HPO42-).
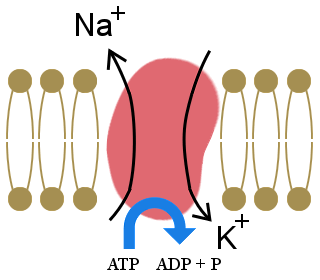
The importance of the sodium-potassium pump, shown in the diagram, to our lives is illustrated by the fact that it uses one-third of our resting energy.The pump maintains our cells’ electrolyte balance, with excess potassium ions inside cells and excess sodium ions outside cells.
This concentration gradient creates a voltage across the cell wall, which allows electrical signals to be transmitted in neurons and in muscles.It also provides the energy for processes in cell-membranes.
