Pseudofakisch cystoïd maculair oedeem (CME), ook bekend als het Irvine-Gass-syndroom, leidt tot een pijnloos verlies van het gezichtsvermogen en treedt meestal 4 tot 6 weken na een cataractoperatie op, hoewel risicofactoren voor deze complicatie vaak al veel eerder kunnen worden geïdentificeerd. Patiënten met een verhoogd risico op CME zijn onder meer patiënten met diabetes mellitus zonder retinopathie, patiënten met diabetes met retinopathie (relatief risico respectievelijk 1,80 en 6,23), patiënten met een voorgeschiedenis van epiretinaal membraan (RR 5.60) of uveïtis (RR 2,88), en patiënten met netvliesaderocclusie (RR 4,47).1
Patiënten die een verhoogd risico lopen op CME vóór de ingreep voorlichten is belangrijk, omdat het hun ontsteltenis zal helpen verlichten als de complicatie zich voordoet. Van bepaalde intraoperatieve complicaties, zoals een kapselruptuur achteraan en achtergehouden lensmateriaal, is ook bekend dat ze de incidentie van CME verhogen.2
Hieronder volgen enkele parels die u in gedachten moet houden wanneer u cataractchirurgiepatiënten comanageert.
RED FLAGS
Voorgestelde etiologische factoren voor postoperatieve CME zijn onder meer ontsteking, vitreomaculaire tractie, en vasculaire instabiliteit. De primaire etiologie lijkt ongereguleerde ontstekingsmediatoren in het oog en het glasvocht te zijn ten gevolge van chirurgische manipulatie. Deze mediatoren (bv. leukotriënen en prostaglandines) verstoren de barrières tussen bloed en glasvocht en tussen bloed en netvlies, wat leidt tot een verhoogde permeabiliteit.3 De typische timing van het begin van CME kan te wijten zijn aan de tijd die deze ontstekingsmediatoren nodig hebben om de achterkant van het oog te bereiken vanuit het voorste oogsegment.
Verdenking voor CME wordt ingegeven door verminderde VA of metamorfopsie die niet kan worden verklaard door andere etiologie geassocieerd met cataractchirurgie, inclusief residuele refractiefout, cornea-oedeem, lens malpositie, of posterieure capsulaire opacificatie.
Visueel significante CME is relatief ongewoon, en komt voor in 0,1% tot 3,5% van de ogen na cataractchirurgie.4-6 Niet-visueel significant macula-oedeem komt veel vaker voor. Het wordt gezien in 3% tot 41% van de ogen geëvalueerd met OCT en in 20% tot 55% van de ogen geëvalueerd met fluoresceïne-angiografie.7
De VA en symptomen van de patiënt moeten de noodzaak voor OCT-beeldvorming bepalen. Wazig zien in afwezigheid van andere bevindingen vereist zorgvuldig fundus dilated onderzoek en maculaire OCT (figuur 1). Routinematige beeldvorming bij alle patiënten kan sommige patiënten met asymptomatische CME identificeren en leiden tot onnodige behandeling en angst bij de patiënt.
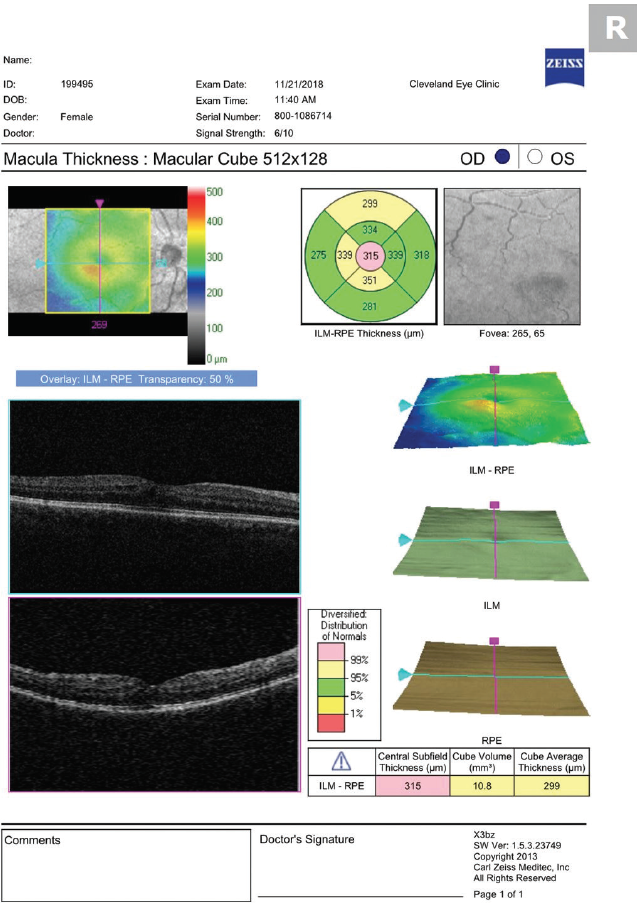
Figuur 1. OCT uitgevoerd 30 dagen na cataractoperatie toont milde CME.
TREKKING VAN CME
Er is geen consensus die de optimale behoefte aan preventie of behandeling van CME definieert. Profylactische behandeling met een plaatselijk niet-steroïdaal anti-inflammatoir geneesmiddel (NSAID) vóór een cataractoperatie bleek de incidentie van CME postoperatief te verminderen; de visuele effecten van CME die optraden waren echter niet significant op de lange termijn (>3 maanden).8
Recentelijk werd dexamethason intraoculaire suspensie 9% (Dexycu, Eyepoint Pharmaceuticals) door de FDA goedgekeurd voor injectie achter de iris ten tijde van cataractchirurgie. Deze formulering bleek veilig en effectief te zijn bij de behandeling van ontstekingen die optreden na cataractchirurgie en kan een alternatief zijn voor postoperatieve instillatie van steroïdendruppels.9
Prophylactische postoperatieve topische ontstekingsremmende medicatie vermindert de incidentie van CME. Een analyse van 30 gerandomiseerde klinische onderzoeken, waaronder ongecompliceerde cataractchirurgie bij niet-diabetische patiënten, toonde aan dat postoperatieve topische NSAID’s de kans op het ontwikkelen van CME aanzienlijk verminderden in vergelijking met postoperatieve topische corticosteroïden.10 Uit die analyse bleek ook dat een combinatie van corticosteroïden en NSAID’s superieur was aan topische corticosteroïden alleen.
Indien een patiënt CME ontwikkelt ondanks profylactische behandeling, kan de aandoening over het algemeen worden behandeld met topische medicatie. Hoewel het oedeem in de loop van enkele maanden vaak vanzelf verdwijnt, is een topische behandeling met NSAID’s effectief in het verminderen van door OCT waargenomen CME en kan het visueel herstel na de operatie versnellen in vergelijking met een placebo.11 De combinatie van een corticosteroïd en een NSAID lijkt ook beter te zijn dan een van beide ontstekingsremmende geneesmiddelen alleen. In één studie was de gemiddelde verbetering in Snellen VA over 3 maanden 1,6 lijnen bij patiënten die een NSAID kregen, 1,1 lijnen bij patiënten die een steroïd kregen, en 3,8 lijnen bij patiënten die een combinatie kregen.12
In onze praktijk schrijven we prednisolonacetaat 1% en ketorolac 0,5% voor, vier keer per dag te gebruiken tot CME verdwenen is, gevolgd door een taper van 3 weken. We verminderen beide op aanraden van de netvliesgroep waarmee we werken (drie keer per dag gedurende 1 week, dan twee keer per dag gedurende 1 week, gevolgd door een keer per dag gedurende 1 week). Wees niet ongerust als de ernst van CME verergert vlak na het begin van de topische therapie. Net zoals het oedeem later optreedt (vermoedelijk door de tijd die ontstekingsmediatoren nodig hebben om het netvlies vanuit het voorste oogsegment te bereiken), duurt het ook enige tijd voordat medicijnen het netvlies vanaf het oogoppervlak bereiken (figuren 2 en 3).
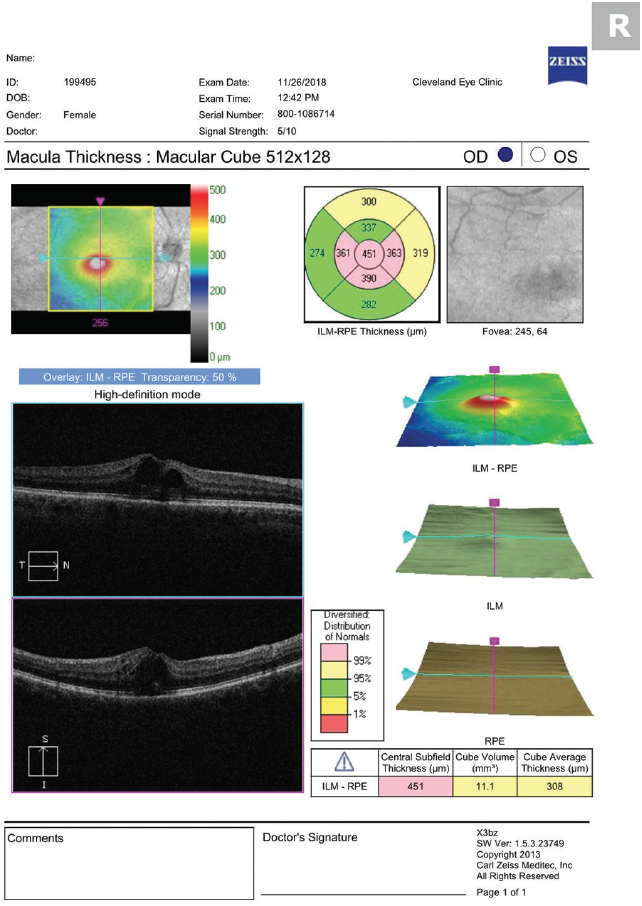
Figuur 2.
Figuur 3. OCT, 5 dagen na het begin van de behandeling met prednisolonacetaat en ketorolac viermaal daags, toont verergering van CME.

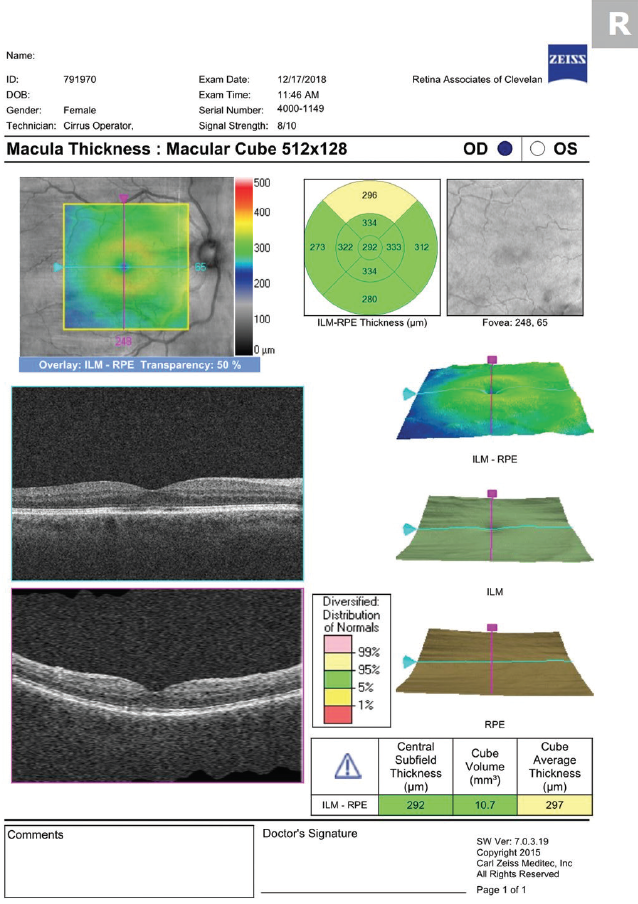
Figuur 3. OCT uitgevoerd 1 maand na aanvang van de behandeling toont resolutie van CME.
Recalcitrante CME vereist vaak verdere interventie voor visueel herstel. Als structurele (OCT bevindingen) en functionele (VA) verbeteringen niet optreden binnen 1 maand na topische behandeling, is verwijzing naar een retinaspecialist geïndiceerd. Perioculaire steroïdeninjecties (subtenon en retrobulbar) blijken oedeem te verminderen en de gezichtsscherpte te verbeteren bij CME die refractair is voor topicale behandeling.13 Intraoculaire steroïdeninjecties en intravitreale implantaten met verlengde afgifte hebben ook de resultaten verbeterd bij patiënten met chronische CME.14
Anti-VEGF injecties hebben ook hun nut bewezen bij de behandeling van chronische CME. Uit een multicenter retrospectieve studie bleek dat 72% van de ogen met refractaire CME die werden behandeld met ten minste één intravitreale injectie met bevacizumab (Avastin, Genentech) na 12 maanden een verbetering van het gezichtsvermogen en een vermindering van de gemiddelde centrale maculaire dikte hadden.15
In sommige gevallen moeten chirurgische methoden worden gebruikt om CME te behandelen. Chirurgische verwijdering van achtergebleven lensmateriaal kan bijvoorbeeld nodig zijn om hardnekkige CME te verhelpen. Pars plana vitrectomie heeft ook geresulteerd in verbeterde visuele resultaten voor CME die niet op medische behandeling heeft gereageerd.16
Notaalpunten
Bij de comanagement van cataractchirurgiepatiënten loont het de moeite om veel voorkomende complicaties zoals CME te herkennen en te weten hoe te handelen wanneer deze worden ontdekt.
Om kort te gaan, identificeer preoperatief risicopatiënten (patiënten met diabetes, epiretinaal membraan, uveïtis of netvliesaderocclusie). Wees u ook bewust van intraoperatieve complicaties die het risico op CME kunnen verhogen (bijv. ruptuur van het achterste kapsel, achtergebleven lensfragmenten). Sluit andere oorzaken van postoperatieve wazigheid uit, en voer een zorgvuldig verwijdingsonderzoek en een maculaire OCT uit om CME vast te stellen. Informeer en stel de patiënt gerust dat CME een behandelbare aandoening is. Behandel plaatselijk met NSAID’s en steroïden, en verwijs naar een retinaspecialist voor verdere interventie als CME hardnekkig is.
1. Henderson BA, Kim JY, Ament CS, Ferrufino-Ponce ZK, Grabowska A, Cremers SL. Clinical pseudophakic cystoid macular edema. Risk factors for development and duration after treatment. J Cataract Refract Surg. 2007;33(9):1550-1558.
2. Kim SJ, Belair ML, Bressler NM, et al. A method of reporting macular edema after cataract surgery using optical coherence tomography. Retina. 2008;28(6):870-876.
3. Benitah NR, Arroyo JG. Pseudophakic cystoid macular edema. Int Ophthalmol Clin. 2010;50(1):139-153.
4. Powe NR, Schein OD, Gieser SC, et al. Synthesis of the literature on visual acuity and complications following cataract extraction with intraocular lens implantation. Cataract Patient Outcome Research Team. Arch Ophthalmol. 1994;112(2):239-252.
5. Greenberg PB, Tseng VL, Wu WC, et al. Prevalence and predictors of ocular complications associated with cataract surgery in United States veterans. Oogheelkunde. 2011;118(3):507-514.
6. Clark A, Morlet N, Ng JQ, et al. Whole population trends in complications of cataract surgery over 22 years in Western Australia. Ophthalmology. 2011;118(6):1055-1061.
7. Bélair ML, Kim SJ, Thorne JE, et al. Incidentie van cystoïd maculair oedeem na cataractchirurgie bij patiënten met en zonder uveïtis met behulp van optische coherentie tomografie. Am J Ophthalmol. 2009;148(1):128-135.
8. Grzybowski A, Kim SJ. Corticosteroids substituted by nonsteroidal antiinflammatory drugs: is it justified by evidence-based medicine? J Cataract Refract Surg. 2016;42(3):510-511.
9. Donnenfeld E, Holland E. Dexamethasone intracameral drug-delivery suspension for inflammation associated with cataract surgery: a randomized, placebo-controlled, phase III trial. Ophthalmology. 2018;125(6):799-806.
10. Heier JS, Topping TM, Baumann W, et al. Ketorolac versus prednisolon versus combinatietherapie bij de behandeling van acuut pseudofakisch cystoïd maculair oedeem. Ophthalmology. 2000;107(11):2034-2039.
11. Kim SJ, Schoenberger SD, Thorne JE, Ehlers JP, Yeh S, Bakri SJ. Topical nonsteroidal antiinflammatory drugs and cataract surgery: a report by the American Academy of Ophthalmology. Ophthalmology. 2015;122(11):2159-2168.
12. Shelsta HN, Jampol LM. Farmacologische therapie van pseudofakisch cystoïd maculair oedeem: 2010 update. Retina. 2011;31(1):4-12.
13. Benhamou N, Massin P, Haouchine B, Audren F, Tadayoni R, Gaudric A. Intravitreal triamcinolone for refractory pseudophakic macular edema. Am J Ophthalmol. 2003;135(2):246-249.
14. Bellocq D, Korobelnik JF, Burillon C, et al. Effectiveness and safety of dexamethasone implants for post-surgical macular oedema including Irvine-Gass syndrome: the EPISODIC study. Br J Ophthalmol. 2015;99(7):979-983.
15. Arevalo JF, Maia M, Garcia-Amaris RA, et al; Pan-American Collaborative Retina Study Group. Intravitreal bevacizumab for refractory pseudophakic cystoid macular edema: The Pan-American Collaborative Retina Study Group results. Ophthalmology. 2009;116:1481-1487.
16. Cardone S, et al. The role of pars plana vitrectomy for pseudophakic cystoid macular edema. Invest Ophthalmol Vis Sci. 2003;44(7):3012.

Charles A. Roseman, OD
- Cleveland Eye Clinic, Ohio
- [email protected]
- Financial disclosure: None