THE ACID-BASE BEHAVIOUR OF AMINO ACIDS
This page looks at what happens to amino acids as you change the pH by adding either acids or alkalis to their solutions.
For simplicity, the page only looks at amino acids which contain a single -NH2 group and a single -COOH group.
Amino acids as zwitterions
Zwitterions in simple amino acid solutions
An amino acid has both a basic amine group and an acidic carboxylic acid group.
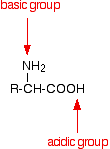
There is an internal transfer of a hydrogen ion from the -COOH group to the -NH2 group to leave an ion with both a negative charge and a positive charge.
This is called a zwitterion.

This is the form that amino acids exist in even in the solid state. Als je het aminozuur in water oplost, bevat een eenvoudige oplossing ook dit ion.
Een zwitterion is een verbinding zonder algemene elektrische lading, maar die afzonderlijke delen bevat die positief en negatief geladen zijn.
Een base aan een aminozuuroplossing toevoegen
Als je de pH van een oplossing van een aminozuur verhoogt door hydroxide-ionen toe te voegen, wordt het waterstofion verwijderd uit de -NH3+ groep.
![]()

Je zou met behulp van elektroforese kunnen aantonen dat het aminozuur nu als negatief ion bestond.
In zijn eenvoudigste vorm kan elektroforese gewoon bestaan uit een stukje bevochtigd filtreerpapier op een microscoopglaasje met aan elk uiteinde een krokodillenklem die aan een batterij is bevestigd. Een druppel aminozuuroplossing wordt in het midden van het papier geplaatst.
Hoewel de aminozuuroplossing kleurloos is, kan de positie ervan na enige tijd worden gevonden door het te besproeien met een oplossing van ninhydrine. Als men het papier laat drogen en vervolgens voorzichtig verwarmt, verschijnt het aminozuur als een gekleurde vlek.
Het aminozuur zou zich naar de anode (de positieve elektrode) blijken te bewegen.
Een zuur toevoegen aan een aminozuuroplossing
Als je de pH verlaagt door een zuur aan een oplossing van een aminozuur toe te voegen, neemt het -COO- deel van het zwitterion een waterstofion op.
![]()
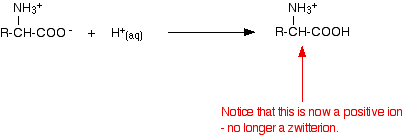
Dit keer zou het aminozuur tijdens de elektroforese naar de kathode (de negatieve elektrode) bewegen.
Het verschuiven van de pH van het ene uiterste naar het andere
Voorstel dat je begint met het ion dat we zojuist onder zure omstandigheden hebben gemaakt en daar langzaam alkali aan toevoegt.
Dat ion bevat twee zure waterstofgenen – die in de -COOH-groep en die in de -NH3+ groep.
De zuurste daarvan is die in de -COOH-groep, en die wordt dus als eerste verwijderd – en dan krijg je het zwitterion terug.
![]()
![]()
Dus als je precies de juiste hoeveelheid alkali hebt toegevoegd, heeft het aminozuur niet langer een netto positieve of negatieve lading. Dat betekent dat het tijdens de elektroforese noch naar de kathode noch naar de anode beweegt.
De pH waarbij dit gebrek aan beweging tijdens de elektroforese optreedt, staat bekend als het iso-elektrisch punt van het aminozuur. Deze pH varieert van aminozuur tot aminozuur.
Als je doorgaat met het toevoegen van hydroxide-ionen, krijg je de reactie die we al hebben gezien, waarbij een waterstofion wordt verwijderd uit de -NH3+ groep.
![]()
![]()