Fugas da natureza da prisão genética
p>Pós-modificação translacional: Uma breve visão geral
Como funciona a pós-modificação translacional?
Muitas modificações pós-tradução comuns
Impacto da pós-modificação translacional na saúde e na doença
h4>Uma breve visão geral
O que significa PTM?
Células precisam detectar e reagir a mudanças nas condições internas e externas. Um método usado para se ajustar a essas mudanças é a modificação química de proteínas. Mudanças químicas condicionais são retransmitidas de sensores para efetores através de modificações pós-tradução reversíveis (PTMs) de proteínas. Os PTMs desempenham um papel importante na modificação do produto final da expressão, contribuem para processos biológicos e condições de doença, desempenhando um papel fundamental em muitos processos celulares como diferenciação celular (1), degradação proteica, processos de sinalização e regulação, regulação da expressão gênica e interações proteína-proteína (2,3).
Como funciona a modificação pós-tradução translacional?
PTMs podem acontecer em qualquer etapa da vida útil da proteína. Muitas proteínas são modificadas logo após a tradução para mediar a dobra adequada ou para direcionar a proteína nascente para locais celulares distintos (como o núcleo ou membrana). Outras modificações ocorrem após a dobra e a localização são completadas para ativar ou inativar a atividade catalítica. As proteínas também são covalentemente ligadas a tags que visam a degradação de uma proteína. Elas são modificadas através de uma combinação de clivagem pós-tradução e a adição de grupos funcionais através de um mecanismo de passo de maturação ou ativação da proteína.
Onde ocorre a modificação pós-tradução? Os PTMs ocorrem em cadeias laterais distintas de aminoácidos ou ligações de peptídeos e são na maioria das vezes mediados por atividade enzimática. De fato, 5% do proteoma compreende enzimas que realizam mais de 200 tipos de PTMs (4). Essas enzimas incluem quinases, fosfatases, transferases e ligases, que adicionam ou removem grupos funcionais, proteínas, lipídios ou açúcares de ou para cadeias laterais de aminoácidos, e proteases, que clivam as ligações do peptídeo para remover seqüências específicas ou subunidades reguladoras. Muitas proteínas também podem se modificar usando domínios autocatalíticos, tais como os domínios autocinase e autoprotolíticos. Os PTMs também podem ser reversíveis, com base na natureza da modificação. Como exemplo, as fosfatases hidrolisam o grupo fosfato para removê-lo da proteína e reverter sua atividade biológica (Figura 1).
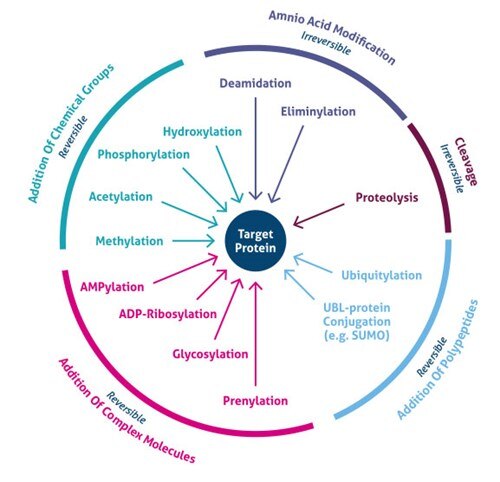
Figure 1. Tipos de modificações pós-tradlacionais (PTMs).
Mais comuns modificações pós-tradlacionais
Desenvolvimentos recentes nos métodos de espectrometria de massa (EM) têm permitido a identificação de milhares de locais de PTMs. Consequentemente, novas estratégias de enriquecimento revelaram a importância celular global de vários tipos de modificações (por exemplo, acetilação, ubiquilação, O-GlNac, glicosilação N-linked). Mais de 200 tipos diversos de PTMs são conhecidos atualmente (5,6), variando de pequenas modificações químicas (por exemplo, fosforilação e acetilação) à adição de proteínas completas (por exemplo, ubiquitylation, Figura 3).
Phosphorylation
Protein phosphorylation (Figura 2) é a modificação pós-tradução mais comumente estudada. Foi estimado que um terço das proteínas de mamíferos pode ser fosforilada, e esta modificação frequentemente desempenha um papel chave na modulação da função proteica. A fosforilação ocorre nos resíduos de serina, treonina e tirosina, agindo para regular a função da proteína, atividade enzimática, interações proteína-proteína, e localização da proteína. A fosforilação é catalisada por fosfatases e pode ser reversível – proteínas fosforiladas podem ser desfosforiladas por fosfatases protéicas.
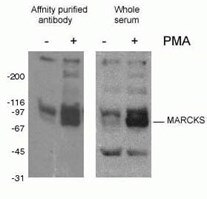
Figure 2. WB resultado do anticorpo phospho-Marcks (10018-3-AP, 1:1500) com células macrofágicas do rato J774 tratadas com PMA.
Glicosilação e Glicanálise
A maioria das proteínas que são sintetizadas nos ribossomas associados ao retículo endoplasmático são submetidas à glicosilação. Isso significa que uma ligação covalente de moitas de açúcar é adicionada à cadeia de polipéptidos. Os dois tipos mais comuns de glicosilação em eucariotas são a glicosilação ligada ao N – para asparagina, e a glicosilação ligada ao O – para serina e treonina.
Ubiquitinação
Ubiquitinação de proteínas significa que uma ubiquitina covalente é adicionada à lisina, cisteína, serina, treonina, ou diretamente à proteína N-terminus. A ubiquitina é uma proteína pequena (+/-8,6 kDa) expressa em quase todos os tipos de tecidos (Figura 3). A ubiquitina é uma reação enzimática catalisada por uma cascata de três enzimas (E1, E2, e E3). Isso fornece especificidade do substrato e etapas de ativação, conjugação e ligadura. As proteínas podem ser monoubiquitinadas (com uma molécula de ubiquitina) ou poli-ubiquitinadas. A poli-ubiquitinação ocorre quando moléculas adicionais de ubiquitina são adicionadas à molécula inicial de ubiquitina. A ubiquitinação através do proteoma pode marcar as proteínas para a degradação. Também é importante para a sinalização celular, a internalização das proteínas da membrana e o desenvolvimento e regulação da transcrição.

Figure 3. As células MDA-MB-453s foram submetidas à SDS PAGE seguida pela mancha ocidental com 10201-2-AP (anticorpo ubiquitina) a uma diluição de 1:600.
PTMs impacto na saúde e doença
A análise das proteínas e seus PTMs é particularmente importante para o estudo de doenças cardíacas, câncer, doenças neurodegenerativas e diabetes (7). Os principais desafios no estudo das proteínas modificadas pós-tradução são o desenvolvimento de métodos específicos de detecção e purificação. Felizmente, esses obstáculos técnicos estão sendo superados com uma variedade de novas e refinadas tecnologias proteômicas.
- Biologia química: proteínas vestidas.
- Conceitos em sumoilação: uma década depois.
- Análise proteômica nas neurociências.
- Os papéis das modificações pós-tradlacionais no contexto das Redes de Interação Proteína
- Decifrando uma rede global de modificações pós-tradlacionais funcionalmente associadas.
- PTMcode: a database of known and predicted functional associations between post-translational modifications in proteins.
- Citrullination: a posttranslational modification in health and disease.
